|
Asma
Tratamento da Asma
CORTICOIDE INALATÓRIO
Como a asma é considerada uma doença inflamatória crônica, o controle farmacológico da doença teve o seu enfoque direcionado nos últimos 45 anos para as drogas inalatórias anti-inflamatórias, deslocando do primeiro plano os broncodilatadores beta-agonistas.
Os corticoides inalatórios (CI) são os anti-inflamatórios mais eficazes no tratamento da asma.1,2 O uso generalizado dos CIs começou na década de 1980, coincidindo com a redução na mortalidade por asma.3 Os CIs são muito eficazes no controle dos sintomas em pacientes asmáticos de todas as idades e gravidade da doença. Eles atuam reduzindo os sintomas, melhorando a função pulmonar, diminuindo a hiper-responsividade das vias aéreas e elevando a qualidade de vida dos pacientes, além de reduzir o risco de exacerbações, hospitalizações e mortalidade relacionada à doença.4,5 Embora os CIs variem em potência e biodisponibilidade, a maior parte dos benefícios é alcançada mesmo em doses baixas. No entanto, a adesão ao tratamento com CI isoladamente costuma ser baixa, já que os pacientes não percebem efeitos imediatos. É importante que as recomendações das diretrizes para usar a menor dose efetiva de CIs sejam observadas. Os CIs devem ser prescritos para os pacientes de acordo com seu estado de controle da asma (Figura 1).
Figura 1 – Abordagem no Tratamento da Asma Baseada no Controle
ABORDAGEM NO TRATAMENTO DA ASMA BASEADA NO CONTROLE |
PARA ADOLESCENTES E ADULTOS |
Nível de Controle |
Ação de Tratamento |
Controlado |
Manter e encontrar sempre a melhor Etapa de controle |
Controlado Parcialmente |
Considere o stepping up para ganhar controle |
Não Controlado |
Step up até estar controlado |
Exacerbação |
Tratar conforme as recomendações |
INDAGAR SEMPRE SE: |
Os sintomas são realmente decorrentes da asma |
O paciente tem conhecimento pleno sobre a doença |
Faz controle ambiental |
Utiliza de forma correta os dispositivos de inalação (Técnica Correta) |
Faz uso correto da medicação prescrita |
|
Preferência para Controle e Alívio |
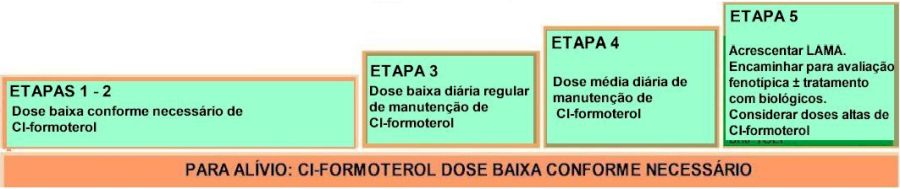 |
Controle e Alívio Alternativo |
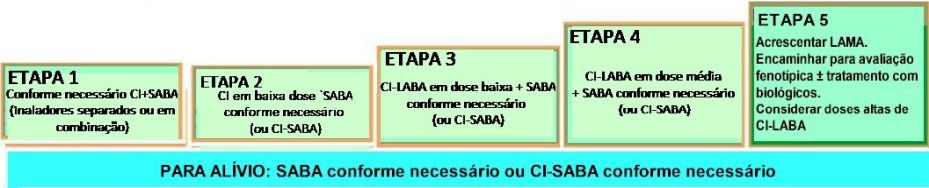 |
O primeiro estudo sobre corticoide em asma aguda foi publicado em 1900 por Solis-Cohen,6 que utilizou extrato bruto de glândula adrenal. O poder da cortisona no alívio das exacerbações e controle da asma crônica severa foi demonstrado pela primeira vez em 1950 por Haydon Carryer.7 Este autor aplicou 100 mg de cortisona por via intramuscular, diariamente, a um pequeno grupo de pacientes, através de estudo duplo-cego controlado, estabelecendo a alta eficácia da droga no tratamento da asma.
Mesmo antes do conhecimento da asma como doença inflamatória, o corticoide inalado já era aplicado. A primeira utilização foi feita por Gelfand8 em 1951, em cinco pacientes asmáticos, utilizando 50 mg de acetato de cortisona por duas semanas. Embora tenha ocorrido resposta favorável, o breve tratamento não foi suficiente para avaliação criteriosa.
Em 1958 Franklin et al. administraram prednisolona em spray, tendo como veículo o fréon.5 A dose total diária era de 18 mg e conseguiram parâmetros de função pulmonar semelhantes aos obtidos quando de doses mais elevadas por via oral. Em 1963 um estudo utilizou inalação de finas partículas de acetato de hidrocortisona em pó.9 Outro ensaio utilizando fosfato de dexametasona sódica 1 mg/dia através de nebulizações diminuiu substancialmente a frequência de exacerbações, em >80% dos pacientes, sendo que percentual equivalente conseguiu interromper ou reduzir substancialmente a utilização de corticoide oral,10 confirmando-se a eficácia do tratamento, embora ocorressem sinais de hipercorticismo, inclusive supressão da suprarrenal, provavelmente devido à elevada absorção sistêmica da medicação. Este fato levou os pesquisadores a buscar o corticoide inalado ideal, aquele que combina alta potência tópica com baixa biodisponibilidade sistêmica.
A avaliação da potência tópica de um corticoide é feita através do teste cutâneo de McKenzie.11 O princípio deste teste reside na indução de vasoconstrição intensa e branqueamento após a aplicação, sob oclusão, de soluções alcoólicas de corticoides com atividade tópica em pele humana intacta. O grau de branqueamento é determinado visualmente por dois observadores independentes e quantificado em números inteiros, relativamente a um esteroide de referência. Certos laboratórios empregam uma adaptação onde o esteroide é aplicado em microáreas (8 mm²), cada uma ocluída individualmente. Esta resposta cutânea se correlaciona com a atividade anti-inflamatória e é utilizada para classificar os corticoides por ordem de potência (Tabela 1).
Tabela 1 — Potência Anti-Inflamatória dos Corticoides Utilizados por Inalação
Medicamento |
Potência Tópica Skin Blanching** |
Ligação ao Receptor de Corticoide – Meia- Vida (h) |
Ligação ao Receptor de Corticoide – Afinidade |
Dipropionato de Beclometasona (BDP) |
600 |
7,5 |
13,5 |
|
980 |
5,1 |
9,4 |
|
330 |
3,5 |
1,8 |
Propionato Fluticasona (FP)
|
1200 |
10,5 |
18,0 |
Acetonido Triancinolona (TAA)
|
330 |
3,9 |
3,6 |
| **comparação com a dexametasona cujo valor é "1" no teste de McKenzie |
A primeira medicação utilizada em grande escala no tratamento tópico da rinite e asma foi o dipropionato de beclometasona (DPB)12 em 1972. É um corticoide halogenado, 5.000 vezes mais potente que a hidrocortisona pelo método de atividade tópica de McKenzie. Posteriormente outras surgiram como o valereato de betametasona, o acetonido de triancinolona, a flunisolida, a budesonida, o propionato de fluticasona e furoato de mometasona (Figura 2).
| |
Estrutura Química dos Corticoides Tópicos
Utilizados no Tratamento da Asma |
| Beclometasona |
Budesonida |
Triancinolona |
|
 |
|
C28H37ClO7 |
C25H34O6 |
C24H31FO6 |
| 9α-cloro-11ß,17,21-trihidroxi-16ß-metilpregna-1,4-diene-3,20-dione 17,21-dipropionato. |
16,17-butilidenebis(oxi)-11-,21-dihidroxipregna-1,4-diene-3,20-dione. |
9-fluoro-11,21-dihidroxi-16,17-[1-metiletilidenebis 9(oxi)]pregna-1,4-diene-3,20-dione. |
Fluticasona Furoato |
Fluticasona Propionato |
Mometasona |
|
|
|
C27H29F3O6S |
C25H31F3O5S |
C27H30C12O6 |
6α,11ß,16α,17α)-6,9-difluoro-17-[(2-furanylcarbonyl)oxy]-11-hydroxy-16-methyl-3-oxoandrosta-1,4-dien-17-yl 2-furoate
|
S-(fluorometil)6α, 9-difluoro-11ß,17-dihidroxi-16α- metil-3-oxoandrosta-1,4-diene-17ß-cabotiato, 17 propionato. |
9α, 21-dicloro-11ß, 17-diidroxi-16α-metil pregna-1,4-dieno-3, 20 diona 17-(2'-furoato). |
A budesonida é 980 vezes mais potente que a dexametasona e apresenta biodisponibilidade sistêmica de 11% devido à primeira e efetiva passagem da droga pelo fígado, enquanto que a dexametasona alcança 80%.13,14
O propionato de fluticasona é duas vezes mais potente que o dipropionato de beclometasona e três vezes mais potente que a budesonida15,16 e, devido ao extenso metabolismo hepático de primeira passagem, sua biodisponibilidade é insignificante. É lipofílico, o que proporciona maior penetração e deposição no tecido pulmonar bem como maior afinidade pelos receptores de glicocorticoides, ocupando-os por tempo mais prolongado.
O furoato de mometasona foi originalmente desenvolvido como um produto para uso dermatológico, apresenta alta potência tópica com baixa absorção sistêmica quando utilizado também por inalação, apresentando a vantagem de utilização em dose única diária. A mometasona é rápida e intensivamente metabolizada após administração, não havendo evidências de metabólitos nas fezes, urina e sangue, sendo a biodisponibilidade oral da mometasona inferior a 0,1% e a biodisponibilidade sistêmica inalada < 1%.
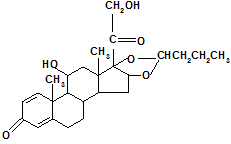
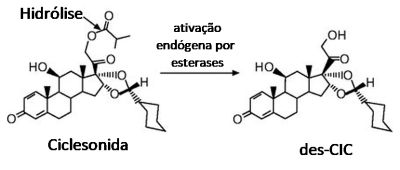
A ciclesonida (CIC) (não disponível para comercialização no Brasil) constitui uma outra geração de corticoides não halogenados, com alta ação local anti-inflamatória e com biodisponibilidade oral praticamente nula. A ciclesonida não é diretamente ativa pois trata-se de um pró-fármaco, um éster. A ciclesonida pró-fármaco tem um éster na posição C-21 que é hidrolisada pelas carboxil-esterases endógenas, formando o seu metabólito ativo, a desisobutiril-ciclesonida (des-CIC) (Figura 3). Esta ativação só ocorre nos pulmões, conceito de ativação on-site, sendo então rapidamente metabolizada, gerando produtos inativos,17 com mínimos efeitos sistêmicos.
Considerando-se a afinidade da dexametasona com o receptor de corticoide como um fator 100, a afinidade relativa de ligação da ciclesonida pró-fármaco com o receptor de corticoide oscila em 12, enquanto que a ciclesonida ativada apresenta grande afinidade com um fator de 1.210. Este valor para a budesonida é de 900.
Farmacocinética e Farmacodinâmica dos Corticoides Inalados
Para produzir ação terapêutica, os corticoides inalados devem estar presentes em concentrações apropriadas nos sítios de ação. O desempenho terapêutico depende da dose administrada, do dispositivo utlizado, do tamanho da partícula livrada, das propriedades farmacológicas da molécula, da distribuição na árvore brônquica, da concentração alcançada no sítio de ação, da solubilidade, da taxa e velocidade de absorção e da biotransformação. Levar em conta que
nem todos os dispositivos de inalação são adequados para todos os pacientes, uma vez que diferem em seu modo de funcionamento e exigem técnicas específicas de uso. A complexidade dessas técnicas varia conforme o dispositivo, demandando diferentes níveis de coordenação e compreensão cognitiva.18
Os mecanismos de ação pelos quais os corticoides inalados exercem seus efeitos farmacológicos são os mesmos para todas as drogas atualmente encontradas no mercado. Entretanto, o que pode influenciar o resultado final são as propriedades farmacocinéticas, que variam nas substâncias disponíveis.
As características farmacocinéticas englobam a biodisponibilidade, o clearance, a meia-vida, a conjugação lipídica e a capacidade de ligação proteica. Ainda não dispomos da droga ideal, cujas propriedades, entretanto, são sobejamente conhecidas. Este fármaco teria as seguintes características farmacocinéticas e farmacodinâmicas:
Farmacocinéticas – baixa biodisponibilidade oral, baixa biodisponibilidade sistêmica, alta biodisponibilidade pulmonar, alta afinidade com os receptores de corticoides, alta ligação proteica plasmática, estrutura de pró-fármaco, grande volume de distribuição, alta afinidade lipídica, rápido clearance sistêmico;
Farmacodinâmicas – alta potência intrínseca, alta deposição pulmonar, longo tempo de permanência em tecido broncopulmonar e ser constituída por pequenas partículas.
As propriedades farmacocinéticas dos corticoides utilizados por inalação, como a biodisponibilidade e o clearance, têm influência na segurança e eficácia. Os vários corticoides comercializados apresentam perfis farmacocinéticos variados, o que pode ser devido em parte aos dispositivos de inalação utilizados para a sua veiculação na árvore brônquica.
Os corticoides inalatórios atuais são bioestáveis nas vias aéreas e são inativados no fígado pelo citocromo P450 3A, especificamente as isoformas CYP3A4 e CYP3A5. A fração inalada que se deposita na orofaringe é deglutida, absorvida pelo trato gastrintestinal e submetida à inativação eficiente pelo efeito de primeira passagem hepática. Entretanto, a pequena fração depositada diretamente nas vias aéreas e alvéolos é absorvida sistemicamente sem sofrer metabolismo prévio significativo. Esta porção absorvida nos pulmões é transportada ao coração pela circulação brônquica e pulmonar. Como apenas cerca de um quarto do débito cardíaco passa pelo fígado em primeira passagem, a maior parte do corticoide de origem pulmonar é distribuída sistemicamente. Essa fração resulta em níveis plasmáticos circulantes de 0,1 a 1 nmol/l, que persistem por várias horas após a inalação, sendo gradualmente reduzidos pela recirculação contínua e inativação hepática subsequente (Figura 1).19,20
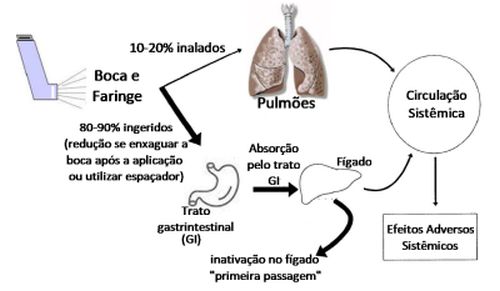
Figura 1 – Farmacocinética dos Corticoides Inalatórios. Reproduzida com modificações da ref.19
Existem particularidades significativas nas propriedades farmacocinéticas dos CIs atualmente utilizados na prática clínica. Todos são rapidamente eliminados do organismo, no entanto, apresentam biodisponibilidade oral variável (o quanto do medicamento é absorvido se deglutido) e, mais importante, na velocidade de absorção após a inalação nos pulmões. Segundo Derendorf et al. essas
propriedades parecem estar associadas ao tempo de permanência após inalação disponível nos pulmões e à solubilidade pulmonar, que parece ser a etapa limitante da velocidade no processo de absorção.21 Para uma ótima eficácia e segurança, o ideal corresponde à alta biodisponibilidade pulmonar associada à baixa biodisponibilidade oral.
Em geral, quanto maior a afinidade de ligação do receptor de glicocorticoide, mais potente é o CI. No entanto, a alta afinidade de ligação ao receptor não se traduz necessariamente em aumento da eficácia clínica devido a outros fatores farmacocinéticos e farmacodinâmicos envolvidos.22 Isso ocorre devido ao fato de que a afinidade de ligação representa apenas o ponto de partida, mas a forma como o medicamento se move pelo organismo (farmacocinética) e o que ele faz nos receptores ao longo do tempo (farmacodinâmica) são os elementos que, ao final, determinam o sucesso do tratamento.
Na Tabela 2 os principais corticoides por inalação e seus percentuais médios de deposição e absorção para cada tipo de dispositivo testado são apresentados.
Tabela 2 – Coticoides Inalatórios - Deposição e Absorção
Medicamento |
Tipo de Inalador |
Deposição Pulmonar (%) |
Deposição Orofaríngea (%) |
Biodisponibildade Oral (%) |
Observações |
Beclometasona |
MDI (sem espaçador) |
10–15% |
~80% |
~20% |
Uso do espaçador reduz deposição orofaringea |
DPI |
15–25% |
~60% |
~20% |
Varia com técnica e fluxo inspiratório |
Budesonida |
DPI (Turbuhaler) |
25–30% |
~50% |
~11% |
Boa deposição pulmonar com fluxo > 60 l/min |
MDI (com espaçador) |
20–30% |
~50% |
~11% |
Espaçador melhora eficácia e reduz absorção GI |
Fluticasona |
DPI (Diskus/Accuhaler) |
12–18% |
~70% |
<1% |
Boa biodisponibilidade oral >> menor risco sistêmico |
MDI |
10–15% |
~75% |
<1% |
Técnica de inalação crítica |
Mometasona |
DPI (Twisthaler) |
30–40% |
~50% |
<1% |
Alta eficácia com mínima absorção sistêmica |
Ciclesonida |
MDI |
52% |
~40% |
<1% |
Pró-fármaco ativado nos pulmões, baixa absorção sistêmica |
A biodisponibilidade oral depende do tamanho da partícula inalada. Partículas maiores que 10 µm depositam-se na boca e orofaringe, enquanto que partículas menores que 0,5 µm alcançam os alvéolos, sendo exaladas sem se depositar na superfície brônquica. Partículas de 1 a 5 µm são as ideais, depositando-se nas pequenas vias aéreas cumprindo o seu papel terapêutico. Para os pacientes com obstrução brônquica, como ocorre na asma, as partículas não devem ultrapassar 2 a 3 µm. A deposição dos aerossóis faz-se através da difusão Browniana.
O dipropionato de beclometasona apresenta biodisponibilidade oral de 26%,23 a budesonida 11%,14 a flunisolida 7%,24 enquanto que o propionato de fluticasona e a des-ciclesonida apresentam biodisponibilidade oral < 1%.25,26 Como a disponibilidade sistêmica de uma droga se correlaciona com a taxa de efeitos adversos, estas diferenças farmacocinéticas podem contribuir para variações no efeito farmacodinâmico.
O clearance (CL) quantifica a velocidade que os fluidos orgânicos (p. ex. sangue) depuram completamente uma substância.
CL = dose/área sob a curva
Um alto clearance sugere rápida eliminação da droga do organismo. É expresso como volume de fluido corporal por unidade de tempo (l.h-1 ou ml.min-1). O clearance de um componente é geralmente constante e pode frequentemente ser comparado ao fluxo sanguíneo hepático (81 l.h-1). Rápidos clearances sistêmicos limitam a biodisponibilidade dos corticoides por inalação, minimizando os efeitos colaterais. O clearance da maioria dos corticoides é semelhante ao fluxo sanguíneo hepático: 84 l.h-1 para a budesonida14 e 69 l.h-1 para a fluticasona27 e 89,2 l.h-1 para a mometasona.
Propriedades moleculares importantes parecem incluir alta atividade intrínseca e retenção no pulmão, juntamente com rápida eliminação sistêmica e baixa retenção tecidual em outras partes do corpo.
A conjugação dos corticoides por inalação com os lipídios aumenta o tempo de permanência da droga nos pulmões, proporcionando seu depósito para posterior lenta liberação. A budesonida e a
des-ciclesonida
formam ésteres conjugados de ácidos graxos nos pulmões, os quais são reversíveis in vivo,28,29 prolongando a ação anti-inflamatória e permitindo menor número de doses, favorecendo a aderência ao tratamento.
A meia-vida de um fármaco (t1/2) é o tempo necessário para que se reduza à metade a sua concentração inicial na circulação sistêmica. A t1/2 de qualquer fármaco está relacionada tanto à taxa de clearance (CL) sistêmco como ao volume de distribuição (Vd):
t1/2 = (0,693 x Vd)/CL
Em relação aos corticoides por inalação, o rápido clearance de qualquer quantidade da droga absorvida sistemicamente é o desejável, reduzindo os riscos dos efeitos adversos. As várias substâncias disponíveis diferem no tempo de meia-vida. A fluticasona tem meia-vida de eliminação de 7,8 h após administração endovenosa,27 a maior dentre as drogas disponíveis no mercado. A mometasona apresenta t1/2 de 5,8 h,30 enquanto que a budesonida 2,8 h31 e a flunisolida de 1,6 h.32 A ciclesonida apresenta t1/2 de 0,7 h, enquanto que a des-CIC ~3,5 h.32
A ligação dos corticoides às proteínas limita os efeitos farmacológicos da medicação, impedindo-a de unir-se ao seu receptor. Apenas a forma livre da substância é capaz de interagir com o receptor. Por outro lado, a ligação às proteínas pode ser considerada também outra forma de estocar a medicação, desde que esta ligação seja reversível, estabelecendo-se rápido equilíbrio. Alta afinidade de ligação proteica é uma vantagem pois determina uma baixa concentração de fármaco livre, melhorando o risco-benefício, reduzindo os efeitos sistêmicos da corticoidoterapia. A
ciclesonida é um corticoide por inalação com alta afinidade de ligação em relação às outras drogas disponíveis. A ligação proteica da flunisolida é de 80%, 87% para o dipropionato de beclometasona, 88% para a budesonida e 90% para a fluticasona,14,21,30 todas operando com frações livres que oscilam entre 10 e 29%.30 No que concerne a
ciclesonida
e
des-ciclesonida, sua fração livre é < 1% ~10 vezes menor que a fração livre dos outros fármacos. Esta baixa disponibilidade do
ciclesonida
reduz os potenciais efeitos sistêmicos, sendo uma vantagem quando relacionada às outras disponíveis.
Na Tabela 3 são apresentados os dados farmacocinéticos, físico-químicos e farmacológicos de uma revisão sobre segurança e eficácia dos corticoides inalatórios utilizados no tratamento da asma.
Tabela 3 – Características Físico-químicas, Farmacológicas e Farmacocinéticas dos Corticoides Inalatórios
CORTICOIDE |
Afinidade de ligação ao GR |
Administração pulmonar % |
Ligação às proteínas plasmáticas (%) |
Biodisponibilidade oral (%)) |
Lipofilicidade (log P) |
Depuração plasmática (l/h) |
Distribuição de volume (l) |
| Fluticasona Furoato DPI |
2989 |
– |
99,7 |
– |
4,17 |
65 |
608 |
| Mometasona Furoato DPI |
2100 |
11HFA-MDI |
99,5 |
<1 |
4,73 |
54 |
332 |
| Fluticasona Propionato DPI |
1775 |
20DPI |
99,3 |
≤1 |
3,89 |
69 |
318 |
| Dipropionato de Beclometasona (MDI) |
53 (1345) |
50-60HFA-MDI |
95,9 |
20 (40) |
4,59 (3,27) |
120 |
424 |
| Ciclesonida (des-CIC) MDI |
12 (1200) |
50HFA-MDI |
98,7 |
<1 (<1) |
3,2 (3,0) |
228 |
396 |
| Budesonida DPI |
935 |
15-30DPI |
91,4 |
11 |
2,32 |
84 |
180 |
| Triancinolona Acetonido MDI |
233 |
22HFA-MDI |
73,2 |
23 |
1,85 |
37 |
103 |
| Flunisolida MDI |
190 |
68HFA-MDI |
61,2 |
20 |
1,36 |
58 |
96 |
Tabela retirada da referência [34] e adaptada das referências [35, 36]
Referências:
01.Adelroth E, Rosenthal L, Johansson S, Linden M, Venge P. Inflammatory cells and eosinophilic activity in asthmatics investigated by bronchoalveolar lavage. The effects of antiasthmatic treatment with budesonide or terbutaline. Am Rev Respir Dis 1990; 142:91-9.
02.Montefort S, Feather I, Underwood J, Madden J, Porter C, Holgate ST, Howarth PH. The influence of inhaled fluticasone propionate on symptoms, pulmonary physiology and airway inflammation in asthma. Am J.Respir Crit Care Med 1995; 151(suppl):A40.
03.Suissa S, Ernst P, Benayoun S, Baltzan S, Cai B. Low-dose inhaled corticosteroids and the prevention of death from asthma. N Engl J Med 2000; 343:332-336.
04.National Asthma Education Program. Guidelines for the diagnosis and management of asthma. Bethesda, Md.: National Institutes of Health, 1991, DHMS publication (NIH) 91-3042.
05.Mygind N, Clark TJH. Topical Steroid Treatment for Asthma & Rhinitis. London, Ballière Tindall, 1980.
06.Solis-Cohen S. The use of adrenal substance in the treatment of acute asthma. JAMA 1900; 34:1164-66.
07.Carryer HM, Koelsche GA, Prickman LE, Maytum CK, Lake CF, Williams HL. Effects of cortisone on bronchial asthma and hay fever occurring in subjects sensitive to ragweed pollen. J Allergy 1950; 21:282-7.
08.Gelfand ML. Administration of cortisone by the aerosol method in the treatment of bronchial asthma. New Engl J Med 1951; 245:293-4.
09.Helm WH, Heyworth F. Bronchial asthma and chronic bronchitis treated with hydrocortisone acetate inhalations. Br Med J 1958; 2:765-8.
10.Bickerman H.A, Itkin SE. Aerosol steroid therapy and chronic bronchial asthma. J Am Med Ass 1963; 184:533-8.
11.McKenzie AW, Stoughton RB. Method for comparing percutaneous absorption of steroids. Arch Derm 1962; 86:608-10.
12.Brown HM, Storey G, George WHS. Beclomethasone dipropionate. A new steroid aerosol for the treatment of allergic asthma. Br Med J 1972; 1:585-90.
13.Brogden RN, McTavish D. Budesonide: An update of its pharmacological properties and therapeutic efficacy in asthma and rhinitis. Drugs 1992; 44:375-404.
14.Ryrfeldt A, Andersson P, Edsbacker S, Tonnesson M, Davies DE, Pauwels RA. Pharmacokinetics and metabolism of budesonide, a selective glucocorticoid. Eur Respir J 1982; 63(suppl 122):86-95.
15.Barnes NC, Marone G, DiMaria GU, Visser S, Utama I, Payne SL. A comparison of fluticasone propionate, 1 mg daily with beclomethasone dipropionate 2 mg daily in treatment of severe asthma. Eur Respir J 1993; 6:877-85.
16.Lundback B. Evaluation of fluticasone propionate (500 mcg/day) administered either as dry powder via diskhaler or pressurized inhaler. Respir Med 1993; 87:609-20.
17.Dietzel K, Engelstätter R, Keller. Ciclesonide: Na on-site-activated steroid. In Hansel TT, Barnes PJ. New Drugs for Asthma, Allergy and COPD. Prog Respir Res. Karger. 2001, vol 31. 91-93.
18.Laube BL, Janssens HM, de Jongh FH, Devadason SG, Dhand R, Diot P, Everard ML, Horvath I, Navalesi P, Voshaar T, Chrystyn H; European Respiratory Society; International Society for Aerosols in Medicine. What the pulmonary specialist should know about the new inhalation therapies. Eur Respir J 2011; 37:1308-31.
19.Barnes PJ. Inhaled Corticosteroids. Pharmaceuticals (Basel). 2010; 3:514-540.
20.Barnes PJ, Pedersen S, Busse WW. Efficacy and safety of inhaled corticosteroids. New developments. Am J Respir Crit Care Med 1998; 157(3 Pt 2):S1-53.
21.Derendorf H., Hochhaus G., Meibohm B., Mollmann H., Barth J. Pharmacokinetics and pharmacodynamics of inhaled corticosteroids. J Allergy Clin. Immunol 1998; 101:S440–S446.
22.Rossi GA, Cerasoli F, Cazzola M. Safety of inhaled corticosteroids: room for improvement. Pulm Pharmacol Ther 2007; 20:23–5.
23.Daley-Yates PT, Price AC, Sisson JR, Pereira A, Dallow N. Beclomethasone dipropionate:absolute bioavailability, pharmcokinetics and metabolism folowing intavenous, oral, intranasal and inhaled administration in man. Br J Clin Pharmacol 2001; 51:400-9.
24.Dickens GR, Wermeling DP, Matheny CJ et al. Pharmacokinetics of flunisolide administered via metered dose inhaler with and without a spacer device and following oral administration. Ann Allergy Asthma Immunol 2000; 84:528-32.
25.Thorsson L, Dahlstrom K, Edsbacker A, Kallen J, Paulson J, Wiren JE. Pharmacokinetics and systemic effects of inhaled fluiticasone propionate in healthy subjects. Br J Clin Pharmacol 1997; 43:155-61.
26.Mollmann H, Wagner M, Meibohm B et al. Pharmacokinetic and pharmacodynamic evaluation of fluiticasone propionate after inhaled administration. Eur J Clin Pharmacol 1998; 53:459-67.
27. Mackie AE, Ventresca GP, Fuller RW, Bye A. Pharmacokinetics of intravenous fluiticasone propionate in healthy subjects. Br J Clin Pharmacol 1996; 41:539-42.
28.Nave R, Sättele N, Meyer W, Fuhst R, Zrch K. Formation of fatty acid conjugates of ciclesonide-active principle in the rat lung after 4 week inhalation of ciclesonide. Am J Respir Crit Care Med 2003; 167:Suppl. 7, A771.
29.Miller-Larsson A, Mattsson H, Hjertberg E, Dahlback M, Tunek A, Brattsand R. Reversible fatty acid conjugation of budesonide. Novel mechanism for prolonged retention of topically applied steroid in airway tissue. Drug Metab Dispos 1998; 26: 623-30.
30.Szefler SJ. Pharmacokinetics of intranasal corticosteroids. J Allergy Clin Immunol 2001; 108: (1Suppl)S26-31.
31.Nave R, Bethke TD, Zech K et al. Pharmacokinetic profiles of ciclesonide and its active metabolite are similar in asthma patients and healthy subjects. Apresentado no 4th Triennial World Asthma Meeting 2004; Bancoc, Tailândia.
32.Kelly HW. Comparative potency and clinical efficacy of inhaled corticosteroids. Respir Care Clin N Am 1999; 5:537-53.
33.Rohatagi S, Derendorf H, Zech K, Nave R, Banerji D. PK/PD of inhaled corticosteroids: the risc/benefit of inhaled ciclosenide. J Allergy Clin Immunol 2003; 111: Suppl.2, S218.
34.Ye Q, He XO, D'Urzo A A. Review on the Safety and Efficacy of Inhaled Corticosteroids in the Management of Asthma. Pulm Ther 2017; 3:1–18.
35.Daley-Yates PT. Inhaled corticosteroids: potency, dose equivalence and therapeutic index. Br J Clin Pharmacol 2015; 80:372-80.
36.Kelly HW. Comparison of inhaled corticosteroids: an update. Ann Pharmacother 2009; 43:519-27.
|