|
Asma
Resposta Tardia da Asma
NEUTRÓFILOS — ASMA NEUTROFÍLICA – INFLAMAÇÃO T2 BAIXA
A asma é reconhecida como uma doença inflamatória alérgica, uma doença eosinofílica, com um aumento do número de eosinófilos ativados na mucosa das vias aéreas, no escarro e no sangue. A inflamação do Tipo 2 alta nas vias aéreas é caracterizada pela presença de citocinas IL-4, IL-5 e IL-13 que foram originalmente reconhecidas como sendo produzidas por células T auxiliares tipo 2 (Th2).
A hipótese que considera o eosinófilo a célula efetora-chave da patogênese da asma apresenta alguns pontos questionáveis:
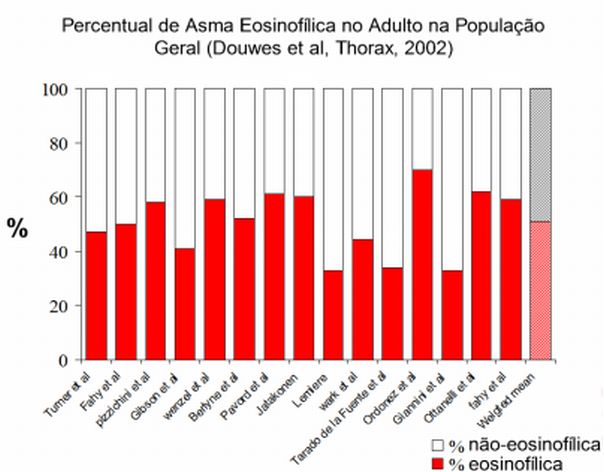
➭ A inflamação eosinofílica está presente na luz brônquica em apenas 50% dos pacientes com asma (Figura 1);1
➭ Mesmo a intensa inflamação eosinofílica da bronquite eosinofílica, esta não induz à asma;2
➭ Muitas exacerbações de asma ocorrem sem que haja eosinofilia nas vias aéreas;
➭ Ratos de laboratório deficientes em eosinófilos foram criados (knockout mouse) e esta modificação tem pouco impacto nos achados patológicos das vias aéreas, em resposta à sensibilização pela ovoalbumina.3
Na Figura 1 é apresentado um sumário da proporção de pacientes com asma eosinofílica e não eosinofílica de vários estudos da literatura compilados por Douwes et al.1 A inflamação eosinofílica está presente na luz brônquica em cerca de 50% dos pacientes com asma, na média. O perfil inflamatório da asma não eosinofílica quando analisado na maioria dos estudos parece ser muito semelhante ao descrito para a asma ocupacional, relacionado ao aumento de neutrófilo e níveis de IL-8 e consistente com a ativação de mecanismos imunes inatos, mediando o processo inflamatório em indivíduos com asma não eosinofílica.
Percentual de Asma Eosinofílica no Adulto na População |
Geral (Douwes et al. Thorax, 2002) |
.
Dados confirmaram a considerável heterogeneidade dos fenótipos da asma, sendo que vários indivíduos exibem doença brônquica caracterizada por neutrofilia no escarro. Os neutrófilos foram implicados nas exacerbações da asma induzidas por vírus,4,5 na asma severa esteroide dependente, na asma noturna,6-8 na asma em fumantes, na asma ocupacional (agentes de baixo peso molecular),9-13 nos casos de asma desencadeadas por poluentes como partículas de escapamento de diesel, ozônio ou óxido de nitrogênio,14 na asma quase fatal e fatal15,16 e naqueles com a presença bacteriana persistente e respostas Th1 e Th17 potentes.17,18
A asma não eosinofílica pode ser observada em pacientes com asma grave, mas também em aproximadamente metade dos pacientes com asma leve a moderada.19 Em pacientes com asma leve, aqueles com inflamação neutrofílica, especialmente os sem inflamação eosinofílica coexistente, são menos propensos a ter respostas de curto prazo aos corticoides do que aqueles com inflamação eosinofílica.20
A patogênese da inflamação das vias aéreas em que predominam os neutrófilos em adultos com asma pode refletir resposta deficiente de eliminação bacteriana pelos neutrófilos observada com a idade, resultando em dano celular, hipersecreção de muco e remodelação das vias aéreas. No entanto, em crianças com asma, os neutrófilos estão menos associados às características adversas da doença e é possível que nestas os neutrófilos sejam menos patogênicos.21 Os neutrófilos estão também relacionados à asma em pacientes obesos20 e
naqueles portadores da síndrome da apneia obstrutiva do sono.22-24
 O uso de contagens de neutrófilos no escarro induzido para definir a inflamação neutrofílica não é ideal porque os neutrófilos, ao contrário dos eosinófilos, são um constituinte normal das células recuperadas no escarro induzido, e o ponto de corte que sugere um aumento na contagem de neutrófilos não foi definido. A contagem de neutrófilos no escarro de indivíduos saudáveis é altamente variável, com média de 30 a 35%,25 oscilando na asma neutrofílica entre 40% e 76% das células do escarro.26-29 (Figura 2) Nair et al.27 propuseram que o termo 'asma neutrofílica' deveria ser limitado aos pacientes que apresentam em pelo menos duas ocasiões contagens de neutrófilos no escarro ≥5 x 10-9/L. Scheich et al.30 efetuaram estudo retrospectivo com 508 pacientes de asma nos quais realizaram a técnica de escarro induzido que foi considerada bem-sucedida, e utilizaram análise de regressão logística múltipla.
A inflamação eosinofílica foi definida por proporção de eosinófilos no escarro ≥ 3%, enquanto o fenótipo neutrofílico foi caracterizado por proporção de neutrófilos ≥ 76%.30
No entanto, estudos sobre assinaturas genéticas induzíveis por IL-13 em escovados epiteliais brônquicos e contagens de células no escarro demonstraram que a asma T2 baixa representa entre 20% e 50% dos casos de asma, sendo frequentemente observada em pacientes que nunca receberam corticoides.30,31 O uso de contagens de neutrófilos no escarro induzido para definir a inflamação neutrofílica não é ideal porque os neutrófilos, ao contrário dos eosinófilos, são um constituinte normal das células recuperadas no escarro induzido, e o ponto de corte que sugere um aumento na contagem de neutrófilos não foi definido. A contagem de neutrófilos no escarro de indivíduos saudáveis é altamente variável, com média de 30 a 35%,25 oscilando na asma neutrofílica entre 40% e 76% das células do escarro.26-29 (Figura 2) Nair et al.27 propuseram que o termo 'asma neutrofílica' deveria ser limitado aos pacientes que apresentam em pelo menos duas ocasiões contagens de neutrófilos no escarro ≥5 x 10-9/L. Scheich et al.30 efetuaram estudo retrospectivo com 508 pacientes de asma nos quais realizaram a técnica de escarro induzido que foi considerada bem-sucedida, e utilizaram análise de regressão logística múltipla.
A inflamação eosinofílica foi definida por proporção de eosinófilos no escarro ≥ 3%, enquanto o fenótipo neutrofílico foi caracterizado por proporção de neutrófilos ≥ 76%.30
No entanto, estudos sobre assinaturas genéticas induzíveis por IL-13 em escovados epiteliais brônquicos e contagens de células no escarro demonstraram que a asma T2 baixa representa entre 20% e 50% dos casos de asma, sendo frequentemente observada em pacientes que nunca receberam corticoides.30,31
Lembrar, no entanto, que enquanto pacientes com ≥ 3% de eosinófilos no escarro são considerados 'eosinofílicos', até 60% de neutrófilos no escarro também podem estar presentes.30-33
Os pacientes com asma neutrofílica são menos atópicos e geralmente apresentam níveis mais baixos da fração exalada de óxido nítrico (FeNO), geralmente < 30 partes por bilhão34 e < 300 eosinófilos/µL no sangue.
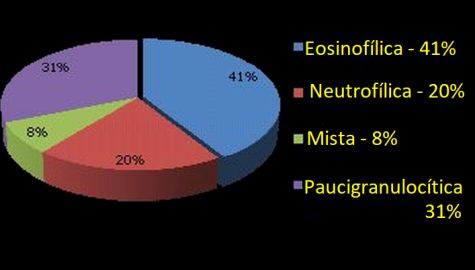 Os neutrófilos estão presentes principalmente nos pacientes com inflamação tipo 2 (T2) baixa – asma moderada / severa e nas exacerbações da doença. Embora o seu papel na patogênese da asma leve não tenha sido estabelecido, existem evidências circunstanciais que demonstram também a sua participação no processo inflamatório brônquico de pacientes com asma leve intermitente e persistente.29 Simpson et al.,33 através de estudo por escarro induzido, analisaram os subfenótipos inflamatórios de um grupo de cerca de 93 pacientes com asma, com idade média de 42 anos (18–77 anos), VEF1 de 76% ± 20, detectaram 41% de pacientes com asma eosinofílica, 20% neutrofílica, 8% mista e 31% paucigranulocítica.
O fenótipo paucigranulocítico é normalmente o mais encontrado.35 (Figura 3) A proporção de neutrófilos no escarro continua sendo o melhor meio de determinar o fenótipo neutrofílico, visto que a contagem de neutrófilos no sangue é pouco preditiva de neutrofilia no escarro. Os neutrófilos estão presentes principalmente nos pacientes com inflamação tipo 2 (T2) baixa – asma moderada / severa e nas exacerbações da doença. Embora o seu papel na patogênese da asma leve não tenha sido estabelecido, existem evidências circunstanciais que demonstram também a sua participação no processo inflamatório brônquico de pacientes com asma leve intermitente e persistente.29 Simpson et al.,33 através de estudo por escarro induzido, analisaram os subfenótipos inflamatórios de um grupo de cerca de 93 pacientes com asma, com idade média de 42 anos (18–77 anos), VEF1 de 76% ± 20, detectaram 41% de pacientes com asma eosinofílica, 20% neutrofílica, 8% mista e 31% paucigranulocítica.
O fenótipo paucigranulocítico é normalmente o mais encontrado.35 (Figura 3) A proporção de neutrófilos no escarro continua sendo o melhor meio de determinar o fenótipo neutrofílico, visto que a contagem de neutrófilos no sangue é pouco preditiva de neutrofilia no escarro.
A única função dos neutrófilos é a sua capacidade de fagocitar e destruir microrganismos, com o propósito de impedir a invasão dos tecidos pelos microrganismos. Ocorrendo a invasão, a inflamação é desencadeada através da produção e liberação de suas citocinas e quimiocinas para ativar outras células envolvidas no processo.
Os neutrófilos representam o tipo de célula imune mais abundante no sangue,
respondendo por 50 a 70% de todas as células brancas circulantes e são gerados na medula óssea sob o controle de fatores de transcrição-chave como C / EBPa (CCAAT/Enhancer-Binding Protein), PU.1, Gfi-1 (Growth Factor Independent 1 Transcriptional Repressor), e C / EBPε.36,37 A produção diária de neutrófilos em um ser humano adulto normal é extensa, oscilando em torno de 1 a 2 × 1011 células. Eles não 'residem nos tecidos saudáveis' ao contrário dos macrófagos, mas migram rapidamente para os locais onde ocorre dano tecidual e participam das defesas imunes inatas, como principal célula fagocítica e microbicida.38 Eles são reconhecidos há longa data como células imunes de vida curta (meia-vida de 6–12 h)39 especializadas em eliminar patógenos por meio de seu alto potencial fagocítico e da secreção de grânulos citotóxicos, uma vez recrutados aos tecidos.40
O G-CSF (Granulocyte Colony Stimulating Factor) é essencial para ajustar a produção de neutrófilos para atender às necessidades aumentadas durante as infecções, mas o G-CSF não é absolutamente necessário para a granulocitopoiese porque ratos com deleção do gene do G-CSF têm aproximadamente 25% de granulocitopoiese residual e geram totalmente neutrófilos maduros.41 A produção de neutrófilos é amplamente regulada pela taxa de apoptose de neutrófilos nos tecidos.
Uma vez liberados da medula óssea para a circulação, os neutrófilos 'vigiam' os vasos sanguíneos e navegam em direção à inflamação detectando gradientes quimiotáticos como o CXCL-8, que podem ser liberados devido à interação de padrões moleculares microbianos ou associados a danos. Durante esse processo, os neutrófilos usam sua polaridade celular, regulada por Rho Guanosina Trifosfatases (Rho GTPases), visando realizar o movimento ameboide para atingir com precisão o local da inflamação.42 A fim de permitir a migração através de matrizes extracelulares densas, os neutrófilos liberam proteinases, como a elastase de neutrófilos (EN) e a proteinase 3 (PR3), para clivar componentes da matriz extracelular, como elastina, fibronectina, vitronectina, laminina e colágeno.43
Os neutrófilos são células arredondadas com cerca de 7 micra de diâmetro e facilmente reconhecidos no esfregaço de sangue periférico 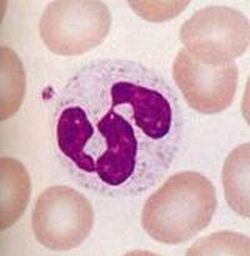 (Figura 4) pela forma de seu núcleo, motivo pelo qual recebeu a designação inexata de polinucleares, quando na verdade trata-se de um único núcleo com várias zonas estreitadas, formando pontes de substância nuclear. O citoplasma ligeiramente acidófilo é repleto de grânulos heterogêneos. Os maiores são chamados de primários ou grânulos azurófilos, são peroxidase positivos, enquanto que os menores, denominados de grânulos secundários ou grânulos específicos são peroxidase negativos. São células de vida curta, seis a oito horas apenas, ligadas primariamente à defesa contra infecção e injúria tecidual. Devido a esta propriedade, os neutrófilos necessitam se mover com rapidez para alcançar o sítio da inflamação, no espaço extravascular. Para isto, expressam em sua superfície receptores para um grande número de agentes quimiotáxicos. Várias proteínas de adesão foram também identificadas nos neutrófilos, dentre elas as de particular importância, as β2-integrinas LFA-1 e Mac-1 que são ligantes para a ICAM-1 e ICAM-2.44 (Figura 4) pela forma de seu núcleo, motivo pelo qual recebeu a designação inexata de polinucleares, quando na verdade trata-se de um único núcleo com várias zonas estreitadas, formando pontes de substância nuclear. O citoplasma ligeiramente acidófilo é repleto de grânulos heterogêneos. Os maiores são chamados de primários ou grânulos azurófilos, são peroxidase positivos, enquanto que os menores, denominados de grânulos secundários ou grânulos específicos são peroxidase negativos. São células de vida curta, seis a oito horas apenas, ligadas primariamente à defesa contra infecção e injúria tecidual. Devido a esta propriedade, os neutrófilos necessitam se mover com rapidez para alcançar o sítio da inflamação, no espaço extravascular. Para isto, expressam em sua superfície receptores para um grande número de agentes quimiotáxicos. Várias proteínas de adesão foram também identificadas nos neutrófilos, dentre elas as de particular importância, as β2-integrinas LFA-1 e Mac-1 que são ligantes para a ICAM-1 e ICAM-2.44
São duas as características dos neutrófilos quanto aos mediadores que produz:
➭ A primeira, ligada à fagocitose seguida pela morte em fagolissoma e digestão de bactérias, fungos e partículas estranhas, inclui enzimas. Para permitir a migração através de matrizes extracelulares densas, os neutrófilos liberam proteinases, como a elastase neutrofílica e a PR3, para clivar componentes da matriz extracelular, como elastina, fibronectina, vitronectina, laminina e colágeno.43 Os neutrófilos também podem exterminar fungos e bactérias por degranulação, um processo no qual os neutrófilos liberam extracelularmente Espécies Reativas de Oxigênio (ROS).43,45 Em resposta a estímulos infecciosos, os neutrófilos formam armadilhas extracelulares (NETs) para proteger o hospedeiro;39,46,47 no entanto, essas estruturas também contribuem para lesões e inflamações nos tecidos.48-50 As NETs são compostas de DNA de fita dupla (dsDNA) e proteínas de histonas modificadas, como a histona H3 citrulinada (Cit-H3), além de proteínas granulares, como elastase de neutrófilos (NE) e mieloperoxidase (MPO).51 Quando de asma grave, o aumento de neutrófilos pode intensificar a formação de NETs, em um processo conhecido como NETose.52--54 O dsDNA liberado pelas NETs ativa a exacerbação alérgica da asma induzida por rinovírus,55 enquanto a NETose induzida por doses baixas de lipopolissacarideos (LPS) estimula a inflamação alérgica das vias aéreas em resposta a alérgenos como os ácaros da poeira doméstica.56
➭ A segunda, congrega mediadores que atraem e ativam mais neutrófilos. Estes mediadores incluem mediadores lipídicos (LTB4) e citocinas Th1 ( IFN-γ, TNF-a), citocinas Th17 (IL-17 e Il-22), mediadores inflamatórios inatos ( IL-1ß, IL-6, IL-8/(CXCL-8).
Na inflamação alérgica em humanos, o acúmulo de neutrófilos quando de provocação alérgica precede ao dos eosinófilos. Além do mais, o pico de acúmulo de neutrófilos ocorre em aproximadamente oito horas, o que corresponde ao início da fase tardia da doença. Entretanto, nenhuma relação causal entre neutrófilo e sintomas de doença alérgica ou asma até hoje foi bem estabelecida. Existe a possibilidade de que o dano tecidual causado pelos neutrófilos ativados no início do processo possa contribuir para a patogenicidade da inflamação alérgica, particularmente nas superfícies mucosas, a longo termo.
Na asma, as funções dos neutrófilos podem estar alteradas ainda mais (Figura 5).21 Pacientes com asma neutrofílica apresentam uma super regulação sistêmica da expressão de α-defensinas e proteases de neutrófilos57 e aumento da formação de NET.58 Além disso, os neutrófilos isolados de pacientes com asma neutrofílica exibem migração aumentada, embora velocidade reduzida de fagocitose em comparação com controles saudáveis in vitro.59 Por outro lado, adultos com asma neutrofílica exibem respostas imunes inatas alteradas, como redução da síntese de interferon antiviral (IFN),51,60 deficiências anti-inflamatórias associadas à redução de galectina-3 e IL-1RA / IL-1β,61 expressão aumentada de receptores de padrão molecular associados a patógenos, como TLR-2 e TLR-4,62 expressão elevada de inflamassomas, como NLRP362 e liberação elevada de mediadores pró-inflamatórios, como CXCL-8 e IL-1β.61 Na asma neutrofílica várias células descendentes mieloides são recrutadas nas vias aéreas onde interagem para ativar células Th17 e promover a infiltração de neutrófilos.63
.
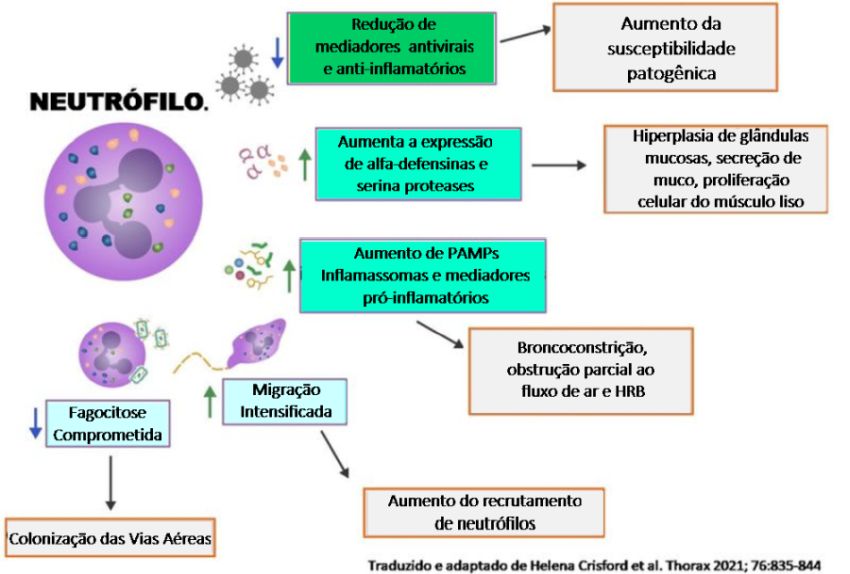
A asma neutrofílica acomete pacientes mais velhos (acima de 25 anos), com um número total de células inflamatórias elevado quando comparado ao de pacientes com padrão eosinofílico.34 É mais comum em mulheres e em pacientes não atópicos.64 O padrão de elevação de neutrófilos no escarro é mais encontrado em obesos, naqueles que fumam, na poluição ambiental pelo ozônio e por matéria particulada do diesel, durante as exacerbações da doença e frequentemente durante as infecções virais que acometem o trato respiratório superior.65 Nas crianças um aumento significante de neutrófilos é detectado no escarro induzido durante as exacerbações.66,67 Esses irritantes podem causar lesões nas vias aéreas e em seguida levar à liberação de receptores do tipo toll-like (TLRs). A análise do escarro em pacientes com asma neutrofílica demonstra um aumento na expressão de receptores imunes inatos, incluindo TLR2, TLR4 e CD14, bem como citocinas pró-inflamatórias IL-8 e IL-1ß.68 Sabe-se que a ativação do TLR induz a uma mudança em direção às respostas Th1 e Th17 levando à geração de IL-8, IL-1ß, IFN-γ e TNF-a.69 IL-1ß é uma citocina imune inata típica, e um aumento na IL-1ß das vias aéreas (como resultado de exacerbações anteriores) foi associado à inflamação sistêmica (observada por um aumento na IL-6) e ao risco de futuras exacerbações, desencadeando um ciclo vicioso.70
Em crianças a neutrofilia das vias aéreas é menos frequente mas, quando ocorre, está associada às bactérias,71 e ao contrário da asma neutrofílica do adulto, a neutrofilia na asma grave pediátrica parece ter um perfil de mediadores inflamatórios diferente sem a IL-17.72,73 Os estudos em crianças pertencem às coortes de asma grave e não à doença leve a moderada.
Em adultos os neutrófilos do escarro (vias aéreas) estão associados à asma mais severa. Moore et al.74 detectaram que pacientes com mais de 60% (mediana) de neutrófilos no escarro tendiam a ser mais velhos, do sexo masculino, tinham asma de início tardio, doença pulmonar mais grave, recebiam prescrições de doses mais altas de corticoides inalados, eram mais propensos a tomar corticoide oral, tinham maior incidência de hospitalização por asma (55% vs 28%)75 e mais comorbidades, como hipertensão, osteoporose e doença do refluxo gastresofágico.74,75
A resistência à insulina parece amplificar a associação negativa entre asma e obesidade,76 com ativação da expressão do fator de crescimento de transformação beta 1 (TGF-ß1) no epitélio brônquico, estimulando a produção de tecido conjuntivo pelos fibroblastos, levando à remodelação das vias aéreas77 o que pode afetar a neutrofilia das vias aéreas.21,76
O recrutamento dos neutrófilos nos pulmões é multifatorial e depende de mediadores quimiotáxicos de neutrófilos, como o leucotrieno B4 (LTB4); anafilotoxinas – fragmentos C3a e C5a e quimiocinas Cysteine-X-Cysteine (CXC) de células residentes das vias aéreas como a IL-8, conhecida como Cysteine-X-Cysteine Chemokine Ligand (CXCL8; GRO-a (Growth-Related Oncogene a) também denominado de CXCL1; e ENAP 78 (Epithelial-Neutrophil Activating Peptide 78) ou CXCL5. Níveis elevados de mediadores ativos dos neutrófilos, como IL-8, elastase de neutrófilos, MMP-9, promovem migração dos neutrófilos, inflamação persistente, remodelação tecidual e resistência aos corticoides,70 IL-17A, LTB4, GM-CSF e TNF-a, foram detectados no sangue, no lavado broncoalveolar (LBA) e epitélio brônquico de pacientes com asma neutrofílica.78
Foi demonstrado que o número de neutrófilos aumenta em pacientes com asma grave em comparação com fenótipos de asma leve, e a inflamação neutrofílica é resistente ao corticoide.79-81 Os neutrófilos, que são a maior fonte de LTB4, estão aumentados no exalado respiratório de pacientes com asma severa.82 O leucotrieno B4 é gerado pela via da 5-lipoxigenase (5-LO) e atua na quimioatração dos neutrófilos, via receptor de leucotrieno B4 expressos na superfície dos neutrófilos. Estudos em pacientes com asma grave demonstraram inflamação persistente das vias aéreas. Apesar do tratamento crônico de longo prazo com corticoide, as concentrações de LTB4 detectadas nestes pacientes estavam aumentadas no LBA, sobrenadante do escarro induzido e em tecidos quando comparadas ao grupo controle sem asma e em pacientes com asma leve / moderada.80,83
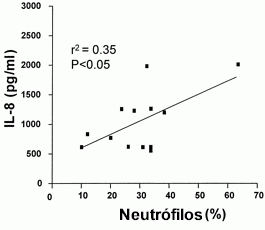 As concentrações de IL-8 se encontram elevadas no escarro de pacientes com asma e se correlacionam com o número de neutrófilos (Figura 6).27,33,81 A expressão do gene da IL-8 e a presença da proteína foram evidenciadas nas células epiteliais brônquicas e esta citocina pode ser induzida por infecção viral, pelo fumo, por alérgenos e poluentes aéreos. A IL-8 é uma quimiocina potente para neutrófilos produzida por células epiteliais, macrófagos e células T ativadas, sob estímulo de IL-17, TNF-a e infecção. Ela ativa os neutrófilos via receptor específico acoplado de baixa afinidade proteína-G (receptor para quimiocinas CXC [CXCR]-1) e também pelo receptor [CXCR]-2 e dentre suas várias atividades está a desgranulação dos neutrófilos com liberação de elastase neutrofílica, lactoferrina, beta-glucoronidase e mieloperoxidase. A IL-8 também upregulate a expressão de duas integrinas (CD11b/CD18 e CD11c/CD18) durante a exocitose dos grânulos específicos.84,85 A IL-8 ativa 5-lipoxigenase do neutrófilo, com a formação do LTB4 e do ácido 5-hidroxieicosatetraenoico e induz à produção de PAF.86 As concentrações de IL-8 se encontram elevadas no escarro de pacientes com asma e se correlacionam com o número de neutrófilos (Figura 6).27,33,81 A expressão do gene da IL-8 e a presença da proteína foram evidenciadas nas células epiteliais brônquicas e esta citocina pode ser induzida por infecção viral, pelo fumo, por alérgenos e poluentes aéreos. A IL-8 é uma quimiocina potente para neutrófilos produzida por células epiteliais, macrófagos e células T ativadas, sob estímulo de IL-17, TNF-a e infecção. Ela ativa os neutrófilos via receptor específico acoplado de baixa afinidade proteína-G (receptor para quimiocinas CXC [CXCR]-1) e também pelo receptor [CXCR]-2 e dentre suas várias atividades está a desgranulação dos neutrófilos com liberação de elastase neutrofílica, lactoferrina, beta-glucoronidase e mieloperoxidase. A IL-8 também upregulate a expressão de duas integrinas (CD11b/CD18 e CD11c/CD18) durante a exocitose dos grânulos específicos.84,85 A IL-8 ativa 5-lipoxigenase do neutrófilo, com a formação do LTB4 e do ácido 5-hidroxieicosatetraenoico e induz à produção de PAF.86
A inflamação neutrofílica pode também ser induzida pela IL-17 liberada pelo linfócito Th17.
Foi demonstrado que as células Th17 secretam IL-17A, IL-17F e IL-22, que geralmente são resistentes aos corticoides.87 No escarro induzido de pacientes com asma, principalmente nos com maior gravidade, existe um aumento nas células Th17,88 medido através de aumento no IL-17 mRNA (1 de 6 membros da família IL-17 de citocinas). Estes achados se correlacionam com aumento da IL-8. A IL-17A também está aumentada no escarro de pacientes com asma muito severa.88 A IL-17A libera das células epiteliais das vias aéreas a IL-8, GRO-a e TNF-a que participam na orquestração da inflamação neutrofílica da asma (Figura 7). O tabagismo também está associado à inflamação neutrofílica na asma,89 derivada da ativação epitelial e macrofágica83 e à expressão aumentada de IL-17A, IL-6 e IL-8, com IL-17A se correlacionando com a IL-8 e a contagem de neutrófilos. Siew et al.90 demonstraram que a expressão de IL-17A, IL-6 e IL-8 e o número de neutrófilos foram significativamente mais elevados na mucosa brônquica de fumantes com asma em comparação com as de não fumantes.
O epitélio medeia processos inflamatórios complexos e em resposta a insultos das vias aéreas, as 'alarminas' IL-25, IL-33 e TSLP são liberadas por células epiteliais danificadas, embora também existam outras procedências de alarminas. As alarminas IL-25, IL-33 e TSLP estimulam respostas inflamatórias por meio de inúmeras vias, incluindo endótipo tipo 2 (IL-4, IL-13 e IL-5) e outros, como vias conduzidas por Th1 – ou Th17 – (IL-17), resultando em vários desdobramentos fisiopatológicos que podem levar a sintomas de asma e exacerbações.91,92 Na asma neutrofílica, as alarminas assumem um papel diferente — promovendo resposta inata pró-inflamatória e modulando Th1/Th17. Em resposta à agressão ao epitélio das via aéreas, as alarminas IL-33 e TSLP são liberadas por células danificadas. A IL-33 promove inflamação por meio de ligação ao seu receptor ST2 (IL1R1), presente em múltiplas células, compreendendo neutrófilos, eosinófilos, basófilos, mastócitos e macrófagos, redundando na secreção de citocinas T2 e não T2.93 A TSLP possui amplo espectro de ação que vai além da tradicional indução da diferenciação de células CD4+ Th2. Essa citocina não só ativa diversas células imunes e não imunes (como DCs, ILC2, células T CD8+, células B, eosinófilos, mastócitos e neurônios sensoriais), como exibe papel de efetor Th1, promovendo o recrutamento de células via quimiocinas como CXCL10 e CXCL11, o que é relevante em pacientes com asma severa. Em suma, a TSLP modula a ativação de mastócitos e induz tanto citocinas e quimiocinas do tipo 2 (T2) quanto não T2.94-96
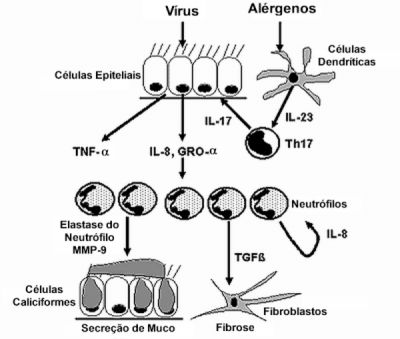 Os vírus podem estimular as células epiteliais a liberar IL-8 e GRO-a. Os alérgenos podem estimular as células dendríticas a liberar IL-23, que recrutam células Th17 que secretam IL-17 que atua sobre o epitélio brônquico. As células epiteliais sob a ação da IL-17 liberam o TNF-a que torna maior a inflamação e ainda a IL-8 e o GRO-a, que recrutam mais neutrófilos para as vias aéreas. Estes, por sua vez, liberam mais IL-8 e o TGF-b (Transforming Growth Factor-b) que ativam os fibroblastos os quais determinam fibrose, participando do processo de remodelamento brônquico; liberam a elastase do neutrófilo que atua degradando colágeno, elasina e fibronectina e a matrix metaloproteinase (MMP)-9 que atua em sinergia com a elastase e ainda estimulam a secreção de muco pelas células caliciformes (Figura 7).97 Os vírus podem estimular as células epiteliais a liberar IL-8 e GRO-a. Os alérgenos podem estimular as células dendríticas a liberar IL-23, que recrutam células Th17 que secretam IL-17 que atua sobre o epitélio brônquico. As células epiteliais sob a ação da IL-17 liberam o TNF-a que torna maior a inflamação e ainda a IL-8 e o GRO-a, que recrutam mais neutrófilos para as vias aéreas. Estes, por sua vez, liberam mais IL-8 e o TGF-b (Transforming Growth Factor-b) que ativam os fibroblastos os quais determinam fibrose, participando do processo de remodelamento brônquico; liberam a elastase do neutrófilo que atua degradando colágeno, elasina e fibronectina e a matrix metaloproteinase (MMP)-9 que atua em sinergia com a elastase e ainda estimulam a secreção de muco pelas células caliciformes (Figura 7).97
O recrutamento de neutrófilos na asma severa envolve ainda a interação com moléculas de adesão expressas no endotélio dos vasos pulmonares e brônquicos, dentre elas, a ICAM-1 e a E-selectina, que interagem com selectinas expressas nas superfícies dos neutrófilos.97
Os neutrófilos são células de vida curta nos tecidos (1 a 2 horas) e sua vitalidade nos pulmões é garantida por fatores de crescimento como o GM-CSF e o G-CSF. O neutrófilo também promove a desgranulação das células caliciformes e produz MUC-5mRNA.
A colonização bacteriana nas vias aéreas de pacientes com asma severa pode colaborar para a asma neutrofílica98,99 e tem sido associada à deficiente fagocitose bacteriana e à apoptose celular por macrófagos.100,101 O microbioma das vias aéreas é alterado na asma neutrofílica, com a colonização por Haemophilus e Moraxella muito mais comum e hipotetizada como responsável pelas respostas Th17.102-105
Tratamento
Há longo tempo sabemos da ineficiência dos corticoides na asma neutrofílica, mesmo quando de altas doses, ao contrário do que se observa na asma alérgica eosinofílica.106 O aumento de neutrófilos nos pacientes com asma severa não parece ser devido às altas doses de corticoides que fazem uso, apesar de ser bem conhecida a ação inibitória desta droga na apoptose dos neutrófilos.87 O aumento no número de neutrófilos no escarro é um parâmetro de perda de controle no tratamento da asma, ou agravamento da doença, indicando a necessidade de busca de novos medicamentos para tratamento. Na atualidade a fenotipagem para a diferenciação mais precoce do tipo de inflamação T2 alta e T2 baixa é proposta antes de se iniciar o tratamento, permitindo melhor orientaçãp na terapêutica. Por exemplo, pacientes com asma paucigranulocítica evidenciam melhor função pulmonar. No entanto, apesar de não apresentarem inflamação eosinofílica ou neutrofílica, os processos de remodelação quanto o de obstrução das vias aéreas persistem. Isso define um fenótipo clínico sintomático, refratário ao tratamento com corticoides.107,108
Na eventualidade de sintomas persistentes, a fenotipagem precoce com eosinófilos do sangue periférico e FeNO permite identificação de inflamação T2 alta ou baixa, para análises baseadas em evidências sobre melhores opções de tratamento.109,110
Os anticolinérgicos na asma funcionam como medicação complementar em pacientes mal controlados, geralmente com asma severa e têm proporcionado significante redução na obstrução do fluxo aéreo, com melhora na função respiratória, diminuindo o risco de exacerbações com alívio nos sintomas. São medicamentos seguros, com longa história no tratamento da DPOC, há mais de 30 anos, sendo a associação uma contingência natural. O brometo de tiotrópio demonstrou eficácia clínica em pacientes com importante obstrução das vias aéreas, geralmente associada à inflamação neutrofílica das vias aéreas.111 Está indicado na asma como tratamento adicional e independe de marcadores sistêmicos de inflamação.112 Os anticolinérgicos também podem reduzir a resposta inflamatória induzida pela acetilcolina, bloqueando a migração de neutrófilos.113
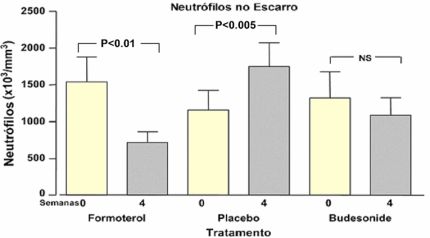 Estudos evidenciaram a atuação dos broncodilatadores de longa ação neste tipo de inflamação, podendo ser benéfico na prevenção das exacerbações da asma.114 O formoterol reduziu significativamente os níveis de IL-8 e o número de neutrófilos no escarro de pacientes com asma quando comparados aos do grupo placebo (Figura 8). O formoterol inibe a adesão de neutrófilos em vênulas pós-capilares de vias aéreas de ratos,115 atenuando desta forma a inflamação neutrofílica. Um outro estudo demonstrou que o salmeterol reduz de forma significante o número de neutrófilos e a quantidade de mieloperoxidase em fragmentos de biópsia brônquica de pacientes com asma.116 Provavelmente, talvez seja este um dos motivos de sua boa atuação na asma moderada e severa persistente, quando associados aos corticoides por inalação. Anticorpos que bloqueiam a IL-17, a IL-23 e antagonistas [CXCR]2 são capazes de reduzir o influxo de neutrófilos e poderão se constituir em novas estratégias para o tratamento. Estudos evidenciaram a atuação dos broncodilatadores de longa ação neste tipo de inflamação, podendo ser benéfico na prevenção das exacerbações da asma.114 O formoterol reduziu significativamente os níveis de IL-8 e o número de neutrófilos no escarro de pacientes com asma quando comparados aos do grupo placebo (Figura 8). O formoterol inibe a adesão de neutrófilos em vênulas pós-capilares de vias aéreas de ratos,115 atenuando desta forma a inflamação neutrofílica. Um outro estudo demonstrou que o salmeterol reduz de forma significante o número de neutrófilos e a quantidade de mieloperoxidase em fragmentos de biópsia brônquica de pacientes com asma.116 Provavelmente, talvez seja este um dos motivos de sua boa atuação na asma moderada e severa persistente, quando associados aos corticoides por inalação. Anticorpos que bloqueiam a IL-17, a IL-23 e antagonistas [CXCR]2 são capazes de reduzir o influxo de neutrófilos e poderão se constituir em novas estratégias para o tratamento.
Os macrolídeos são drogas passíveis de utilização no tratamento da inflamação não eosinofílica das vias aéreas, particularmente na asma neutrofílica refratária. Simpson et al.117 através de um estudo duplo-cego, randomizado, placebo controlado, em pacientes com asma refratária, demonstraram que a claritromicina, na dose de 500 mg duas vezes ao dia por oito semanas, reduzia significativamente a IL-8 das vias aéreas e o número de neutrófilos, com melhora dos índices de qualidade de vida. Reduções nas concentrações de MMP-9 e elastase também ocorreram, sugerindo downregulation na ativação neutrofílica e na liberação de mediadores. Gibson et al.118 publicaram estudo duplo-cego, randomizado, placebo controlado, avaliando o efeito da azitromicina nas exacerbações da asma e na qualidade de vida em adultos com asma persistente mal controlada, conhecido como estudo AMAZES
(Asthma and Macrolides: Azithromycin Efficacy and Safety). Constou de ensaio clínico de mais de 48 semanas com amostra de 420 pacientes, utilizando 500 mg duas vezes por semana. Os resultados do estudo AMAZES destacaram que a azitromicina é um tratamento potencial para pacientes com asma não eosinofílica (neutrofílica e paucigranulofílica), para os quais há um limitado arsenal terapêutico porém, houve melhora na qualidade de vida relacionada à asma. O mecanismo de ação pode ser devido às ações antibacterianas ou anti-inflamatórias, que incluem inibição de NF-kB e outros fatores de transcrição, tal como redução na migração ou função de neutrófilos. Além disso, foi demonstrado que os macrolídeos podem exercer ações antivirais,119 apresentam a capacidade de restaurar a sensibilidade do corticoide ao inibir a via PI3K, restauram a ação da histona desacetilase 2 (HDAC2)120 e possibilitam a atenuação do TNF-a, receptores de TNF e IL-1ß, IL-6 através de respostas imunes pela IL-17.121-123 É importante ressaltar que o tratamento complementar com azitromicina em pacientes com asma mal controlada mostrou-se uma estratégia de tratamento custo-efetiva.124
O tezepelumabe é um anticorpo que tem como alvo a TSLP (thymic stromal lymphopoietin), uma citocina superexpressa nas vias aéreas de asmáticos graves, derivada do epitélio, que afeta diversos tipos de células imunes nas respostas inflamatórias tipo 2. Em paciente com asma os níveis de TSLP estão correlacionados com a resistência das vias aéreas, gravidade da doença e resistência aos corticoides.125,126 Dentre os anticorpos monoclonais, o tezepelumabe é o biológico (imunoglobulina G2λ) que foi aprovado para o tratamento da asma grave, sem restrições de fenótipos ou biomarcadores. É o único que pode ser usado para tratar asma em indivíduos sem perfil T2 alto, o que é particularmente importante, relacionado à inflamação neutrofílica e perfil T1/T17.127-129
A TSLP é liberada pelas células epiteliais das vias aéreas em resposta a "agressões" ubiquitárias: vírus (especialmente rinovírus), alérgenos, poluentes, fumaça e estresses mecânicos.
Ao contrário da IL-4, IL-5 ou IL-13 que atuam "a jusante" e são específicas da via T2, a TSLP é uma das primeiras moléculas a ser liberada. Ela "determina" para onde a resposta inflamatória vai se direcionar.
Atacar os fatores desencadeantes iniciais, antes que a inflamação se ramifique em vias T2 e não T2, é a estratégia que permite benefícios transversais.
O tezepelumabe se constituiu no primeiro biológico a mostrar eficácia em uma população mais ampla de pacientes, embora modesta, com asma tipo 2 baixa grave.130 Corren et al. em análise agrupada post hoc dos estudos PATHWAY e NAVIGATOR demonstraram que o tezepelumabe reduz as exacerbações em adultos com asma grave não controlada, incluindo o subgrupo tipo 2 baixa.131 O tezepelumabe representa, portanto, a primeira classe de biológicos "antialarmina" e abre um novo capítulo no manejo da asma grave. Entretanto, outros anticorpos monoclonais humanizados que tem como alvo a TSLP (CM326, TQC2731) se encontram em avaliação pré-clinica de segurança, bem como o Verekitug um anticorpo monoclonal recombinante totalmente humano contra a imunoglobulina G1 (IgG1) que se liga ao receptor da TSLP (TSLP-R) e inibe a sinalização pró-inflamatória iniciada pela TSLP.
Vários antagonistas de IL-33, outra alarmina podem resultar na melhora dos sintomas e na prevenção de exacerbações ao conter a inflamação persistente e impedir a remodelação das vias aéreas.
IL-33 também está envolvida na asma neutrofílica, embora por mecanismos diferentes dos clássicos Th2. Ela atua p. ex., ativando
células inatas tipo 2 (ILC2s) de maneira “plástica”, levando-as a secretar IL-17A e IL-8, em vez de IL-5 e IL-13 e
estimula neutrófilos diretamente via receptores ST2, promovendo quimiotaxia, liberação de NETs e citocinas inflamatórias (IL-1ß, TNF-a). Anticorpos anti-IL-33 humanos encontram-se em fase de avaliação como o astegolimabe e o itepequimabe.132 O astegolimabe é um anticorpo monoclonal IgG 2 humano que inibe seletivamente o receptor IL-33/ST2. O astegolimabe reduziu as exacerbações da asma em uma ampla população de pacientes, incluindo aqueles com baixo nível de eosinófilos, com asma grave e mal controlada. Astegolimabe foi seguro e bem tolerado.132,133 O bloqueio da IL-33 com itepequimabe apresentou poucos eventos adversos e possibilitou melhora na função respiratória em pacientes com asma moderada a grave.134
A Termoplastia Brônquica (TB) é uma possibilidade terapêutica na Etapa 5 do Gudeline GINA135 voltado para pacientes com asma grave, onde ocorre o remodelamento das vias aéreas e anormalidades da musculatura lisa. Trata-se de um procedimento por broncoscopia cujo objetivo é a redução da massa muscular e ablação nervosa, com redução concomitante da espessura da membrana basal reticulada através da aplicação de três sessões com pulso de radiofrequência. Prospectivamente os resultados mostraram redução nas exacerbações em pacientes com asma grave não controlada e fenótipo de obstrução crônica ao fluxo de ar, com menos hospitalizações, sugerindo melhor controle da asma em diferentes fenótipos e melhor qualidade de vida.136-138 A TB também pode representar uma forma alternativa de tratamento para pacientes com asma grave que não podem usar ou não se qualificam para tratamento com imunobiológicos para asma (p. ex., aqueles com doença não eosinofílica).136 Entretanto, se deve ter cautela na sua indicação, observando certos fatores de exclusão: asma com risco de vida, doença sinusal crônica, doenças respiratórias como o enfisema, uso de imunossupressores, agentes bloqueadores adrenérgicos ou anticoagulantes e história no ano anterior de três ou mais internações por asma, três ou mais infecções do trato respiratório inferior e quatro ou mais pulsos de corticoide oral para tratar a asma e VEF1 <60%.135
Referências
01.Douwes J, Gibson P, Pekkanen J Pearce N. Non-eosinophilic asthma: importance and possible mechanisms. Thorax 2002; 57:643-48.
02.Brightling CE, Symon FA, Birring SS, Bradding P, Wardlaw AJ, Pavord ID.
Comparison of airway immunopathology of eosinophilic bronchitis and asthma. Thorax 2003; 58:528-32.
03.Humbles AA, Lloyd CM, McMillan SJ. A critical role for eosinophils in allergic airways remodeling. Science 2004; 305:1776-9.
04.Norzila MZ, Fakes K, Henry RL, Simpson J, Gibson PG: lnterleukin-8 secretion and neutrophil recruitment accompanies induced sputum eosinophil activation in children with acute asthma. Am J Respir Crit Care Med 2000; 161:769-774.
05.John V, Fahya B, Kimb KW, Liub J, Homer A, Bousheya B: Prominent neutrophilic inflammation in sputum from subjects with asthma exacerbation. J Allergy Clin Immunol 1995; 95:843-852.
06.Ordonez CL, Shaughnessy TE, Matthay MA, Fahy JV. Increased neutrophil numbers and IL-8 levels in secretions in acute severe asthma: clinical and biological significance. Am J Respir Crit Care Med 2000; 161:1185-90.
07.Martin RJ, Cicutto LC, Smith HR, Ballard RD, Szefler SJ. Airways inflammation in nocturnal asthma. Am Rev Respir Dis 1991; 143:351-357.
08.Carrol N, Carello S, Cooke C, James A. Airway structure and inflammatory cells in fatal attacks of asthma. Eur Respir J 1996; 709:19:709-15.
09.Fabbri LM, Boschetto P, Zocca E, Milani G, Pivirotto F, Plebani M, Burlina A, Licata B, Mapp CE.
Bronchoalveolar neutrophilia during late asthmatic reactions induced by toluene diisocyanate. Am Rev Respir Dis 1987; 136:36–42.
10.Sastre J, Banks DE, Lopez M, Barkman HW, Salvaggio JE. Neutrophil chemotactic activity in toluene diisocyanate (TDI)-induced asthma. J Allergy Clin Immunol 1990; 85:567–572.
11.Park HS, Jung KS, Kim HY, Nahm DH, Kang KR. Neutrophil activation following TDI bronchial challenges to the airway secretion from subjects with TDI-induced asthma. Clin Exp Allergy 1999; 29:1395-1401.
12.Leigh R, Hargreave FE. Occupational neutrophilic asthma. Can Respir J 1999; 6:194-196.
13.Tarlo SM, Lemiere C. Occupational Asthma. N Engl J Med Overseas Ed 2014; 370:640-649.
14.Hekking P-PW, Bel EH. Developing and Emerging Clinical Asthma Phenotypes. J Allergy Clin Immunol 2014; 2:671–680.
15.Sur S, Crotty TB, Kephart GM, Hyma BA, Colby TV et al. Sudden onset fatal asthma: distinct entity with few eosinophils and relatively more neutrophils in the airways submocosa? Am Rev Respir Dis 1993; 148:712-19.
16.Woodruff PG, Fahy JV. A role for neutrophils in asthma? Am J Med 2002; 112:498-500.
17.Essilfie A-T, Simpson JL, Dunkley ML, et al. Combined Haemophilus influenzae respiratory infection and allergic airways disease drives chronic infection and features of neutrophilic asthma. Thorax 2012; 67:588-99.
18.Wood LG, Simpson JL, Hansbro PM, Gibson PG. Potentially pathogenic bacteria cultured from the sputum of stable asthmatics areassociated with increased 8-isoprostane and airway neutrophilia. Free Radic Res 2010; 44:146-154.
19.McGrath KW, Icitovic N, Boushey HA, Lazarus SC, Sutherland ER, Chinchilli VM, Fahy JV. A large subgroup of mild-to-moderate asthma is persistently noneosinophilic. Am J Respir Crit Care Med 2012; 185:612-619.
20.Fahy JV. Type 2 inflammation in asthma — present in most, absent in many. Nat Rev Immunol 2015; 15:57-65.
21.Crisford H, Sapey E, Rogers GB, Taylor S, Nagakumar P, Lokwani R, Simpson JL. Neutrophils in asthma: the good, the bad and the bacteria. Thorax 2021; 76:835-844.
22.European Network for Understanding Mechanisms of Severe Asthma. The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma. Eur Respir J 2003; 22:470-7.
23.Antonopoulou S, Loukides S, Papatheodorou G, et al. Airway inflammation in obstructive sleep apnea: is leptin the missing link? Respir Med 2008; 102:1399–1405.
24.Holguin F, Bleecker ER, Busse WW, Calhoun WJ, Castro M, Erzurum SC, Fitzpatrick AM, Gaston B, Israel E, Jarjour NN, Moore WC, Peters SP, Yonas M, Teague WG, Wenzel SE.
Obesity and asthma: an association modified by age of asthma onset. J Allergy Clin Immunol 2011; 127:1486–1493.e2.
25.Belda J, Leigh R, Parameswaran K, O'Byrne PM, Sears MR, Hargreave FE. Induced sputum cell counts in healthy adults. Am J Respir Crit Care Med. 2000; 161:475–478.
26.Chung KF. Neutrophilic asthma: a distinct target for treatment. Lancet Respir Med 2016; 10:765–767.
27.Nair P, Aziz–Ur–Rehman A, Radford K. Therapeutic implication of ‘neutrophilic asthma'. Curr Opin Pulm Med 2005; 21:33–38.
28.Ray A, Kolls JK. Neutrophilic inflammation in asthma is associated with disease severity. Trends Immunol 2017; 38:948–954.
29.Green RH, Brightling CE, McKenna S, et al. Asthma excerbations and sputum eosinophil: a randomised controlled trial. Lancet 2002; 360:1715-21.
30.Schleich FN, Manise M, Sele J, Henket M, Seidel L, Louis R. Distribution of sputum cellular phenotype in a large asthma cohort: predicting factors for eosinophilic vs neutrophilic inflammation. BMC Pulm Med 2013 26;13:11.
31.Woodruff PG, Modrek B, Choy DF, Jia G, Abbas AR, Ellwanger A, Koth LL, Arron JR, Fahy JV. T-helper type 2-driven inflammation defines major subphenotypes of asthma. Am J Respir Crit Care Med. 2009; 180:388-95.
32.Wenzel SE: Asthma: defining of the persistent adult phenotypes. Lancet 2006; 368:804-813.
33. Simpson JL, Scott R, Boyle MJ, Gibson PG: Inflammatory subtypes in asthma: assessment and identification using induced sputum. Respirology 2006; 11:54-61.
34.Busse WW, Holgate ST, Wenzel SW, et al. Biomarker profiles in asthma with high vs low airway reversibility and poor disease control. Chest 2015; 148:1489-96.
35.Pembrey L, Brooks C, Mpairwe H, Figueiredo CA, Oviedo AY, Chico M, Ali H, Nambuya I, Tumwesige P, Robertson S, Rutter CE, van Veldhoven K, Ring S, Barreto ML, Cooper PJ, Henderson J, Cruz AA, Douwes J, Pearce N; WASP Study Group. Asthma inflammatory phenotypes on four continents: most asthma is non-eosinophilic. Int J Epidemiol. 2023 Apr 19;52(2):611-623.
36.Borregaard N. Neutrophils, from marrow to microbes. Immunity 2010; 33:657-670.
37.Rademecker C, Louis R, Bureau F, Marichal T. Role of neutrophils in allergic asthma. Curr Opin Immunol 2018; 54:28-34.
38.Parhan, P. ? O Sistema Imune. 1ª edição. Porto Alegre: Artmed; 2001.
39.Summers C, Rankin SM, Condliffe AM, Singh N, Peters AM, Chilvers ER: Neutrophil kinetics in health and disease. Trends Immunol 2010; 31:318-324.
40.Borregaard N: Neutrophils, from marrow to microbes. Immunity 2010; 33:657-670.
41.Lieschke GJ, Grail D, Hodgson G, Metcalf D, Staley E, et al. Mice lacking granulocyte colony-stimulating factor have chronic neutropenia, granulocyte and macrophage progenitor cell deficiency, and impaired neutrophil mobilization. Blood 1994; 84:1737-1746.
42.Amulic B, Cazalet C, Hayes GL, et al. Neutrophil function: from mechanisms to disease. Annu Rev Immunol 2012; 30: 459-89.
43.Crisford H, Sapey E, Stockley RA. Proteinase 3; a potential target in chronic obstructive pulmonary disease and other chronic inflammatory diseases. Respir Res 2018; 19:180.
44.Barreiro O, Zamai M, Yáñez-Mó M, Tejera E, et al. Endothelial adhesion receptors are recruited to adherent leukocytes by inclusion in preformed tetraspanin nanoplatforms J. Cell Biol 2008; 183:527-542.
45.Korkmaz B, Moreau T, Gauthier F. Neutrophil elastase, proteinase 3 and cathepsin G: physicochemical properties, activity and physiopathological functions. Biochimie 2008; 90:227-42.
46.Yipp BG, Petri B, Salina D, Jenne CN, Scott BN, Zbytnuik LD, Pittman K, Asaduzzaman M, Wu K, Meijndert HC, Malawista SE, de Boisfleury Chevance A, Zhang K, Conly J, Kubes P. Infection-induced NETosis is a dynamic process involving neutrophil multitasking in vivo. Nat Med 2012; 18:1386-93.
47.Brinkmann V, Zychlinsky A. Neutrophil extracellular traps: is immunity the second function of chromatin? J Cell Biol 2012; 198:773-83.
48.Caudrillier A, Kessenbrock K, Gilliss BM, Nguyen JX, Marques MB, Monestier M, Toy P, Werb Z, Looney MR. Platelets induce neutrophil extracellular traps in transfusion-related acute lung injury. J Clin Invest 2012; 122:2661-71.
49.Thomas GM, Carbo C, Curtis BR, Martinod K, Mazo IB, Schatzberg D, Cifuni SM, Fuchs TA, von Andrian UH, Hartwig JH, Aster RH, Wagner DD. Extracellular DNA traps are associated with the pathogenesis of TRALI in humans and mice. Blood 2012; 119:6335-43.
50.Delgado-Rizo V, Martínez-Guzmán MA, Iñiguez-Gutierrez L, García-Orozco A, Alvarado-Navarro A, Fafutis-Morris M. Neutrophil Extracellular Traps and Its Implications in Inflammation: An Overview. Front Immunol 2017; 8:81.
51.Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol 2018; 18:134-147.
52.Krishnamoorthy N, Douda DN, Brüggemann TR, Ricklefs I, Duvall MG, Abdulnour RE, Martinod K, Tavares L, Wang X, Cernadas M, Israel E, Mauger DT, Bleecker ER, Castro M, Erzurum SC, Gaston BM, Jarjour NN, Wenzel S, Dunican E, Fahy JV, Irimia D, Wagner DD, Levy BD; National Heart, Lung, and Blood Institute Severe Asthma Research Program-3 Investigators. Neutrophil cytoplasts induce Th17 differentiation and skew inflammation toward neutrophilia in severe asthma. Sci Immunol 2018; 3(26):eaao4747.
53.Wright TK, Gibson PG, Simpson JL, McDonald VM, Wood LG, Baines KJ. Neutrophil extracellular traps are associated with inflammation in chronic airway disease. Respirology 2016; 21:467-75.
54.Lachowicz-Scroggins ME, Dunican EM, Charbit AR, Raymond W, Looney MR, Peters MC, Gordon ED, Woodruff PG, Lefrançais E, Phillips BR, Mauger DT, Comhair SA, Erzurum SC, Johansson MW, Jarjour NN, Coverstone AM, Castro M, Hastie AT, Bleecker ER, Fajt ML, Wenzel SE, Israel E, Levy BD, Fahy JV. Extracellular DNA, Neutrophil Extracellular Traps, and Inflammasome Activation in Severe Asthma. Am J Respir Crit Care Med 2019; 199:1076-1085.
55.Toussaint M, Jackson DJ, Swieboda D, Guedán A, Tsourouktsoglou TD, Ching YM, Radermecker C, Makrinioti H, Aniscenko J, Bartlett NW, Edwards MR, Solari R, Farnir F, Papayannopoulos V, Bureau F, Marichal T, Johnston SL. Host DNA released by NETosis promotes rhinovirus-induced type-2 allergic asthma exacerbation. Nat Med 2017; 23:681-691. doi: 10.1038/nm.4332. Epub 2017 May 1. Erratum in: Nat Med 2017; 23(11):1384.
56.Radermecker C, Sabatel C, Vanwinge C, Ruscitti C, Maréchal P, Perin F, Schyns J, Rocks N, Toussaint M, Cataldo D, Johnston SL, Bureau F, Marichal T. Locally instructed CXCR4hi neutrophils trigger environment-driven allergic asthma through the release of neutrophil extracellular traps. Nat Immunol. 2019; 20:1444-1455.
57.Baines KJ, Simpson JL, Wood LG, et al. Systemic upregulation of neutrophil a-defensins and serine proteases in neutrophilic asthma. Thorax 2011; 66:942-7.
58.Wright TK, Gibson PG, Simpson JL, et al. Neutrophil extracellular traps are associated with inflammation in chronic airway disease. Respirology 2016; 21:467-75.
59.Mosca T, Menezes MCS, Silva AV, et al. Chemotactic and phagocytic activity of blood neutrophils in allergic asthma. Immunol Invest 2015; 44:509-20.
60.Simpson JL, Carroll M, Yang IA, et al. Reduced antiviral interferon production in poorly controlled asthma is associated with neutrophilic inflammation and high-dose inhaled corticosteroids. Chest 2016; 149:704-13.
61.Gao P, Gibson PG, Baines KJ, et al. Anti-Inflammatory deficiencies in neutrophilic asthma: reduced galectin-3 and IL-1RA/IL-1ß. Respir Res 2015; 16:5.
62.Simpson JL, Phipps S, Baines KJ, et al. Elevated expression of the NLRP3 inflammasome in neutrophilic asthma. Eur Respir J 2014; 43: 1067-76.
63.Niessen NM, Baines KJ, Simpson JL, Scott HA, Qin L, Gibson PG, Fricker M. Neutrophilic asthma features increased airway classical monocytes. Clin Exp Allergy 2021; 51:305-317.
64.Green RH, Brightling CE, Woltmann G, Parker D, Wardlaw AJ, Pavord ID. Analysis of induced sputum in adults with asthma: identification of subgroup with isolated sputum neutrophilia and poor response to inhaled corticosteroids. Thorax 2002;57:875-9.
65.
Yamasaki A, Okazaki R, Harada T. Neutrophils and Asthma. Diagnostics (Basel). 2022; 12:1175.
66.Fahy JV, Kim KW, Liu J, Boushey HA. Prominent neutrophilic inflammation in sputum from subjects with asthma exacerbation. J Allergy Clin Immunol 1995;95: 843-52.
67.Norzila MZ, Fakes K, Henry RL, Simpson J, Gibson PG. Interleukin-8 secretion and neutrophil recruitment accompanies induced sputum eosinophil activation in children with acute asthma. Am J Respir Crit Care Med 2000;161:769-74.
68.Baines KJ, Simpson JL, Bowden NA, Scott RJ, Gibson PG. Differential gene expression and cytokine production from neutrophils in asthma phenotypes. Eur Respir J 2010; 35:522-31.
69.Chang HS, Lee T‐H, Jun JA, et al. Neutrophilic inflammation in asthma: mechanisms and therapeutic considerations. Expert Rev Respir Med 2017;11(1):29-40.
70.Fu JJ, McDonald VM, Baines KJ, Gibson PG. Airway IL‐1beta and systemic inflammation as predictors of future exacerbation risk in asthma and COPD. Chest 2015; 148(3):618-629.
71.Robinson PFM, Pattaroni C, Cook J, et al. Lower airway microbiota associates with inflammatory phenotype in severe preschool wheeze. J Allergy Clin Immunol 2019; 143:1607–10.
72.Grunwell JR, Stephenson ST, Tirouvanziam R, et al. Children with Neutrophil-Predominant severe asthma have proinflammatory neutrophils with enhanced survival and impaired clearance. J Allergy Clin Immunol Pract 2019; 7:516–25.
73.Sun Y-chang, Zhou Q-tao, Yao W-zhen. Sputum interleukin-17 is increased and associated with airway neutrophilia in patients with severe asthma. Chin Med J 2005; 118:953-6.
74.Moore WC, Hastie AT, Li X, et al. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis. J Allergy Clin Immunol 2014; 133:1557-63.
75.Sur S, Crotty TB, Kephart GM, et al. Sudden-onset fatal asthma. A distinct entity with few eosinophils and relatively more neutrophils in the airway submucosa? Am Rev Respir Dis 1993; 148:713-9.
76.Cardet JC, Ash S, Kusa T, et al. Insulin resistance modifies the association between obesity and current asthma in adults. Eur Respir J 2016; 48:403-10.
77.Park YH, Oh EY, Han H, et al. Insulin resistance mediates high-fat diet-induced pulmonary fibrosis and airway hyperresponsiveness through the TGF-ß1 pathway. Exp Mol Med 2019; 51:1-12.
78.Panettieri RA Jr. The role of neutrophils in asthma. Immunol Allergy Clinics North Am 2018; 38(4):629-638.
79.Wenzel SE, Szefler SJ, Leung DY, Sloan SI, Rex MD, Martin RJ: Bronchoscopic evaluation of severe asthma. Persistent inflammation associated with high dose glucocorticoids. Am J Respir Crit Care Med 1997; 156:737-743.
80.Vachier I, Kumlin M, Dahlen SE, Bousquet J, Godard P, Chanez P: High levels of urinary leukotriene E4 excretion in steroid treated patients with severe asthma. Respir Med 2003; 97:1225-1229.
81.Jatakanon A, Uasuf C, Maziak W, Lim S, Chung KF, Barnes PJ: Neutrophilic inflammation in severe persistent asthma. Am J Respir Crit Care Med 1999; 160: 1532-1539.
82.Montuschi P, Barnes PJ. Exhaled leukotrienes and prostaglandins in asthma. J Allergy Clin Immunol 2002; 109:615-20.
83.Vachier I, Bonnans C, Chavis C, Farce M, Godard P, Bousquet J, Chanez P: Severe asthma is associated with a loss of LX4, an endogenous anti-inflammatory compound. J Allergy Clin Immunol 2005; 115:55-60.
84.Detmers PA, Lo SK, Olsen-Egbert E, Walz A, Baggiolini M, Cohn ZA. Neutrophil activating protein 1/interleukin 8 stimulates the binding activity of the leukocyte adhesion receptor CD11b/CD18 on human neutrophils. J Exp Med 1990; 171:1155-62.
85.Detmers PA, Powell DE, Walz A, Clark-Lewis I, Baggiolini M, Cohn ZA. Differential effects of neutrophil-activating peptide 1/IL-8 and its homologues on leukocyte adhesion and phagocytosis. J Immunol 1991; 147:4211-7.
86.Bussolino F, Sironi M, Bocchietto E, Mantovani A. Synthesis of platelet-activating factor by polymorphonuclear neutrophils stimulated with interleukin-8. J Biol Chem 1992; 267:14598-603.
87.Alcorn JF, Crowe CR, Kolls JK. Th17 cells in asthma and COPD. Annu Rev Physiol 2010; 72:495-516.
88.Sun YC, Zhou QT, Yao WZ. Sputum interleukin-17 is increased and associated with airway neutrophilia in patients with severe asthma. Chin Med J (Engl) 2005; 118:953-6.
89.Shimoda T, Obase Y, Kishikawa R, et al. Influence of cigarette smoking on airway inflammation and inhaled corticosteroid treatment in patients with asthma. Allergy Asthma Proc 2016; 37:50-8.
90.Siew LQC, Wu S-Y, Ying S, Corrigan CJ. Cigarette smoking increases bronchial mucosal IL-17A expression in asthmatics, which acts in concert with environmental aeroallergens to engender neutrophilic inflammation. Clinical & Experimental Allergy 2017; 47:740-750.
91.Mitchell PD, O'Byrne PM. Epithelial-derived cytokines in asthma. Chest 2017; 151:1338–1344.
92.Porsbjerg CM, Sverrild A, Lloyd CM, et al. Anti-alarmins in asthma: targeting the airway epithelium with next-generation biologics. Eur Respir J 2020; 56:2000260 [https://doi.org/10.1183/ 13993003.00260-2020].
93.Griesenauer B, Paczesny S. The ST2/IL-33 Axis in Immune Cells during Inflammatory Diseases. Front Immunol 2017; 8:475.
94.Varricchi G, Pecoraro A, Marone G, Criscuolo G, Spadaro G, Genovese A, Marone G. Thymic Stromal Lymphopoietin Isoforms, Inflammatory Disorders, and Cancer. Front Immunol 2018; 9:1595.
95.Ying S, O'Connor B, Ratoff J, Meng Q, Fang C, Cousins D, Zhang G, Gu S, Gao Z, Shamji B, Edwards MJ, Lee TH, Corrigan CJ. Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease. J Immunol 2008; 181:2790-8.
96.Allakhverdi Z, Comeau MR, Jessup HK, Yoon BR, Brewer A, Chartier S, Paquette N, Ziegler SF, Sarfati M, Delespesse G. Thymic stromal lymphopoietin is released by human epithelial cells in response to microbes, trauma, or inflammation and potently activates mast cells. J Exp Med 2007; 204:253-8.
97.Barnes PJ. New molecular targets for the treatment of neutrophilic diseases. J Allergy Clin Immunol 2007; 119:1055-62.
98.Zhang Q, Illing R, Hui CK, et al. Bacteria in sputum of stable severe asthma and increased airway wall thickness. Respir Res 2012; 13:35.
99.Wood LG, Simpson JL, Hansbro PM, Gibson PG. Potentially pathogenic bacteria cultured from the sputum of stable asthmatics are associated with increased 8-isoprostane and airway neutrophilia. Free Radic Res 2010; 44:146–54.
100.Fitzpatrick AM, Holguin F, Teague WG, Brown LA. Alveolar macrophage phagocytosis is impaired in children with poorly controlled asthma. J Allergy Clin Immunol 2008; 121:1372–78.
101.Huynh ML, Malcolm KC, Kotaru C, et al. Defective apoptotic cell phagocytosis attenuates PGE2 and 15-HETE in severe asthma alveolar macrophages. Am J Respir Crit Care Med 2005; 172:972–79.
102.Seys SF, Lokwani R, Simpson JL, Bullens DMA. New insights in neutrophilic asthma. Curr Opin Pulm Med 2019; 25:113-120.
103.Hinks TSC, Levine SJ, Brusselle GG. Treatment options in type-2 low asthma. Eur Respir J 2021; 57(1):2000528.
104.Jabeen MF, Sanderson ND, Tinè M, Donachie G, Barber C, Azim A, Lau LCK, Brown T, Pavord ID, Chauhan A, Klenerman P, Street TL, Marchi E, Howarth PH, Hinks TSC. Species-level, metagenomic and proteomic analysis of microbe-immune interactions in severe asthma. Allergy 2024; 79:2966-2980.
105.Simpson JL, Daly J, Baines KJ, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, Hugenholtz P, Willner D, Gibson PG. Airway dysbiosis: Haemophilus influenzae and Tropheryma in poorly controlled asthma. Eur Respir J. 2016 Mar;47(3):792-800.
106.Niessen NM, Fricker M, McDonald VM, Gibson PG. T2-low: what do we know?: Past, present, and future of biologic therapies in noneosinophilic asthma. Ann Allergy Asthma Immunol 2022; 129:150-159.
107.Berry M, Morgan A, Shaw DE, Parker D, Green R, Brightling C, Bradding P, Wardlaw AJ, Pavord ID. Pathological features and inhaled corticosteroid response of eosinophilic and non-eosinophilic asthma. Thorax 2007; 62:1043-9.
108.Simpson JL, Baines KJ, Ryan N, Gibson PG. Neutrophilic asthma is characterised by increased rhinosinusitis with sleep disturbance and GERD. Asian Pac J Allergy Immunol 2014; 32:66-74.
109.Fricker M, Tiedeman C, Gibson PG. Options in the absence of type 2 inflammation. In: Jackson DJ, McDonald VM, Pavord ID, eds. Asthma (ERS Monograph). Sheffield: European Respiratory Society; 2025: 271–286.
110.Shaw DE, Heaney LG, Thomas M, Beasley R, Gibson PG, Pavord ID. Balancing the needs of the many and the few: where next for adult asthma guidelines? Lancet Respir Med. 2021 Jul;9(7):786-794.
111.Radovanovic D, Santus P, Blasi F, Mantero M. The evidence on tiotropium bromide in asthma: from the rationale to the bedside. Multidiscip Respir Med 2017; 12:12. doi: 10.1186/s40248-017-0094-3. Erratum in: Multidiscip Respir Med. 2017; 12 :17. PMID: 28484598; PMCID: PMC5420159.
112.Szefler SJ, Vogelberg C, Bernstein JA, Goldstein S, Mansfield L, Zaremba-Pechmann L, Engel M, Hamelmann E. Tiotropium Is Efficacious in 6- to 17-Year-Olds with Asthma, Independent of T2 Phenotype. J Allergy Clin Immunol Pract 2019; 7:2286-2295.e4.
113.Bühling F, Lieder N, Kühlmann UC, Waldburg N, Welte T. Tiotropium suppresses acetylcholine-induced release of chemotactic mediators in vitro. Respir Med 2007; 101:2386-94.
114.Maneechotesuwan K, Essilfie-Quaye S, Meah S, Kelly C, Kharitonov SA, Adcock IA, Barnes PJ. Formoterol attenuates neutrophilic airway inflammation in asthma. Chest 2005; 128:1936-42.
115.Bowden JJ, Sulakvelidze I, McDonald DM. Inhibition of neutrophil and eosinophil adhesion to venules of rat trachea by B2-adrenergic agonist formoterol. J Appl Physiol 1994; 77:397-40.
116.Jeffery PK, Venge P, Gizycki MJ, et al. Effects of salmeterol on mucosal inflammation in asthma: a placebo-controlled study. Eur Respir J 2002; 20:1378-85.
117.Simpson JL, Powell H, Boyle MJ, Scott RJ, Gibson PG. Clarithromycin targets neutrophilic airway inflammation in refractory asthma. Am J Respir Crit Care Med 2008; 177:148-55.
118.Gibson PG, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, Jenkins C, Peters MJ, Marks GB, Baraket M, Powell H, Simpsom JL. . Efficacy of azithromycin in severe asthma from the AMAZES randomised trial. ERJ Open Res 2019 Oct; 5(4). DOI:10.1183/23120541.00056-2019.
119.Schögler A, Kopf BS, Edwards MR, et al. Novel antiviral properties of azithromycin in cystic fibrosis airway epithelial cells. Eur Respir J 2015; 45:428-439.
120.Essilfie AT, Horvat JC, Kim RY, et al. Macrolide therapy suppresses key features of experimental steroid-sensitive and steroid-insensitive asthma. Thorax 2015; 70:458-467.
121.Niessen NM, Gibson PG, Baines KJ, Barker D, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, Jenkins C, Peters MJ, Marks GB, Baraket M, Simpson JL, Fricker M. Sputum TNF markers are increased in neutrophilic and severe asthma and are reduced by azithromycin treatment. Allergy 2021l; 76:2090-2101.
122.Shukla SD, Taylor SL, Gibson PG, Barker D, Upham JW, Yang IA, Reynolds PN, Hodge S, James AL, Rogers GB, Simpson JL. Add-on azithromycin reduces sputum cytokines in non-eosinophilic asthma: an AMAZES substudy. Thorax 2021; 76:733-736.
123.Kobayashi Y, Wada H, Rossios C, et al. A novel macrolide solithromycin exerts superior anti-inflammatory effect via NF-?B inhibition. J Pharmacol Exp Ther 2013; 345:76-84.
124.O'Neill C, Gibson PG, Heaney LG, Upham JW, Yang IA, Reynolds PN, Hodge S, Jenkins CR, Peters M, Marks GB, James AL, Simpson JL. The cost-effectiveness of azithromycin in reducing exacerbations in uncontrolled asthma. Eur Respir J 2021; 57:2002436.
125.Gauvreau GM, Sehmi R, Ambrose CS, Griffiths JM. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets 2020;24:777-792.
126.Liu S, Verma M, Michalec L, et al. Steroid resistance of airway type 2 innate lymphoid cells from patients with severe asthma: the role of thymic stromal lymphopoietin. J Allergy Clin Immunol 2018;141:257.
127.Corren J, Parnes JR, Wang L, Mo M, Roseti SL, Griffiths JM, van der Merwe R. Tezepelumab in Adults with Uncontrolled Asthma. N Engl J Med 2017; 377:936-946. doi: 10.1056/NEJMoa1704064. Erratum in: N Engl J Med 2019;380(21):2082.
128.Corren J, Pham TH, Garcia Gil E, Salapa K, Ren P, Parnes JR, Colice G, Griffiths JM. Baseline type 2 biomarker levels and response to tezepelumab in severe asthma. Allergy 2022; 77:1786-1796.
129.Menzies-Gow A, Corren J, Bourdin A, Chupp G, Israel E, Wechsler ME, Brightling CE, Griffiths JM, Hellqvist Å, Bowen K, Kaur P, Almqvist G, Ponnarambil S, Colice G. Tezepelumab in Adults and Adolescents with Severe, Uncontrolled Asthma. N Engl J Med 2021; 384:1800-1809.
130.Brusselle GG, Koppelman GH. Biologic therapies for severe asthma. N Engl J Med 2022; 386:157-171.
131.Corren J, Menzies-Gow A, Chupp G, Israel E, Korn S, Cook B, et al. Efficacy of tezepelumab in severe, uncontrolled asthma: pooled analysis of the PATHWAY and NAVIGATOR studies. Am J Respir Crit Care Med 2023; 208:13-24.
132.Varricchi G, Ferri S, Pepys J, Poto R, Spadaro G, Nappi E, Paoletti G, Virchow JC, Heffler E, Canonica WG. Biologics and airway remodeling in severe asthma. Allergy 2022; 77:3538-3552.
133.Kelsen SG, Agache IO, Soong W, Israel E, Chupp GL, Cheung DS, Theess W, Yang X, Staton TL, Choy DF, Fong A, Dash A, Dolton M, Pappu R, Brightling CE. Astegolimab (anti-ST2) efficacy and safety in adults with severe asthma: A randomized clinical trial. J Allergy Clin Immunol 2021; 148:790-798.
134.Wechsler ME, Ruddy MK, Pavord ID, Israel E, Rabe KF, Ford LB, Maspero JF, Abdulai RM, Hu CC, Martincova R, Jessel A, Nivens MC, Amin N, Weinreich DM, Yancopoulos GD, Goulaouic H. Efficacy and Safety of Itepekimab in Patients with Moderate-to-Severe Asthma. N Engl J Med 2021 28; 385:1656-1668.
135.Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2025. Updated May 2025. Disponível em: www.ginasthma.org
136.Chupp G, Kline JN, Khatri SB, McEvoy C, Silvestri GA, Shifren A, Castro M, Bansal S, McClelland M, Dransfield M, Trevor J, Kahlstrom N, Simoff M, Wahidi MM, Lamb CR, Ferguson JS, Haas A, Hogarth DK, Tejedor R, Toth J, Hey J, Majid A, LaCamera P, Fitzgerald JM, Enfield K, Grubb GM, McMullen EA, Olson JL, Laviolette M. Bronchial Thermoplasty in Patients With Severe Asthma at 5 Years: The Post-FDA Approval Clinical Trial Evaluating Bronchial Thermoplasty in Severe Persistent Asthma Study. Chest 2022; 161:614-628.
137.Chupp G, Laviolette M, Cohn L, McEvoy C, Bansal S, Shifren A, Khatri S, Grubb GM, McMullen E, Strauven R, Kline JN; Other members of the PAS2 Study Group. Long-term outcomes of bronchial thermoplasty in subjects with severe asthma: a comparison of 3-year follow-up results from two prospective multicentre studies. Eur Respir J 2017 Aug 31;50(2):1700017. Erratum in: Eur Respir J 2017; 50.
138.Laxmanan B, Hogarth DK. Bronchial thermoplasty in asthma: current perspectives. J Asthma Allergy 2015; 8:39-49.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|