|
Asma
Tratamento da Asma
MODIFICADORES DE LEUCOTRIENOS
Na década de 1990 surgiram os antagonistas de leucotrienos que substituíram amplamente o uso das cromonas (cromoglicato e nedocromil) como medicação de escolha, não esteroide, especialmente para crianças menores, nas quais a utilização dos sprays e dispositivos de pó seco são mais difíceis. Estudos sugerem eficácia maior quando utilizados no controle da asma associada à rinite alérgica.1
Nos últimos anos ocorreram progressos no desenvolvimento de agentes que modulam a síntese ou ação dos leucotrienos. Sua utilização na prática clínica (Tabela 1) é direcionada para a asma desencadeada pelo esforço e ar frio, asma induzida por aspirina e na prevenção e controle da asma leve. Sua utilização tem sido preconizada também quando se busca efeito aditivo ao tratamento da asma crônica, visando-se também à redução nas doses dos corticoides e broncodilatadores. Pacientes que não utilizam de forma correta os sprays podem se beneficiar do tratamento com antileucotrieno por via oral, ressaltando-se ainda, que a aderência ao medicamento oral com comprimidos em certos pacientes é melhor do que com dispositivos por inalação. Outra indicação seria para os pacientes e crianças asmáticas cujos pais têm “corticosteroidefobia”. Os efeitos dos inibidores de leucotrienos em asmáticos incluem também a broncodilatação aguda, a melhora nas provas funcionais respiratórias, a redução dos sintomas diurnos e noturnos, com melhora na qualidade de vida.
Tabela 1 – Indicações para a Utilização dos Modificadores de Leucotrienos
|
|
• Asma Induzida por Exercício
|
|
• Asma Agudizada por Alérgenos
|
|
|
• Asma que não pode ser controlada de forma satisfatória com doses seguras de corticoides
|
• Pacientes que apresentam dificuldade de adesão com a medicação por inalação
|
• Pacientes com rinite alérgica coexisente
|
A metabolização do ácido araquidônico requer inicialmente a ativação da 5-lipoxigenase, que ocorre através de sua interação com outra proteína chamada proteína ativadora da 5-lipoxigenase (também conhecida como ALOX5-AP ou FLAP), formando o HPETE, precursor do LTA4. O LTA4 sob ação da enzima LTA4 hidrolase forma o LTB4, enquanto por outra via resultam os leucotrienos sulfidopeptídicos (LTC4, LTD4, LTE4).
Quanto as estratégias terapêuticas para inibir os leucotrienos utlizam-se dois grupos de drogas:
-
As inibidoras da síntese de leucotrienos por inibição da 5-lipoxigenase ou de sua ativação e
- As que atuam como antagonistas de receptores de leucotrienos (LTRA) (Tabela 2).
Tabela 2 — Estratégias para Inibir os Leucotrienos
1. Inibição da síntese de Leucotrienos |
— inibidores da 5-lipoxigenase (5-LO) |
— inibidores da proteína ativadora da 5-LO (FLAP) |
— inibidores da mobilização de cálcio |
2. Antagonistas de Receptores de Leucotrienos (LTRA) |
No grupo que interfere na sí 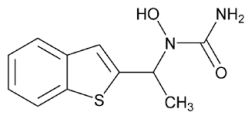 ntese temos o ABT-761 e o Zileuton (Figura 1). O Zileuton é o inibidor de 5-LO mais promissor estudado em humanos. Uma dose diária oral de 800 mg diminui o broncospasmo induzido por ar frio e seco. 2 Na asma induzida por aspirina, múltiplas doses inibem substancialmente a excreção de LTE 4, reduzindo a sintomatologia. 3 Na asma moderada em uso prolongado apresentou efeito broncodilatador significativo. 4 A dose preconizada para o Zileuton é de 600 mg quatro vezes ao dia, fora das refeições, o que limita o seu uso. Uma forma de liberação lenta do Zileuton, recebeu a aprovação do FDA, reduzindo a frequência de doses para duas vezes ao dia. Como o Zileuton inibe diretamente a 5-LO, este efeito bloqueia a produção tanto dos cisteinil-leucotrienos como do LTE 4. O LTE 4 tem ação importante de quimioatração de neutrófilos, células envolvidas na asma neutrofílica, na asma severa, bem como nas exacerbações da asma. No mesmo grupo temos as substâncias que inibem a ativação da 5-LO pelo antagonismo à proteína ativadora da 5-lipoxigenase (FLAP) (MK-886, MK-0591, BAY-x-1005). Inibem a produção de LTB4 e determinam uma atenuação na resposta imediata e tardia da asma por alérgenos inalados.5
Estudos utilizando o BAY-x-1005 na dose de 500 mg duas vezes ao dia durante três dias, antes e no dia do teste de provocação ao alérgeno, evidenciaram proteção de 60% na resposta asmática precoce 0 a 3 horas após exposição, e de 52,7% na resposta asmática tardia três a sete horas após a provocação.6
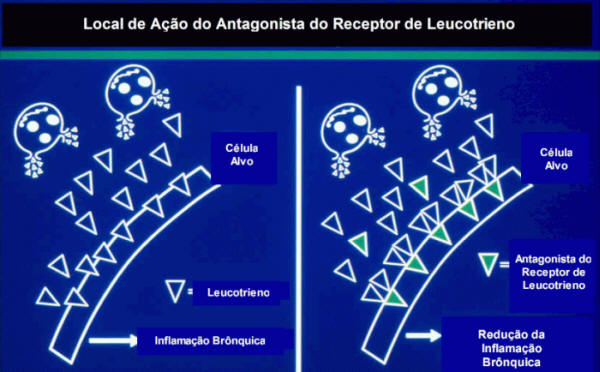 Em outro grupo temos os antagonistas de receptores do LTD4. Os antagonistas seletivos de receptores de leucotrienos bloqueiam um subtipo de receptor denominado arbitrariamente de cys-LT1. Muitas das ações dos cisteinil-leucotrienos são mediadas pelo próprio receptor cys-LT17-9 (Figura 2). Em outro grupo temos os antagonistas de receptores do LTD4. Os antagonistas seletivos de receptores de leucotrienos bloqueiam um subtipo de receptor denominado arbitrariamente de cys-LT1. Muitas das ações dos cisteinil-leucotrienos são mediadas pelo próprio receptor cys-LT17-9 (Figura 2).
.
Entre as várias drogas estudadas as mais potentes e seletivas são as de segunda geração: Zafirlucaste, Montelucaste, Pranlucaste (Figura 3), MK-679 (Verlucaste), SK&F 104.353 (Pobilucaste), LY 170680 (Sulucaste), LY 171.883 (Tomelucaste), CGP 45.715 (Iralucaste), Cinalucaste e RG 12.525. 5
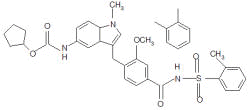 |
Zafirlucaste – 4-(5-ciclopentiloxicarbonilamino-1 metilindol-3-ilmetil)-3-metoxi- o -toilsulfonilbenzamida. Peso molecular de 575,5. |
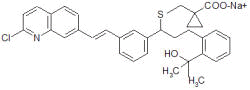 |
Montelucaste Sódico – sal monossódico do ácido acético [R-(E)]-1-[[[1-[3-[2-(7-cloro-2-quinolinil)etinil]fenil]-3-[2-(1-hidroxi-1-metiletil)fenil]propil]tio]metil ciclopropano. Peso molecular de 608,18.
|
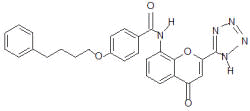 |
Pranlucaste – 4 – oxo -8 –[4 – (4 – fenilbutoxi) benzoilamino] – 2 (tetrazol – 5 yl) – 4H- 1 benzopiran hemihidrato. Peso molecular de 490,52. |
O Montelucaste sódico reduz a sensibilidade ao LTD4 inalado em cerca de 100 vezes ou mais no paciente com asma, enquanto que um valor de 20 vezes é considerado um pré-requisito para adequada inibição em humanos. Uma dose única de 40 mg de Zafirlucaste suprime quase que totalmente a resposta imediata da asma e reduz a hiper-responsividade à histamina seis horas após a provocação.10
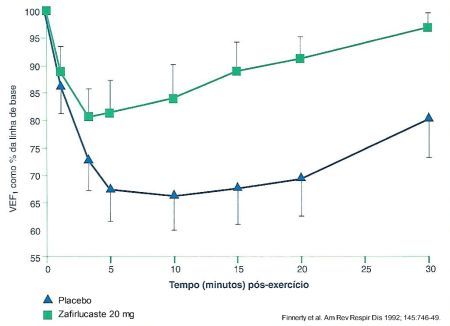 Da mesma forma, uma única dose de Zafirlucaste de 20 mg inibe a broncoconstrição provocada por exercício em esteira, respirando ar seco, e à velocidade constante, duas horas após a administração da droga. 11 (Figura 4) Estudos com 450 mg de MK 0571 por via endovenosa demonstraram atenuação das respostas precoces e tardias da asma. 12 Doses menores, 160 mg também por via endovenosa, suprimiram completamente o broncospasmo decorrente do esforço. 5 A administração do Cinalucaste resultou em redução na broncoconstrição após exercício em cerca de 80% dos pacientes asmáticos testados, mantendo-se o efeito por mais de oito horas. 13 Os antagonistas de receptor de leucotrienos mostraram boa proteção na asma induzida por aspirina. 14,15 O tratamento prévio com Verlucaste 14 ou Verlucaste 15 é capaz de prevenir a resposta broncoconstritora após inalação de aspirina sob a formPobilucastea lisina.
As atenções no momento estão direcionadas para estudos que avaliam os efeitos a longo prazo, na asma crônica.16-19 Investigações recentes em modelos animais de asma têm demonstrado que estes agentes podem controlar as respostas fibróticas observadas no remodelamento brônquico.20
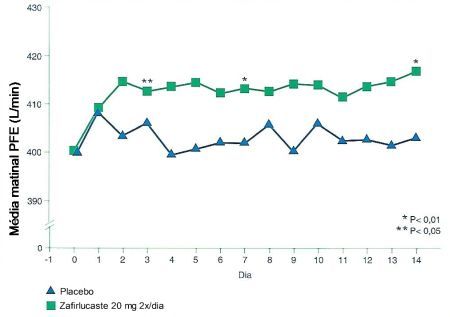 Estudos com o Zafirlucaste em doses diárias de 20 mg durante seis semanas constataram melhora na asma noturna, com elevação dos valores do PFE matinal.5 Outras drogas tiveram resultados similares, com melhora dos sintomas, redução do consumo de ß-agonistas e melhora nas provas de função pulmonar.18,19 Kemp et al.21 em estudo clínico randomizado, placebo-controlado e duplo-cego, avaliaram um grupo de pacientes com asma moderada. Administraram Zafirlucaste na dose de 20 mg duas vezes ao dia ou placebo por um período de 13 semanas. Os pacientes que fizeram uso do Zafirlucaste apresentaram início de ação rápido, em cerca de três dias, com significante melhora da função pulmonar avaliada através da medida do PFE médio matinal (p < 0,05) (Figura 5). Estudos com o Zafirlucaste em doses diárias de 20 mg durante seis semanas constataram melhora na asma noturna, com elevação dos valores do PFE matinal.5 Outras drogas tiveram resultados similares, com melhora dos sintomas, redução do consumo de ß-agonistas e melhora nas provas de função pulmonar.18,19 Kemp et al.21 em estudo clínico randomizado, placebo-controlado e duplo-cego, avaliaram um grupo de pacientes com asma moderada. Administraram Zafirlucaste na dose de 20 mg duas vezes ao dia ou placebo por um período de 13 semanas. Os pacientes que fizeram uso do Zafirlucaste apresentaram início de ação rápido, em cerca de três dias, com significante melhora da função pulmonar avaliada através da medida do PFE médio matinal (p < 0,05) (Figura 5).
A dose do Zafirlucaste para uso na clínica é de 20 mg duas vezes ao dia, uma hora antes ou duas após as refeições. Estudo recente na asma moderada com o Montelucaste, em dose oral única diária de 10 mg, obteve proteção na broncoconstrição esforço-induzida por 12 semanas, sem o desenvolvimento de taquifilaxia, com mínimos efeitos colaterais.22 As doses do Montelucaste para uso na clínica são de 10 mg para > 15 anos, 5 mg para crianças de 6 a 14 anos e 4 mg para crianças de 2 a 5 anos, sempre em dose única diária, à noite ao deitar-se. Para pacientes pediátricos de 6 meses a 2 anos de idade a posologia preconizada é de 4 mg diariamente, através de sachê de grânulos orais, misturados ou não com alimentos. O Pranlucaste, ainda não comercializado no Brasil, é utilizado na dose de 450 mg em duas doses diárias. Para as crianças a dose preconizada é de 7 mg/kg/dia, aumentando-se até 10 mg/kg/dia de acordo com a idade e os sintomas, não excedendo 450 mg/dia. Como os alimentos afetam a biodisponibilidade, o Pranlucaste deve ser administrado após o café da manhã e jantar.
A comparação direta do Zafirlucaste e do Montelucaste com o Pranlucaste é muito difícil pois a maioria dos estudos foi efetuada no Japão, com protocolos diferentes. Todavia, existe um estudo americano com o Pranlucaste relatando melhora nos sintomas de magnitude similar àqueles descritos para o Zafirlucaste e Montelucaste.23
Entre os três antagonistas de receptores cys-LT1 (LTRA) até o momento comercializados, o Zafirlucaste e Montelucaste apresentam biopotência semelhante, enquanto que o Pranlucaste apresenta uma biopotência de 3-5 vezes menor.
Os inibidores de leucotrienos são bem tolerados. Seus efeitos adversos mais relatados são a dispepsia, diarreia e cefaleia.16,17 Existem relatos de aumento assintomático nas transaminases (3 vezes ou mais) em pacientes em uso do Zileuton (4-5%), com a dose de 600 mg quatro vezes ao dia,24 e com o Zafirlucaste25 em doses acima das recomendadas. Quando do uso do Zileuton, recomenda-se a dosagem das transaminases antes do início do tratamento, mensalmente nos primeiros três meses e posteriormente a cada três meses durante o primeiro ano de tratamento, prosseguindo a cada seis meses. O Zileuton diminui o clearance da teofilina, resultando em significante aumento nas concentrações plasmáticas da droga. O Pranlucaste deve ser suspenso em caso de insuficiência hepática, pneumonia eosinofílica ou intersticial, leucopenia, trombocitopenia ou risco de anafilaxia. Os LTRAs geralmente são drogas seguras, porém interagem com outros agentes como a warfarina, também metabolizada pelo CYP2C9.
Alguns casos de Síndrome de Churg-Strauss (SCS) – Granulomatose Eosinofílica com Poliangiite (GEPA) foram relatados em pacientes em uso de Zafirlucaste, Montelucaste e Pranlucaste.26-28 Quase todos vinham em uso de altas doses de corticoides, por inalação ou por via oral, e se beneficiaram com o uso de modificadores de leucotrienos, que possibilitaram a redução das doses prévias de corticoide. O quadro clínico é típico da SCS e os primeiros sinais aparecem dentro de dias, até cerca de um ano após o início do tratamento da asma com antileucotrienos.
A SCS foi descrita pela primeira vez em 1951 por Churg e Strauss que relataram 13 casos que apresentavam a asma como primeira manifestação. Estes pacientes evoluíram para asma severa até o aparecimento de febre e elevada eosinofilia. A SCS constitui-se em uma vasculite pouco frequente, de etiologia desconhecida, também denominada de angiíte alérgica e granulomatosa.29 Em 1990, o American College of Rheumatology publicou os critérios diagnósticos da síndrome, que deve incluir pelo menos quatro das seis de suas características (Tabela 3).
Tabela 3 – Critérios para o Diagnóstico da SCS
• Asma moderada a severa |
• Eosinofilia periférica > 10% ou contagem absoluta > 1.500 mm3 |
• Mononeuropatia ou polineuropatia |
• Infiltrados pulmonares |
• Anormalidade nos seios da face |
• Presença extravascular de eosinófilos |
A incidência da síndrome na população geral oscila entre 2,4 a 3,3 casos por milhão/ano,30-32 enquanto que em asmáticos oscila em torno de 60 casos/milhão/ano.32 Um terço dos pacientes apresenta asma severa que necessita de corticoides. Mononeurite multiplex é descrita em 72% dos casos enquanto que perda ponderal, febre, mialgia, lesões cutâneas (rash macular ou papular, nódulos, lesões hemorrágicas) e sinusite estão presentes na metade dos casos. Após os pulmões, o coração é o órgão mais acometido, contribuindo com 48% dos óbitos, principalmente por infarto agudo do miocárdio, pericardite aguda ou constritiva.
A apresentação da doença é muito variável, sendo na maioria das vezes trifásica. As fases consistem de rinite alérgica e asma de graus variados, geralmente de início na idade adulta; eosinofilia e infiltração tecidual por eosinófilos; e vasculite geralmente grave que envolve múltiplos órgãos incluindo pele, pulmões, coração, trato gastrintestinal e sistema nervoso. Cursam com hemossedimentação elevada, níveis de IgE geralmente aumentados, sendo os anticorpos anticitoplasma dos neutrófilos (P-ANCA) positivos em ~40% dos casos, sendo que este teste negativo não afasta a possibilidade de diagnóstico da síndrome.
 Encontra-se ainda em discussão se a SCS é consequência da droga (idiossincrasia) ou da redução do corticoide. 26 Publicação de Weschsler et al. 27 reforça a segunda hipótese, acreditando-se que a síndrome esteja dissimulada, sendo diagnosticada erroneamente como asma moderada a severa, que constitui um dos componentes da SCS. Quando estes pacientes recebem os modificadores de leucotrienos que suprimem a obstrução ao fluxo aéreo, e possibilitam a redução das altas doses de corticoides, as outras manifestações inflamatórias da síndrome se exteriorizam de modo pleno.
Mais aceitável é a teoria de que o bloqueio dos receptores para cisteinil-leucotrienos pode provocar um desequilíbrio na estimulação dos mesmos, levando a um aumento de células B circulantes, e sendo os leucotrienos quimioatrativos de eosinófilos e neutrófilos, estariam preparando o campo para o desenvolvimento de vasculite.
Mitsuyama et al.28 dosaram o VEGF (Vascular Endothelial Growth Factor) sérico em 18 pacientes com SCS, 19 pacientes com asma e 12 com bronquite aguda. Encontraram valores significantemente elevados do VEGF na SCS, capaz de diferenciar a SCS da asma, com sensibilidade de 93,3% e especificidade de 81,8%. O infiltrado tecidual eosinofílico da SCS foi intensamente positivo para o coramento para o VEGF, sendo que os níveis elevados de VEGF demonstraram significante correlação com a contagem periférica dos eosinófilos. Valores baixos do VEGF reduzem a possibilidade de tratar-se de SCS. Acredita-se que o VEGF possa estar associado à patogênese da SCS. Os valores de VEGF permanecem elevados por cerca de um mês apesar do tratamento com corticoide, caindo de forma drástica quando de follow-up após seis meses.
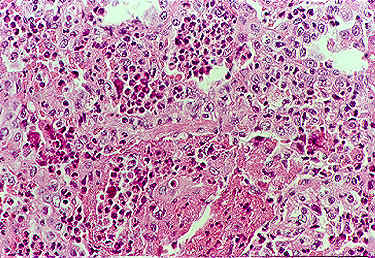
O quadro histopatológico clássico consiste em vasculite necrotizante, infiltração eosinofílica tecidual e granuloma extravascular (Figura 6). Em outros órgãos pode ocorrer necrose fibrinoide de pequenos vasos que é a responsável pelos achados de glomerulonefrite, miosite e mononeurites.
Na maioria dos pacientes com SCS, a eosinofilia e os sintomas respondem rapidamente à terapia com corticoides e ciclofosfamida, sendo que alguns pacientes se beneficiam com o interferon-a.29
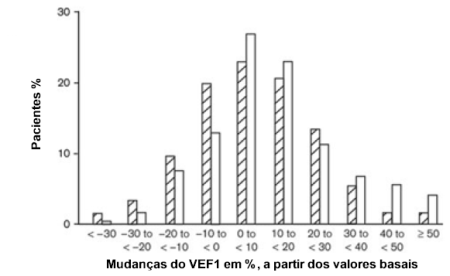 Apesar dos modificadores de leucotrienos terem se mostrado eficientes no tratamento de vários tipos de asma, a sua atuação varia consideravelmente entre os pacientes, não ocorrendo uma resposta uniforme.30 Malmstrom et al.31 analisaram um grupo de pacientes com asma recebendo beclometasona por inalação ou Montelucaste e demonstraram um largo espectro de respostas interindividuais a ambas as drogas. Existem aqueles que respondem muito bem ao medicamento e pacientes que não apresentam qualquer benefício com o seu uso (Figura 7). Apesar dos modificadores de leucotrienos terem se mostrado eficientes no tratamento de vários tipos de asma, a sua atuação varia consideravelmente entre os pacientes, não ocorrendo uma resposta uniforme.30 Malmstrom et al.31 analisaram um grupo de pacientes com asma recebendo beclometasona por inalação ou Montelucaste e demonstraram um largo espectro de respostas interindividuais a ambas as drogas. Existem aqueles que respondem muito bem ao medicamento e pacientes que não apresentam qualquer benefício com o seu uso (Figura 7).
Vários dos genes que participam na regulação da síntese de leucotrienos (p.ex. 5-LO e sintase LTC4) e na sua degradação têm sido estudados e avaliados como variantes funcionais polimórficas que podem interferir nas respostas terapêuticas destes agentes. Estas respostas variáveis parecem decorrer principalmente de modificações genéticas (mutações) da enzima 5-lipoxigenase. A taxa de transcrição do gene codificante da 5-LO, localizado no cromossomo 10, é controlada pelo seu promotor, mais precisamente pela região denominada de core promotor, que contém a sequência única G+C-rica, localizada entre os pares de bases 176 e 147, upstream ao sitio de iniciação ATG, que contém repetições em tandem, sítios de ligação para dois fatores de transcrição, Sp-1 e Egr-1.30,32 Variações genéticas na região core promotor podem mudar a ligação destes fatores de transcrição e a taxa de ativação transcricional da 5-LO quando ocorrem condições inflamatórias como, por exemplo, a asma. Uma família natural de mutações na região G+C-rica foi identificada consistindo de adição ou deleção destes sítios de ligação. A deleção de um destes sítios de ligação, a deleção de dois deles ou adição de outro, estão associadas à transcrição alterada do gene da 5-LO, quando comparada ao alelo comum. Uma alteração no número de repetições diminui a eficiência na gene transcrição.
Drazen et al.33 concluíram que pacientes que apresentam formas mutantes do promotor 5-LO podem ter diminuída a gene transcrição da 5-LO, sendo nestes pacientes a asma menos dependente da formação de leucotrienos e podem, portanto, ser menos sensíveis aos efeitos antiasmáticos da inibição da 5-LO. Pacientes com asma portadores destas variantes genéticas apresentam resposta diminuída ao tratamento com drogas antileucotrienos, indicando efeito farmacogenético das sequências promotor nas respostas ao tratamento.34
Estudos sugerem que a ação anti-inflamatória do antagonista de receptor de leucotrieno Montelucaste possa estar relacionada à inibição da produção de citocinas induzida pelo fator nuclear kappa B (NF-kB), associada a supressão dos níveis séricos de receptor solúvel IL-2 (sIL-2R) e do fator de necrose tumoral alfa (TNF-a) e pela inibição da protease eosinofílica, determinando redução do infiltrado eosinofílico das vias aéreas.35-37 Os LTRAs são adicionados ao esquema terapêutico dos pacientes com asma que não foram completamente controlados com doses médias de corticoide por inalação pois, a administração de LTRAs é mais efetiva do que dobrar-se a dose do corticoide por inalação.38
Comparados com os LABAs, LTRAs usados em combinação com os corticoides por inalação são menos efetivos na melhora dos sintomas da asma, da função respiratória bem como na prevenção da exacerbação.
Geralmente os LTRAs como monoterapia são menos efetivos do que os corticoides por inalação em baixas doses, nos pacientes com asma leve.39,40 Não há lugar na asma para para sua utilização em monoterapia.
A partir de 2020, a FDA (Food and Drug Administration) exigiu inclusão de uma advertência em bula do medicamento Montelucaste sobre os sérios efeitos colaterais à saúde mental causados por este medicamento. Os riscos podem incluir pensamentos ou ações suicidas. Considerar os riscos e benefícios do montelucaste ao decidir prescrever ou continuar com o medicamento. Para a rinite alérgica o medicamento passa a ser reservado para pacientes com resposta ou intolerância inadequadas a terapias alternativas.41
O banco de dados VigiBase de farmacovigilância contém 8.707 casos relacionados a sintomas psiquiátricos ou comportamentais com o Montelucaste relatados entre julho de 1998 e janeiro de 2022. Destes, 3.173 casos estão relacionados a crianças dos 2 aos 11 anos, 761 casos de crianças entre 12 e 17 anos, 2.941 casos a adultos e a idade não foi estabelecida para 1.591 casos. Os distúrbios do sono foram os principais sintomas em crianças < 2 anos, enquanto a depressão ou ansiedade foram os sintomas preponderantes para crianças entre 2 e 11 anos em uma análise retrospectiva da VigiBase após 2015.42
Referências
01.Philip G, Nayak AS, Berger WE at al. The effect of montelukast on rhinitis symptoms in patients with asthma and seasonal allergic rhinitis. Curr Med Res Opin 2004; 20:1549-58.
02.Israel E, Dermarkarian R, Rosenberg M, Sperling R, Taylor G, Rubin P, Drazen JM.
The effects of a 5-lipoxygenase inhibitor on asthma induced by cold, dry air. N Engl J Med 1990; 323:1740-4.
03.Israel E, Fischer AR, Rosenberg MA, Lilly CM, Callery JC, Shapiro J, Cohn J, Rubin P, Drazen JM.
The pivotal role of 5-lipoxygenase products in the reaction of aspirin-sensitive asthmatics to aspirin. Am Rev Respir Dis 1993; 148:1447-51.
04.Israel E, Rubin P, Kemp JP, Grossman J, Pierson W, Siegel SC. The effect of inhibition of 5-lipoxygenase by zileuton in mild-to-moderate asthma. Am Inter Med 1993; 119:1059-66.
05.Diamant Z, Lammers JWJ, Sterk PJ. Leukotriene receptor antagonists and biosynthesis inhibitors in asthma. Clin Immunother 1994; 2:220-32.
06.O' Byrne P.M, Watson RM, Stong HA, et al. The effect of treatment with a 5-lipoxygenase inhibitor, BAY-X-1005, on allergen-induced asthmatic responses in human subjects. Am J Respir Crit Care Med 1994; 149:A532.
07.Henderson WR Jr. The role of leukotrienes in inflammation. Ann Intern Med 1994; 121:684-97.
08.Piper PJ. Pharmacology of leukotrienes. Br Med Bull 1983; 39:255-9.
09.Serphan CN, Haeggstrom JZ, Leslie CC. Lipid mediator networks in cell signaling: update and impact of cytokines. FASEB J 1996; 10:1147-58
10.Taylor IK, O' Shaughnessy KM, Fuller RW, et al. Effect of cysteinyl-leukotriene receptor antagonist ICI 204.219 on allergen-induced bronchoconstriction and airway hyperreactivity in atopic subjects. Lancet 1991; 337:690-4.
11.Finnerty JP, Wood-Baker R, Thompson H, Holgate ST. Role of leukotrienes in exercise-induced asthma. Inibitory effect of ICI 204219, a potent leukotriene D 4 receptor antagonist. Am Rev Respir Dis 1992; 145:746-49.
12.Rasmussen JB, Eriksson LO, Margolskee DJ, Tagari P, Williams VC, Andersson KE.
Leukotriene D 4 receptor blockade inhibits the immediate and late bronchoconstrictor reponses to inhaled antigen in patients with asthma. J Allergy Clin Immunol 1992; 90:193-201.
13.Adelroth E, Inman MD, Summers E, Pace D, Modi M, O'Byrne PM. Prolonged protection against exercise-induced bronchoconstriction by the leukotriene D 4 receptor antagonist cinalukast. J Allergy Clin Immunol 1997; 99:210-5.
14.Dahlén B, Kumlin M, Margolskee DJ. The leukotriene-receptor antagonist MK-0679 blocks airway obstruction induced by inhaled lysine-aspirin in aspirin-sensitive asthmatics. Eur Respir J 1993; 6:1018-26.
15.Christie PE, Smith CM, Lee TH. The potent and selective sulfidopeptide leukotriene antagonist, SK&F 104353, inhibits aspirin-induced asthma. Am Respir Dis 1991; 144:957.
16.Cloud ML, Enas GC, Kemp J, Platts-Mills T, Altman LC, Townley R, Tinkelman D, King T Jr, Middleton E, Sheffer AL, et al.
A specific LTD 4 /LTE 4 receptor antagonist improves pulmonary function in patients with mild, chronic asthma. Am Rev Respir Dis 1989; 140:1336-9.
17.Spector SL, Smith LJ, Glass M. Effects of six weeks of therapy with oral doses of ICI 204.219, a leukotriene D 4 receptor antagonist, in subjects with bronchial asthma. Am J.Respir Crit Care Med 1994; 150:618-23.
18.Gaddy JN, Margolskee DJ, Bush RK, Williams VC, Busse WW. Bronchodilatation with a potent and selective leukotriene D 4 (LTD 4 ) receptor antagonist (MK-571) in patients with asthma. Am Rev Respir Dis 1992; 146:358-63.
19.Wahedna I, Wisniewski AFZ, Wong CS, et al. Effect of multiple doses of RG-12.525, an oral leukotriene D 4 antagonist, in chronic asthma. Am Rev Respir Dis 1992; 145:A16.
20.Henderson WR Jr, Tang LO, Chu SJ, Tsao SM, Chiang GK, Jones F, Jonas M, Pae C, Wang H, Chi EY.
A role for cysteinyl leukotrienes in airway remodeling in a mouse asthma model. A J Respir Crit Care Med 2002; 165:108-16.
21.Kemp JP, Glass M, Minkwitz MC. Onset of action of the leukotriene receptor antagonist zafirlukast ('Accolate') in patients with asthma. J.Allergy Clin.Immunol 1995; 95; Abs 839 and Poster Presentation at AAAAI, New York. 1995.
22.Leff JA, Busse WW, Pearlman D, Bronsky EA, Kemp J, Hendeles L, Dockhorn R, Kundu S, Zhang J, Seidenberg BC, Reiss TF.
Montelukast, a leukotriene-receptor antagonist, for treatment of mild asthma and exercise-induced bronchoconstriction. N Engl J Med 1998; 339:147-52.
23.Yokoyamo A, Kohno N, Sakai K, Hirasawa Y, Knodo K, Hiwada K. Effect of pranlukast, a leukotriene receptor antagonist, in patients with severe asthma refractory to corticoesteroids. J Asthma 1998; 35:57-62.
24.ZYFLO filmtab. In: Physicians' desk reference.52nd ed.Montvale,N.J.: Medical Economics, 1998:474.
25.Wechsler ME, Garpestad E, Flier SR, Kocher O, Weiland DA, Polito AJ, Klinek MM, Bigby TD, Wong GA, Helmers RA, Drazen JM.
Pulmonary infiltrates, eosinophilia, and cardiomyopathy following corticosteroid withdraw in patients with asthma receiving zafirlukast. JAMA 1998; 279:455-7.
26.Drazen JM, Israel E, O'Byrne PM. Treatment of asthma with drugs modifying the leukotriene pathway. N Engl J Med 1999; 340:197206.
27.Wechsler ME, Finn D, Gunawardena D, Westlake R, Barker A, Haranath SP, Pauwels RA, Kips JC, Drazen JM. Churg-Strauss syndrome in patients reciving montelukast as treatment for asthma. Chest 2000; 117:708-13.
28.Mitsuyama H, Matsuyama W, Iwakawa J, Higashimoto I, Watanabe M, Osame M, Arimura K. Increased serum vascular endothelial growth factor level in Churg-Strauss Sybdrome. Chest 2006; 129:407-11.
29.Tatsis E, Schnabel A, Gross WL. Interferon-alpha treatment of four patients with Churg-Strauss syndrome. Ann Intern Med 1998; 129:370-374.
30.De Caterina R, Zampolli A. From asthma to atherosclerosis — 5-Lipoxygenase, leukotrienes, and inflammation. N Engl J Med 2004; 350:4.
31.Malmstrom K, Rodriguez-Gomez G, Guerra J, et al. Oral montelukast, inhaled beclomethasone, and placebo for chronic asthma. A randomized controlled trial. Ann Intern Med 1999; 130:487-495.
32.Silverman ES, Du J, De Sanctis GT, Rådmark O, Samuelsson B, Drazen JM, Collins T. Egr-1 and Sp1 interact functionally with the 5-lipoxygenase promoter and its naturally occurring mutants. Am J Respir Cell Mol Biol 1998; 19:316-323.
33.Drazen JM, Yandava CN, Dubé L, Szczerback N, Hippensteel R, Pillari A, Israel E, Schork N, Silverman ES, Katz DA, Drajesk J. Pharmacogenetic association between ALOX5 promoter genotype and the response to anti-asthma treatment. Nat Genet 1999; 22:170-172.
34.Wechsler ME, Israel E. Pharmacogenetics of tretment with leukotriene modofiers. Curr Opin Allergy Clin Immunol 2002; 2:395-401.
35.Maeba S, Ichiyama T, Ueno Y, Makata H, Matsubara T, Furukawa S.
Effect of montelukast on nuclear factor kB activation and proinflammatory molecules. Ann Allergy Asthma Immunol 2005; 94:670-674.
36.Can M, Yüksel B, Demirtas S, Tomaç N. The effect of montelukast on soluble interleukin-2 receptor and tumor necrosis factor alpha in pediatrics patients. Allergy Asthma Proc 2006; 27:383-386.
37.Langlois A, Ferland C, Tremblay GM, Laviolette M.
Montelukast regulates eosinophil protease activity through a leukotriene-independent mechanism. J Allergy Ckin Immunol 2006; 118:113-119.
38.Wada K, Minoguchi K, Adachi M, Oda N, Matsuura T, Kawazu K, et al. Effect of leukotriene receptor antagonist, pranlukast hydrate, on airway inflammation and airway hyper responsiveness in patients with moderate to severe asthma. Allergol Int 2000; 49:63-8.
39.American Lung Association Asthma Clinical Research Centers, Peters SP, Anthonisen N, Castro M, Holbrook JT, Irvin CG, Smith LJ, Wise RA.
Randomized comparison of strategies for reducing treatment in mild persistent asthma. N Engl J Med 2007; 356:2027-39.
40.Price D, Musgrave SD, Shepstone L, Hillyer EV, Sims EJ, Gilbert RF, et al. Leukotriene antagonists as first-line or add-on asthma-controller therapy. N Engl J Med 2011; 364:1695-707.
41.FDA requires Boxed Warning about serious mental health side effects for asthma and allergy drug montelukast (Singulair); advises restricting use for allergic rhinitis. FDA, 2020. Disponível via www. Arquivo capturado em 28 de abril de 2020. URL: https://www.fda.gov/drugs/drug-safety-and-availability/fda-requires-boxed-warning-about-serious-mental-health-side-effects-asthma-and-allergy-drug.
42.Ekhart C, van Hunsel F, Sellick V, de Vries T. Neuropsychiatric reactions with the use of montelukast. BMJ 2022 Mar 29; 376:e067554. doi: 10.1136/bmj-2021-067554. PMID: 35351683.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|