|
Asma
Tratamento da Asma
MONITORAMENTO DA INFLAMAÇÃO
As características principais da asma são a limitação intermitente ao fluxo aéreo, a presença de hiper-responsividade brônquica (HRB), a inflamação brônquica e o remodelamento. De todas, a inflamação é a manifestação principal, sendo os corticoides por inalação as drogas de primeira linha para o seu tratamento, prescritos a partir da Etapa 2 de sua abordagem para controlar a doença.
O tratamento dos pacientes com asma depende do monitoramento dos sintomas e da função respiratória (VEF1, PFE). Como pôde ser avaliado nos capítulos anteriores, a inflamação brônquica pode estar presente em pacientes asmáticos, mesmo quando assintomáticos, sugerindo que parâmetros clínicos e da função respiratória não são suficientes para refletir a extensão da inflamação.
A avaliação da inflamação brônquica pode ser efetuada através de procedimentos invasivos (broncoscofibroscopia com biópsias e lavado broncoalveolar) ou não invasivos, que incluem os testes de broncoprovocação diretos e indiretos e os marcadores biológicos da asma (Tabela 1).
Tabela 1 — Marcadores Biológicos na Asma
| MARCADORES BIOLÓGICOS NA ASMA |
SANGUE/SORO |
Eosinófilos |
Proteína Eosinofílica Catiônica (ECP) |
Peroxidase Eosinofílica (EPO) |
Receptor Solúvel de Interleucina-2 (sIL-2R) |
Periostina |
URINA |
9α11ß-PGF2 |
Leucotrieno E2 |
Proteína X Eosinofílica (EPX) |
ESCARRO INDUZIDO |
Mediadores solúveis |
Celularidade |
AR EXALADO |
Oxido Nítrico (NO) |
Monóxido de Carbono (CO) |
Hidrocarbonetos |
ß-isoprostane F2α |
Nitrotirosina |
Adenosina |
Testes de Provocação
A hiper-responsividade das vias aéreas (HRB) é uma das características da asma, estando diretamente relacionada à inflamação, sendo avaliada pelos chamados testes de provocação. A HRB é um aumento anormal na limitação ao fluxo aéreo após exposição a estímulos, sendo que a maioria dos pacientes com asma sintomática apresenta HRB mensurável. Pacientes com asma leve, durante as exacerbações, apresentam vias aéreas menos responsivas do que aqueles com asma severa.1
Um grande número de estudos detectou correlações entre a HRB e os componentes celulares da inflamação brônquica, com a variação do calibre das vias aéreas, com os sintomas e com a gravidade clínica da doença. Por outro lado, igual número de publicações não obteve correlação significativa entre os marcadores de inflamação e o grau de HRB.2,3 A aplicabilidade clínica dos testes de provocação para a monitoração da inflamação ainda está por ser determinada, em decorrência de controvérsias. Por exemplo, Sont et al.4 em estudo propuseram a incorporação do teste de provocação à metacolina como um teste adicional para o acompanhamento e ajuste da terapia anti-inflamatória. Por outro lado, Crime et al.5 não encontraram associação entre hiper-responsividade e inflamação brônquicas. Nesta publicação, a análise por regressão múltipla não revelou correlação significativa entre o grau de responsividade à metacolina e o número de células inflamatórias no escarro, no lavado broncoalveolar e em biópsias brônquicas. Crime et al.5 utilizaram uma amostra com cerca de 71 pacientes, sendo que a HRB encontrada independia do número de células inflamatórias na mucosa ou luz das vias aéreas. Deve levar-se em consideração que apesar de ser um teste bem padronizado, sua execução não pode ser considerada fácil, não sendo também isenta de riscos.
Marcadores de Sangue
Agora há evidências de grandes estudos de intervenção em asma leve, moderada e grave de que a contagem de eosinófilos no sangue periférico está associada a um risco aumentado de até cinco vezes para exacerbações graves, bem como uma maior resposta aos corticoides por inalação e aos agentes biológicos.6-9 A contagem de eosinófilos periférica aumenta ≥ 0,30 × 109/L quando ocorre inflamação tipo TH2-alta ou exacerbações da asma.10-12
A periostina, é uma proteína da matrix extracelular, mensurável no sangue periférico, produzida pela IL-4 e IL-13 no epitélio das vias aéreas e fibroblastos pulmonares.13,14 Ela provou ser um importante biomarcador TH2 associado à inflamação das vias aéreas e potencial determinante da maior expressão de eosinofilia e mediadores inflamatórios nas vias aéreas. É um marcador que pode seguir em paralelo com a medição do FeNO e principalmente com a dosagem de eosinófilos tanto no escarro, como em biópsia brônquica. Jia et al. avaliando 59 pacientes com asma grave através de um modelo
de regressão logística, incluindo sexo, idade, índice de massa corporal, níveis de IgE, número de eosinófilos no sangue, níveis de Feno e níveis séricos de periostina, mostrou que, desses índices, o nível sérico de periostina foi o melhor preditor de eosinofilia das vias aéreas (P = 0,007).15
Na presença de histamina, a expressão de periostina por outras células está aumentada. Há limitações de seu uso principalmente em pacientes com osteoporose e fraturas recentes. Este aspecto se deve ao fato de a periostina ser uma proteína extracelular produzida por osteoblastos. Alguns tumores especialmente associados a metástases ósseas também podem gerar resultados séricos elevados.16
Marcadores Urinários
A peroxidase urinária eosinofíilica (EPO) oferece uma vantagem sobre a ECP do soro, por ser menos invasiva, especialmente quando da análise em pacientes pediátricos com asma. Outras investigações analisam os metabólitos eicosanoides na urina, como o LTE4 e o 9a,11ß-PGF2. Vários estudos têm demonstrado o aumento basal significativo da excreção do LTE4 em pacientes com asma, principalmente os sensíveis à aspirina.17-19
Escarro Induzido
Durante os últimos anos, um método utilizado no passado para o diagnóstico bacteriológico da tuberculose foi reintroduzido na prática clínica para permitir um rápido diagnóstico (não invasivo) de infecções oportunísticas em pacientes com SIDA.20 Trata-se da indução da produção de escarro através de nebulização ultrassônica de solução salina hipertônica. A partir do começo da década de 90, o método foi adotado por alguns investigadores para o estudo da inflamação da asma.21-26 Esta nova aplicação, para uma técnica antiga, foi padronizada (Tabela 2) ao longo dos anos, passando a ser utilizada tanto em protocolos de pesquisa como na clínica.
No escarro induzido de indivíduos normais, o tipo celular predominante é o macrófago, com pequenas quantidades de neutrófilos. Em pacientes com DPOC, aumentam os macrófagos, mas muito mais os neutrófilos e há até mesmo pequenas quantidades de eosinófilos. O escarro colhido de pacientes com exacerbação da asma contém um alto número de eosinófilos27 e de marcadores solúveis de inflamação, ocorrendo a redução de ambos com o tratamento com corticoides por via oral28 e/ou por inalação,29,30 demonstrando que a contagem seriada do número destas células e a análise dos mediadores pode ser útil para o monitoramento do tratamento, para a avaliação da adesão e para a determinação da gravidade da doença.
Tabela 2 — Protocolo para Obtenção de Escarro Induzido
1 – |
Pré-tratamento do paciente com 200 mcg de salbutamol ou equivalente
|
2 – |
Efetuar prova de função respiratória antes e 10 minutos após inalação do ß2-agonista, porém, antes da indução
|
3 – |
Obliterar as narinas com um 'pince nez'
|
4 – |
Iniciar a indução ou com solução salina normal (em pacientes com alto risco) ou 4,5% de solução salina. Outra opção, iniciar com 3% e progredir até 5%, com mudanças de concentração a cada 5 minutos de intervalo
|
5 – |
Solicitar ao paciente que expectore sempre que sinta necessidade ou a cada cinco minutos de intervalo
|
6 – |
Verificar o VEF1 e no caso de não disponibilidade de espirometria utilizar o PFE a cada 5 minutos
|
7 – |
Continuar a indução por 3 a 5 minutos e se necessário por mais 5 minutos, caso a amostra não seja adequada
|
8 – |
Interromper o procedimento após 20 minutos ou se ocorrer queda de 20% no VEF1 ou PFE
|
Esta metodologia, de boa reprodutibilidade, validade e responsividade ainda não é largamente utilizada em nosso meio, nem na prática clínica, nem como instrumento para o diagnóstico ou para o acompanhamento seriado da doença, pois se trata de um exame com certas características técnicas especializadas que demandam recursos.31
O escarro é induzido através da inalação de solução salina hipertônica a 3% por períodos de 3 – 7 minutos ou 3, 4 e 5% por período de 5 minutos para cada percentual. Esta técnica pode ser aplicada em adultos e crianças acima de sete anos, podendo ser repetida em várias ocasiões. O aumento da resistência das vias aéreas através de solução salina hipertônica, que é um potente estímulo broncoconstritor indireto, pode ser minimizado pela nebulização prévia com ß2-agonista, o que não altera a avaliação da celularidade.32 No caso de pacientes com asma moderada/severa ou em vigência de crise, utiliza-se a solução isotônica (0,9%) que proporciona maior segurança, com resultados comparáveis aos obtidos pela nebulização com solução hipertônica, tanto na contagem celular de eosinófilos e neutrófilos como na avaliação dos mediadores/proteínas da fase líquida.33
O mecanismo da produção de escarro após provocação com solução salina hipertônica não é de todo conhecido. O sucesso da técnica parece estar relacionado à redução na viscosidade do muco traqueobrônquico por aumento do fluxo de água através do epitélio, ao aumento no volume secretado pelas glândulas das vias aéreas, ao aumento do clearance mucociliar e pela estimulação dos receptores da tosse. Os efeitos adversos da inalação incluem a queda do VEF1 (5–7%), queda na saturação de oxigênio e desconforto no paciente. Aconselha-se interromper a nebulização se ocorrer queda do VEF1 ≥ 20%.
As técnicas usadas para induzir e processar o escarro diferem pouco entre os vários grupos.34 Utiliza-se um nebulizador ultrassônico de débito moderado (ao redor de 1 ml/min) pois apresenta uma performance superior ao nebulizador de jato (tradicional) que apresenta baixo débito. Em alguns centros, o escarro é induzido pela inalação de concentrações progressivas de solução salina hipertônica por períodos fixos de tempo, enquanto que em outros centros a concentração é fixa, com períodos de tempo mais prolongado. A duração da inalação deve ser de 15 minutos, prorrogáveis por mais 5 minutos se uma amostra adequada não for obtida.
O processamento do material expectorado também difere, pois a saliva é um contaminante que pode influir na interpretação do exame. A contaminação salivar pode ser minimizada pela seleção microscópica da porção mucocelular viscosa da amostra.35,36 Uma segunda técnica processa toda a amostra, que engloba a saliva e o escarro. Outra técnica consiste na coleta seletiva de saliva e escarro, visando evitar a contaminação pela saliva. O escarro colhido separadamente da saliva contém maior proporção de células viáveis (células epiteliais do trato inferior baixo, macrófagos, neutrófilos, eosinófilos, mastócitos, basófilos, linfócitos), e menor quantidade de células epiteliais escamosas que provêem do trato respiratório superior, propiciando uma avaliação celular de melhor qualidade.
Alguns procedimentos tentam evitar a contaminação com as células epiteliais. Preconiza-se lavar a boca com água antes de cada expectoração, secando-a com lenço de papel. Recomenda-se assoar o nariz antes da indução para minimizar a contaminação com a descarga pós-nasal. No entanto, durante a indução o nariz deve ser obliterado com um " pince-nez ".
O processamento do material deve ser efetuado o mais rápido possível, dentro de 2 h, pois existe a possibilidade de ocorrer dano do material celular assim como dos mediadores solúveis. As amostras são mantidas no gelo. O escarro é expectorado sobre uma placa de Petri e então removido para um tubo cônico onde é solubilizado.
As amostras selecionadas são colocadas em um tubo de poliestireno de 15 ml, liquefeitas pela adição de quatro vezes o seu volume, de um agente mucolítico, o ditiotreitol (DTT) a 0,1%, ou ditioeritritol (DTE), que se mostram mais eficazes na dispersão das células do que a técnica pela adição salina. Ambas atuam quebrando as pontes dissulfito das grandes moléculas de mucina. A mistura é agitada por 15 segundos e aspirada e ejetada através de uma pipeta de Pasteur. O tubo de poliestireno é colocado em um agitador de mesa e a amostra é agitada por 15 minutos. Logo após são adicionados 4 volumes de solução salina tamponada em fosfato de Dulbecco - D-PBS (Dulbeccos phosphate buffered saline) para sustar o efeito do DTT, prosseguindo a agitação por mais 5 minutos. A suspensão é filtrada através de um filtro de náilon com microporos de 48 µm, para a obtenção de uma amostra homogênea, sem debris e muco. A suspensão obtida é centrifugada a 790 x g por 10 minutos e o sobrenadante aspirado e armazenado em tubos Eppendorf a – 70º C para futura análise dos componentes da fase líquida, tais como citocinas (IL-1ß, IL-5, IL-8, TNFa, RANTES...) e mediadores inflamatórios (ECP, triptase, fibrinogênio).
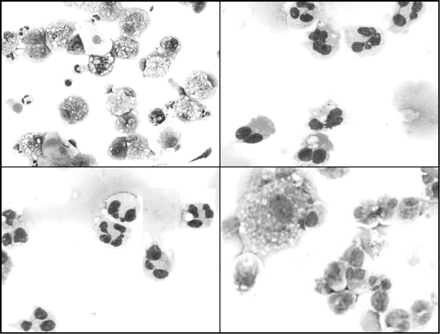
O conglomerado de células que se depositam no fundo (cell pellet) é aspirado por pipeta e a contagem total de leucócitos é obtida através de uma câmara modificada de Neubauer (hemocitômetro). A viabilidade celular é determinada pelo método de exclusão do trypan blue (as células mortas aparecem em azul) e calcula-se o número absoluto de células por mg de escarro. Setenta e cinco µl da suspensão são colocados em recipientes de uma citocentrífuga e quatro citospinas codificadas são preparadas a 450 rpm por 6 minutos. O objetivo é manter as células intactas, permitindo que a morfologia das células seja examinada. As lâminas são secas e coradas geralmente pelo Giemsa, objetivando a futura:
Análise sob microscopia da composição celular da amostra (Figura 1);
● Coloração imunocitoquímica de marcadores celulares (EG-2, triptase, HLA-DR...)
● Citometria de fluxo para a determinação dos marcadores de superfície (eosinófilos, neutrófilos, linfócitos...)
O valor normal da contagem de eosinófilos no escarro não está universalmente aceito, sendo a sensibilidade ao método alta quando o teste é efetuado em pacientes virgens de tratamento, sendo a especificidade média.
Alguns estudos sugerem que um valor de contagem de eosinófilos no escarro induzido superior a 3% pode ser considerado elevado e indicativo de inflamação das vias aéreas em pacientes com asma ou outras doenças pulmonares. No entanto, outros estudos propõem diferentes pontos de corte para diferentes grupos de pacientes ou populações.37-41
Ar Exalado e Condensado
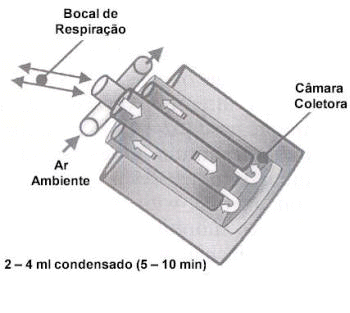
 O ar exalado pode ser condensado através de diferentes dispositivos de resfriamento (Figura 2), resultando em 1–2 ml de condensação da respiração exalada por 10 minutos de respiração normal, ao nível de volume corrente. Este procedimento é não invasivo, simples e fácil de executar em pacientes de qualquer idade. O ar exalado pode ser condensado através de diferentes dispositivos de resfriamento (Figura 2), resultando em 1–2 ml de condensação da respiração exalada por 10 minutos de respiração normal, ao nível de volume corrente. Este procedimento é não invasivo, simples e fácil de executar em pacientes de qualquer idade.
Vários gases, como o óxido nítrico (NO), o monóxido de carbono (CO) e hidrocarbonetos têm sido medidos no ar exalado de adultos e crianças. Mais recentemente, marcadores não voláteis e mediadores (peróxido de hidrogênio, leucotrienos, prostaglandinas, citocinas, produtos de peroxidação de lipídios, adenosina, amônia, endotelina-1...) podem ser analisados no ar exalado e condensado. Estes marcadores exalados são utilizados para monitorar a inflamação das vias aéreas e o estresse oxidativo na asma, DPOC, fibrose cística e bronquiectasias, assim como no acompanhamento da resposta terapêutica durante o tratamento com corticoides, antagonistas de receptor de leucotrienos etc.
 O CO endogenamente produzido, considerado um marcador da inflamação e do estresse oxidativo,42 encontra-se moderadamente aumentado no adulto43 e na asma pediátrica.44 Os níveis elevados de CO na asma estável ocorrem devido à elevação da expressão da Heme-oxigenase-1 (HO-1), enzima capaz de ser induzida por uma série de estímulos como citocinas pró-inflamatórias, toxinas bacterianas, ozônio, etc. Devido à elevação da atividade HO-1, as concentrações de bilirrubinas no escarro induzido também se encontram elevadas. Em função da simplicidade da mensuração do CO e portabilidade dos analisadores de CO, esta técnica pode ser útil no monitoramento da asma pediátrica. O CO endogenamente produzido, considerado um marcador da inflamação e do estresse oxidativo,42 encontra-se moderadamente aumentado no adulto43 e na asma pediátrica.44 Os níveis elevados de CO na asma estável ocorrem devido à elevação da expressão da Heme-oxigenase-1 (HO-1), enzima capaz de ser induzida por uma série de estímulos como citocinas pró-inflamatórias, toxinas bacterianas, ozônio, etc. Devido à elevação da atividade HO-1, as concentrações de bilirrubinas no escarro induzido também se encontram elevadas. Em função da simplicidade da mensuração do CO e portabilidade dos analisadores de CO, esta técnica pode ser útil no monitoramento da asma pediátrica.
Outra abordagem é efetuada através da medida de mediadores não voláteis no condensado do ar expirado, a fase líquida do ar exalado (Figura 4). Este é um procedimento não invasivo, fácil de ser executado por crianças ou pacientes, mesmo com asma severa. O paciente respira através de uma válvula que impede a reinspiração (válvula unidirecional), com um obliterador nasal e um dispositivo que evita a contaminação com a saliva. Geralmente dez minutos são suficientes para obter 2–4 ml de amostra, sendo bem tolerado pelo paciente. Durante a expiração, o ar flui através de um condensador, resfriado a - 20ºC. Não se utiliza filtro entre o paciente e o condensador. O condensado é analisado por cromatografia gasosa e/ou extração espectofotométrica, ou por imunoensaio.45
 O condensado de asmáticos contém níveis elevados de leucotrienos (B4, C4, D4, E4). Altos níveis de nitrito/nitrato (NO2- /NO3- ) e O condensado de asmáticos contém níveis elevados de leucotrienos (B4, C4, D4, E4). Altos níveis de nitrito/nitrato (NO2- /NO3- ) e
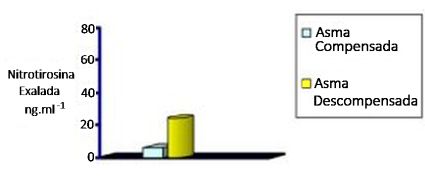
S-nitrosotióis, produtos da interação do NO com o superóxido e tióis, têm sido encontrados no condensado exalado de pacientes com asma,46 assim como níveis elevados de 8-isoprostane F2a, outro marcador não invasivo do estresse oxidativo.47 Níveis elevados de nitrotirosina no condensado exalado estão associados à piora nos sintomas da asma e deterioração na função pulmonar quando da suspensão do tratamento com corticoides por inalação na asma moderada,48 qualificando a nitrotirosina como um agente preditivo da deterioração da asma (Figura 4).
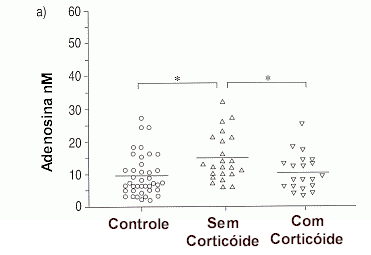 As medidas da adenosina no condensado exalado são reprodutíveis e se encontram aumentadas na asma esteroide naïve e em pacientes com exacerbação da doença, servindo como marcador e na monitoração da inflamação brônquica aguda e crônica. Em pacientes que utilizam o corticoide por inalação como tratamento, com redução do nível de inflamação, a concentração de adenosina cai aos níveis encontrados no grupo controle não asmático (Figura 5).49 As medidas da adenosina no condensado exalado são reprodutíveis e se encontram aumentadas na asma esteroide naïve e em pacientes com exacerbação da doença, servindo como marcador e na monitoração da inflamação brônquica aguda e crônica. Em pacientes que utilizam o corticoide por inalação como tratamento, com redução do nível de inflamação, a concentração de adenosina cai aos níveis encontrados no grupo controle não asmático (Figura 5).49
Pesquisadores da Universidade de Bari, Itália, relataram pela primeira vez no Annual Meeting of the American Academy of Allergy, Asthma and Immunology (AAAAI) de 2004, que o pH do condensado exalado é capaz de predizer exacerbações de asma em crianças. Estudaram 104 crianças com asma leve persistente, 70 com doença estabilizada enquanto que 34 tiveram exacerbações. Destas com asma descontrolada, o pH do condensado apresentava significante redução (7,25) enquanto que o pH das crianças com doença estabilizada era de 7,32. Ambos eram, no entanto, menor do que o pH do condensado de crianças sem asma (7,78). Após o tratamento ocorreu ascensão de 7,25 para 7,75.50 Havia correlação entre o pH e o VEF1.
Óxido Nítrico Exalado
O NO é um radical livre gasoso, com uma meia-vida extremamente curta, de alguns segundos, rapidamente destruído pela interação como o oxigênio. Na asma o NO é o teste de respiração exalada mais utilizado na prática clínica. Trata-se de um teste útil, prático, confortável, sensível, reprodutível, não invasivo, que apresenta forte correlação com a inflamação das vias aéreas.
 As técnicas e os valores de referência para todas as idades para a medida do NO exalado foram estandardizados pela European Respiratory Society (ERS) e pela American Thoracic Society (ATS) em 2005.51,52 Recentemente os consensos foram atualizados, esperando-se novas publicações para breve. As normas para o paciente pediátrico, aprovadas pela ATS e ERS, também estão disponíveis.53 As técnicas e os valores de referência para todas as idades para a medida do NO exalado foram estandardizados pela European Respiratory Society (ERS) e pela American Thoracic Society (ATS) em 2005.51,52 Recentemente os consensos foram atualizados, esperando-se novas publicações para breve. As normas para o paciente pediátrico, aprovadas pela ATS e ERS, também estão disponíveis.53
A medida é efetuada através de aparelhos que utilizam analisador de gás NO (Figura 6) por quimiluminescência e o laser, de alta sensibilidade e especificidade, capaz de detectar moléculas de NO em muito baixas concentrações. A análise por quimiluminescência é baseada na medida da intensidade da radiação fluorescente emitida após oxidação química do NO pelo ozônio – NO + O3 –, utilizando um tubo fotomultiplicador sensível. O produto desta reação é o NO2* + O2 (onde * simboliza a luz emitida). O NO2* emite um fóton e o número total de fótons produzidos é proporcional à concentração de NO.54
O teste é efetuado pelo método de respiração única:
1 – Na posição sentada o paciente esvazia os pulmões;
2 – Através da peça bucal o paciente inala ar isento de NO, em 2 – 3 segundos, eliminando a possibilidade de qualquer contaminação através do ar ambiente, até o nível da CPT;
3 – Sem interrupção, passa então a exalar lentamente através da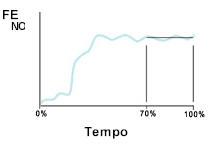 peça bucal, durante 10 segundos, mantendo o fluxo expiratório constante de 0,05l segundo-1 (BTPS) através de uma válvula mecânica contendo uma membrana elástica, quando ao final efetua-se a leitura. Uma pressão de 5–20 cm H2O é gerada durante a exalação, o que fecha o palato, propiciando a exclusão nasal. peça bucal, durante 10 segundos, mantendo o fluxo expiratório constante de 0,05l segundo-1 (BTPS) através de uma válvula mecânica contendo uma membrana elástica, quando ao final efetua-se a leitura. Uma pressão de 5–20 cm H2O é gerada durante a exalação, o que fecha o palato, propiciando a exclusão nasal.
4 – O valor da FeNO é calculado pela criação de um platô por no mínimo 3 segundos. Como a exalação ocorre em 10 segundos, o platô situa-se entre 70 a 100% da exalação (entre 7 – 10 segundos) (Figura 7).
Na atualidade
os dispositivos para medir a FeNO
empregam tecnologia mais moderna que utiliza leitura através de sensor eletroquímico que torna as leituras equivalentes àquelas obtidas com
quimioluminescência. Ao contrário da geração anterior os novos aparelhos são mais compactos, portáteis, fáceis de manusear e de manter, mais rápidos e baratos.55
Em não fumantes, a fração exalada normal de NO (FeNO50) é < 25 partes por bilhão (ppb) para adultos a 50 ml/seg e em crianças < 20 ppb. Valores maiores que 50 ppb (> 35 ppb em crianças) são altamente preditivos de inflamação TH2 eosinofílica de vias aéreas e de provável resposta positiva ao tratamento com corticoide por inalação (Tabela 3).
Tabela 3 — Níveis de FeNO e Inflamação
| FeNO BAIXA |
FeNO INTERMEDIÁRIA |
FeNO ALTA |
| <25 ppb (crianças < 20 ppb) |
25–50 ppb (crianças 25–30 ppb) |
>50 ppb (crianças >35 ppb) |
| Inflamação Eosinofílica: Improvável |
Inflamação Eosinofílica: Presente, mas leve
|
Inflamação Eosinofílica: Significativa |
⇓ |
⇓ |
⇓ |
Responsividade ao corticoide é menos provável |
Os resultados devem ser interpretados com cautela e no contexto clínico |
Resposta aos corticoides provável em pacientes sintomáticos |
Evolutivamente, reduções na FeNO (< 25 ppb em adultos; < 20 em crianças abaixo de 12 anos) podem ter um papel na identificação de pacientes em que se pode reduzir com segurança as doses de corticoide.
Valores entre > 25 em adultos são encontrados 70–80% de pacientes com asma não tratada, na asma neutrofílica, na síndrome da hiperventilação/ansiedade, na disfunção das cordas vocais, na rinossinusite, na doença do refluxo gastresofagiano (DRGE) e na doença cardíaca e em 30–40% dos pacientes com tosse crônica. Nas crianças, medidas entre 25–40 são encontradas na DRGE, na asma neutrofílica, na síndrome da hiperventilação e nas imunodeficiências.
Considera-se como altamente provável a inflamação eosinofílica sempre que a FeNO50 for > 50 ppb em adultos e > 35 ppb em crianças. Considerar nesta situação as hipóteses de asma atópica, se a história for compatível e se o VEF1 for < 80% do teórico, bronquite eosinofílica e síndrome de Churg-Strauss.
Aumentos na FeNO são observados na asma e em outras condições não eosinofílicas, como infecções virais das vias aéreas, síndrome da bronquiolite obliterante e na DPOC. Nos pacientes com asma os valores podem se elevar 3–5 vezes. Se as medidas se mantêm elevadas apesar de tratamento anti-inflamatório, devem ser consideradas as possibilidades de: pouca aderência ao tratamento, recente exposição a alérgenos ou fatores desencadeantes, dose inadequada do anti-inflamatório ou a possibilidade de tratar-se de um não respondedor aos anti-inflamatórios. A medida da FeNO deve sempre ser efetuada antes da espirometria, ou de qualquer atividade física e os examinados devem abster-se, por uma hora, de fumar ou ingerir alimentos ou líquidos. As infecções virais,56 a rinite alérgica57 e dieta rica em nitrato58 podem influenciar os resultados, elevando-os. O tabagismo reduz os valores da FeNO. Fumantes "saudáveis" normalmente têm níveis de FeNO entre 2–10 ppb.59 Quando os resultados são elevados, pode significar inflamação eosinofílica, merecendo investigação criteriosa, principalmente se houver história de asma em algum período da vida. A sensibilidade do teste FeNO é alta em pacientes não tratados60.
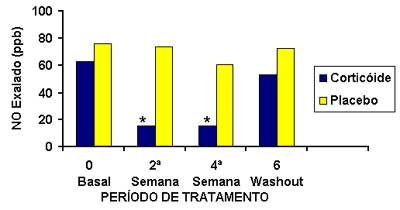 Os corticoides não têm efeito no NO exalado em indivíduos normais,61 porém reduzem a FeNO em asmáticos, principalmente naqueles com doença severa.62,63 Na asma atópica, níveis elevados exalados (bucal e nasal) de NO correlacionam-se de forma significativa com os testes cutâneos, a IgE total e a eosinofilia sanguínea. A FeNO é extremamente sensível ao tratamento com corticoides, sendo que a redução no NO pode ser detectada após 6 h de uma única dose de corticoide nebulizado, ou dentro de 2 – 3 dias após o tratamento com corticoide inalado.64-66 (Figura 8) Níveis persistentemente elevados da FeNO em pacientes asmáticos tratados com corticoides refletem ou a pouca aderência do paciente ao tratamento ou um tratamento não eficaz.67-69 Os corticoides não têm efeito no NO exalado em indivíduos normais,61 porém reduzem a FeNO em asmáticos, principalmente naqueles com doença severa.62,63 Na asma atópica, níveis elevados exalados (bucal e nasal) de NO correlacionam-se de forma significativa com os testes cutâneos, a IgE total e a eosinofilia sanguínea. A FeNO é extremamente sensível ao tratamento com corticoides, sendo que a redução no NO pode ser detectada após 6 h de uma única dose de corticoide nebulizado, ou dentro de 2 – 3 dias após o tratamento com corticoide inalado.64-66 (Figura 8) Níveis persistentemente elevados da FeNO em pacientes asmáticos tratados com corticoides refletem ou a pouca aderência do paciente ao tratamento ou um tratamento não eficaz.67-69
O tratamento guiado por FeNO reduz significativamente as taxas de exacerbação em comparação com o tratamento baseado em diretrizes, pelo menos em crianças.70 No entanto, mais estudos são necessários para identificar as populações com maior probabilidade de se beneficiar do tratamento guiado por escarro ou guiado por FeNO,71, e a frequência ideal de monitoramento do FeNO.
Refererências
01.Lötvall J, Inman M, O'Byrne p. Measurement of airway hyperresponsiveness: new considerations. Thorax 2000; 53:419-24.
02.Brusasco V, Crimi E, Pellegrino R. Airway responsiveness in asthma: not just a matter of airway inflammation. Thorax 1998; 53:992-8.
03.Rosi E, Scano G. Association of sputum parameters with clinical and functional measurements in asthma. Thorax 2000; 55:235-8.
04.Sont JK, Willems LN , Bel EH, van Krieken JH, Vandenbroucke JP, Sterk PJ. Clinical control and histopathologic outcome of asthma when using airway hyperresponsiveness as an additional guide to long-term treatment. The AMPUL Study Group. Am J Respir Crit Care Med 1999; 159:1043-51.
05.Crimi E, Spanevello A, Neri M, Ind PW, Rossi GA, Brusasco V. Dissociation between airway inflammation and airway hyperresponsiveness in allergic asthma. Am J Respir Crit Care Med 1998; 157:4-9.
06.
Heaney LG, Djukanovic R, Woodcock A, Walker S, Matthews JG, Pavord ID, Bradding P, Niven R, Brightling CE, Chaudhuri R, Arron JR, Choy DF, Cowan D, Mansur A, Menzies-Gow A, Adcock I, Chung KF, Corrigan C, Coyle P, Harrison T, Johnston S, Howarth P, Lordan J, Sabroe I, Bigler J, Smith D, Catley M, May R, Pierre L, Stevenson C, Crater G, Keane F, Costello RW, Hudson V, Supple D, Hardman T.
Research in progress: Medical Research Council United Kingdom Refractory Asthma Stratification Programme (RASP-UK). Thorax 2016; 71:187–189.
07.
Castro M, Corren J, Pavord ID, Maspero J, Wenzel S, Rabe KF, Busse WW, Ford L, Sher L, FitzGerald JM, Katelaris C, Tohda Y, Zhang B,
Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med 2018; 378:2486–2496.
08.Shrimanker R, Keene O, Hynes G, Wenzel S, Yancey S, Pavord ID. Prognostic and predictive value of blood eosinophil count, fractional exhaled nitric oxide, and their combination in severe asthma: a post hoc analysis. Am J Respir Crit Care Med 2019; 200:1308–1312.
09.Pavord ID, Holliday M, Reddel HK, Braithwaite I, Ebmeier S, Hancox RJ, et al.; Novel START Study Team. Predictive value of blood eosinophils and exhaled nitric oxide in adults with mild asthma: a prespecified subgroup analysis of an open-label, parallel-group, randomised controlled trial. Lancet Respir Med [online ahead of print] 11 Mar 2020; DOI: 10.1016/S2213-2600(20)30053-9.
10.Chiappori A, De Ferrari L, Folli C, Mauri P, Riccio AM, Canonica GW. Biomarkers and severe asthma: A critical appraisal. Clin Mol Allergy 2015; 13, 20.
11.Tran TN, Khatry DB, Ke X, Ward CK, Gossage D. High blood eosinophil count is associated with more frequent asthma attacks in asthma patients. Ann. Allergy Asthma Immunol . 2014; 113:19–24.
12.Horn BR, Robin ED, Theodore J, Van Kessel A. Total eosinophil counts in the management of bronchial asthma. N Engl J Med 1975; 292:1152-5.
13.Takayama G, Arima K, Kanaji T, Toda S, Tanaka H, Shoji S, McKenzie AN, Nagai H, Hotokebuchi T, Izuhara K. Periostin: a novel component of subepithelial fibrosis of bronchial asthma downstream of IL-4 and IL-13 signals. J Allergy Clin Immunol 2006l; 118:98-104.
14.Woodruff PG, Boushey HA, Dolganov GM, Barker CS, Yang YH, Donnelly S, Ellwanger A, Sidhu SS, Dao-Pick TP, Pantoja C, Erle DJ, Yamamoto KR, Fahy JV. Genome-wide profiling identifies epithelial cell genes associated with asthma and with treatment response to corticosteroids. Proc Natl Acad Sc i U S A. 2007; 104:15858-63.
15.Jia G, Erickson RW, Choy DF, Mosesova S, Wu LC, Solberg OD, Shikotra A, Carter R, Audusseau S, Hamid Q, Bradding P, Fahy JV, Woodruff PG, Harris JM, Arron JR; Bronchoscopic Exploratory Research Study of Biomarkers in Corticosteroid-refractory Asthma (BOBCAT) Study Group. Periostin is a systemic biomarker of eosinophilic airway inflammation in asthmatic patients. J Allergy Clin Immunol 2012; 130:647-654.e10.
16.
Berry A, Busse WW.
Biomarkers in asthmatic patients: Has their time come to direct treatment? J Allergy Clin Immunol,2016; 137:1317-24.
17.Kumlin M, Dahlén B, Bjorck T, Zetterstrom O, Granstrom E, Dahlen SE. Urinary excretion of leukotriene E 4 and 11-dehydrothromboxane B 2 in response to bronchial provocation with allergen, aspirin, leukotriene D 4 and histamine in asthmatics. Am Rev Respir Dis 1992; 146:96-103.
18.Kumlin M, Stensvad F, Larsson L, Dahlen B, Dahlen SE. Validation and application of a new simple strategy for measurements of urinary leukotriene E 4 in humans. Clin Exp Allergy 1995; 25:467-79.
19.Smith CM, Hawksworth RJ, Thien FCK, Christie PE, Lee TH. Urinary leukotriene E 4 in bronchial asthma. Eur Respir J 1992; 5:693-9.
20.Bigby TD, Margolskee D, Michael PF, Sheppard D, Hadley WK, Hopewell PC. The usefulness of induced sputum in the diagnosis of Pneumocystis carinii pneumonia in patients with the acquired immunedeficiency syndrome. Am Rev. Respi. Dis 1986; 113:515-8.
21. Fahy JV, Liu J, Wong H, Boushey HA. Cellular and biochemical analysis of induced sputum from asthmatic and from healthy subjects. Am Rev Respir Dis 1993; 147:1126-31.
22.Fahy JV, Wong H, Liu J, Boushey HA. Comparison of samples collected by sputum induction and bronchoscopy from asthmatic and healthy subjects. Am J Respir Crit Care Med 1995; 152:53-8.
23.Gibson PG, Girgis-Gabardo A, Morris MM, Mattoli S, Kay JM, Dolovich J, Denburg JA, Hargreave FE. Cellular characteristics of sputum from patients with asthma and chronic bronchitis. Thorax 1989; 44:693-9.
24.Hargreave FE, Popov T, Kidney J, Dolovich J. Sputum Measurements to Assess Airway Inflammation in Asthma. Allergy 1993; 48:81-3.
25.Maestrelli P, Calcagni PG, Saetta M, Di Stefano A, Hosselet JJ, Santonastaso A, Fabbri LM, Mapp CE. Sputum eosinophilia after asthmatic responses induced by isocyanates in sensitized subjects. Clin Exp Allergy 1994; 24:29-34.
26.Pin I, Gibson PG, Kolendowicz R, Girgis-Gabardo A, Denburg JA, Hargreave FE, Dolovich J. Use of induced sputum cell counts to investigate airway inflammation in asthma. Thorax 1992; 47:25-9.
27.Gibson PG, Wong BJO, Hepperle MJE et al . A research method to induce and examine a mild exacerbation of asthma by withdrawl of inhaled corticosteroid. Clin Exp Allergy 1992; 22:525-32.
28.Claman DM, Boushey HA, Liu J, Wong H, Fahy JV. Analysis of ind uced sputum to examine the effects of prednisone on airway inflammation in asthmatics subjects. J Allergy Clin Immunol 1994; 94:861-9.
29.Pizzichini MMM, Pizzichini E, Clelland L, Efthi-miads A, Mahony J, Dolovich J et al. Sputum in severe exacerbations of asthma. Kinetics of inflammatory ind ices after prednisone treatment. Am J Respir Crit Care Med 1997; 155:1501-8.
30.Booth H, Richmond I, Ward C, Gardiner PV, Harkawat R, Walters EH. Effect of high inhaled fluiticasone propionate on airway inflammation in asthma. Am J Respir Crit Care Med 1995; 152:45-52.
31.O'Byrne PM, Inman MD. Induced sputum to assess airway inflammation in asthma. Eur Respir J 1996; 9:2435-6.
32.Pizzichini MM, Kidney JC, Wong BJ et al . Effect of salmetrol compared with beclomethasone on allergen-induced asthmatic and inflammatory responses. Eur Respir J 1996; 9:449-55.
33.Cataldo D, Foidart JM, Lau L, Bartsch P, Djukanovic R, Louis R. Induced sputum - Comparison between isotonic and hypertonic saline solution inhalation in patients with asthma. Chest 2001; 120:1815-21.
34.Kips JC, Peleman RA, Pauwels RA. Methods of examining induced sputum: do differences matter? Eur Respir J 1998; 11:529-33.
35.Chodosh S, Zaccheo CV, Segal MS. The cytology and histochemistry of sputum cells. Am Respir Dis 1962; 85:635-48.
36.Gibson PG, Girgis-Gabardo A, Morris MM et al . Cellular characteristics of sputum from patients with asthma and chronic bronchitis. Thorax 1989; 44:693-9.
37.Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2022. Disponível em: www.ginasthma.org
38.Pizzichini E, Pizzichini MM, Efthimiadis A, Evans S, Morris MM, Squillace D, Gleich GJ, Dolovich J, Hargreave FE. Indices of airway inflammation in induced sputum: reproducibility and validity of cell and fluid-phase measurements. Am J Respir Crit Care Med 1996; 154:308-17.
39.Gibson PG, Wlodarczyk JW, Hensley MJ, Gleeson M, Henry RL, Cripps AW, Clancy RL. Epidemiological association of airway inflammation with asthma symptoms and airway hyperresponsiveness in childhood. Am J Respir Crit Care Med 1998; 158:36-41.
40.Reddel HK, Taylor DR, Bateman ED, et al. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice. Am J Respir Crit Care Med 2009;180:59-99.
41.Jayaram L, Pizzichini MM, Cook RJ, Boulet LP, Lemière C, Pizzichini E, Cartier A, Hussack P, Goldsmith CH, Laviolette M, Parameswaran K, Hargreave FE. Determining asthma treatment by monitoring sputum cell counts: effect on exacerbations. Eur Respir J 2006; 27:483-94.
42.Donnelly LE, Barnes PJ. Expression of heme oxygenase in human airway epithelial cells. Am J Respir Cell Mol Biol 2001; 24:295-303.
43.
Zayasu K, Sekizawa K, Okinaga S, Yamaya M, Ohrui T, Sasaki H.
Increased carbon monoxide in exhaled air of asthmatic patients. Am J Respir Crit Care Med 1997; 156:1140-3.
44.
Uasuf CG, Jatakanon A, James A, Kharitonov SA, Wilson NM, Barnes PJ.
Exaled carbon monoxide in childhood asthma. J Pediatr 1999; 135:569-74.
45.Kips JC, Kharitonov SA, Barnes PJ. – Noninvasive assessment of airway inflammation in asthma. In : F. Chung, L.M. Fabbri. Asthma. European Respiratory Monograph 2003; 8:164-179
46.
Corradi M, Montuschi P, Donnelly LE, Pesci A, Kharitonov SA, Barnes PJ.
Increased nitrosothiols in exhaled breath condensate in inflamatory airway diseases. Am J Respir Crit Care Med 2001; 163:854-8.
47.
Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ.
Increased 8-isoprostane, a marker of oxidative stress, in ehaled condensate of asthma patients. Am J RespirCrit Care Med 1999; 160:216-20.
48.Hanazawa T, Kharitonov SA, Barnes PJ. Increased nitrotyrosine in exhaled breath condensate of patients with asthma. Am J Respir Crit Care Med 2000 162:1273-6.
49.Huszár É, Vass G, Vizi É, Csoma Zs, Barát E, Molnár Világos Gy, Herjavecz I, Horváth I. Adenosine in exhaled breath condensate in healthy volunteers and in patients with asthma. Eur Respir J 2002; 20:1393-1398.
50.Researchers explore mechanisms of allergic disease at 2004 AAAAI Annual Meeting (online). Disponível na internet via www. URL: http://www.aaaai.org/media/news_releases/2004/03/032304a.stm. Arquivo capturado em 24 de março de 2004.
51.Kharitonov SA, Alving K, Barnes PJ. Exhaled and nasal nitric oxide measurements: recommendations. Eur Respir J 1997; 10:1683-93.
52.ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal
nitric oxide. Am J Respir Crit Care Med 2005; 171:912-30.
53.Baraldi E, de Jongste JC; European Respiratory Society; American Thoracic Society. Measurement of exhaled nitric oxide in children. Eur Respir J 2002; 20:223-37.
54.Archer S. Measurement of nitric oxide in biological models. FASEB J 1993; 7:349-60.
55.Boot JD, de Ridder L, de Kam ML, Calderon C, Mascelli MA, Diamant Z. Comparison of exhaled nitric oxide measurements between NIOX MINO electrochemical and Ecomedics chemiluminescence analyzer. Respir Med 2008; 102:1667-71.
56.Murphy AW, Platts-Mills TA, Lobo M, Hayden F. Respiratory nitric oxide levels in experimental human influenza. Chest 1998; 114:452-6.
57.Henriksen AH, Sue-Chu M, Lingaas HT, Langhammer A, Bjermer L. Exaled and nasal NO levels in allergic rhinitis: relation to sensitization, pllen season and bronchial hyperresponsiveness. Eur Respir J 1999; 13:301-6.
58.
Olin AC, Aldenbratt A, Ekman A, Ljungkvist G, Jungersten L, Alving K, Torén K. Increased nitric oxide in exaled air after intake of a nitrate-rich meal. Resp Med 2001; 95:153-8.
59.Verleden GM, Dupont LJ, Verpeut AC, Demedts MG. The effect of cigarette smoking on exhaled nitric oxide in mild steroid-naïve asthmatics. Chest 1999; 116:59-64.
60.Frew AJ, Langley SJ, Perrin V, Hertog MG. Effects of 4-week treatment with low-dose budesonide (100 micrograms BID) from a novel inhaler Airmax and from a conventional inhaler on bronchial hyper-responsiveness, lung function and symptoms in patients with mild asthma. Respir Med 2002; 96:542-7.
61.Yates DH, Kharitonov AS, Robbins RA, Thomas OS, Barnes PJ. Effect of a nitric oxide synthase inhibitor and a glucocorticosteroid on exhaled nitric oxide. Am J Respir Crit Care Med 1995; 152:892-6.
62.Baraldi E, Dario C, Ongaro R, Scollo M, Azzolin NM, Panza N, Paganini N, Zacchelo F. Exhaled nitric oxide concentrations during treatment of wheezing exacerbation in infants and young children. Am J Respir Crit Care Med 1999; 159:1284-8.
63.Baraldi E, Azzolin NM , Zanconato S, Dario C, Zacchello F. Corticosteroids decrease exhaled nitric oxide in children with acute asthma. J Pediatr 1997; 131:381-5.
64.Kharitonov SA, Yates DH, Barnes PJ. Inhaled glucocorticosteroids decrease nitric oxide in exhaled air of asthmatics patients. Am J Respir Crit Care Med 1996; 153:454-7.
65.Kharitonov SA, Yates DH, Chung KF, Barnes PJ. Changes in the dose of inhaled steroid affect exhaled nitric oxide levels in asthmatic patients. Eur Respir J 1996; 9:196-201.
66.Kharitonov SA, Donnelly LE, Corradi M, Montuschi P, Barnes PJ. Dose-dependent onset and duration of action of 100/400 mcg budesonide on exhaled nitric oxide and related changes in other potential markers of airway inflammation in mild asthma. Am J Respir Crit Care Med 1996; 161:A186.
67.Artlich A, Bush T, Lewandowski K, Jonas S Gortner L, Falke KJ. Childhood asthma: exaled nitric oxide in relation to clinical symptoms. Eur Respir J 1999; 13:1396-401.
68.Stirling RG, Kharitonov SA, Campbell D, Robinson DS, Durham B, Chung KF, Barnes PJ. For the Asthma and Allergy Group. Increase in exhaled nitric oxide levels in patients with difficult asthma and correlation with symptoms and disease severity despite treatment with oral and inhaled corticosteroids. Thorax 1998; 53:1030-4.
69. van Rensen ELJ, Straathof KCM, Vaselic-Charvat MA et al Effect of inhaled steroids on airway hyperresponsiveness, sputum eosinophils, and exhaled nitric oxide levels in patients with asthma. Thorax 1999; 54:403-8.
70.Petsky HL, Kew KM, Chan AB. Exhaled nitric oxid levels to guide treatment for children with asthma. Cochrane Database Syst Rev 2016; 11Cd011439.
71. Petsky HL, Kew KM, Turner C, Chang AB. Exhaled nitric oxide levels to guide treatment for adults with asthma. Cochrane Database Syst Rev 2016; 9:Cd011440.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|