|
Asma
INTRODUÇÃO
A característica principal da asma é a inflamação.
Contrastando com a vasta maioria de patologias pulmonares e de outros órgãos, em que ocorrem respostas limitadas de injúria e reparação, a inflamação alérgica na asma se inicia na sua grande maioria na infância e persiste ao longo da vida do paciente acometido pela doença.
A asma é caracterizada pelo aumento da expressão de múltiplas
proteínas que estão envolvidas em complexa cascata inflamatória.
Estas proteínas inflamatórias incluem citocinas [do grego (cyto) célula e movimento (kynos)], quimocinas,
enzimas que produzem mediadores inflamatórios, receptores para mediadores
inflamatórios e adesão de moléculas. O aumento da expressão
da maioria destas proteínas é resultado de um aumento na transcrição
genética, sendo que vários destes genes não são
expressos em células normais sob condições habituais.
Mudanças na transcrição de genes são reguladas
por fatores de transcrição. Nas doenças inflamatórias,
os fatores de transcrição ativados por estímulos inflamatórios
(alérgenos, vírus, oxidantes e citocinas) acionam genes, determinando
aumento da síntese de proteínas inflamatórias.
A descrição do quadro inflamatório da
asma foi relatada pela primeira vez em estudos de autópsia em casos
agudos fatais, na década de 60.1
Com o advento da broncofibroscopia e suas técnicas associadas
lavado broncoalveolar (LBA), escovado brônquico, biópsia endobrônquica
e biópsia transbrônquica, medida do óxido
nítrico endobrônquico e do condensado respiratório, tornou-se possível nos últimos
25 anos conhecer melhor a biologia pulmonar, a complexidade da inflamação,
os mecanismos imunológicos e os processos de injúria e
reparação, envolvidos na patogênese da asma. Com estes
procedimentos se teve a oportunidade de recolher e avaliar os vários
tipos de células, inúmeros mediadores químicos,
proteínas, enzimas, envolvidos na asma leve e moderada.2,3 Avanços na avaliação da inflamação foram também alcançados com a técnica do escarro induzido. Seus resultados têm
sido comparados aos do LBA e escovado.4-7 Trata-se de
técnica não invasiva e de fácil execução,
podendo ser repetida várias vezes para avaliações sequenciais, mesmo
em pacientes com asma severa.
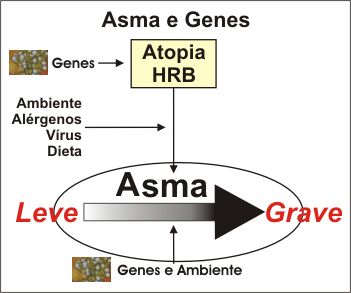
A
asma é uma doença genética complexa. Após a introdução
de técnicas avançadas de biologia molecular, estudos começaram
a ser efetuados com o propósito de avaliar se a asma é determinada
geneticamente ou se aberrações genéticas são necessárias
para permitir que fatores ambientais determinem a expressão clínica
da doença. Os dados atuais sugerem que ambas as
hipóteses são corretas (Figura 1).
A expressão clínica do fenótipo da asma pode refletir uma complexa
interação entre um número muito variado de genes predisponentes e suas
variantes polimórficas – determinantes pessoais e influências ambientais como:
∎ A prematuridade e o baixo peso determinam maior risco para o desenvolvimento da asma.8 Fetos nascidos com menos de 37 semanas de gestação apresentam risco até 36% maior para desenvolver asma do que o recém-nascido a termo.9
∎ História familiar ou pessoal de alergia – relacionadas à existência à atopia (história de rinite, dermaite atópica, eczema).
∎ Fatores endócrinos – exposição hormonal – predomínio na infância da asma nos meninos com inversão na puberdade para as meninas.10-12 As mulheres continuam a ter maior predominância para asma do que os homens até a 5ª década de vida. Entretanto, a desproporção entre mulheres e homens diminui por volta da 5ª década, revertendo novamente.13
∎ Infecções virais durante a primeira infância (especialmente a bronquiolite) – há longa data a bronquiolite é reconhecida como fator de risco para o desenvolvimento de asma infantil persistente.14-16
∎ Alérgenos de ambientes fechados (ácaros da poeira doméstica, pelos, esporos de mofo) ou exterior (pólens, mofo) das casas.17
∎ Tabagismo ativo ou passivo desde o período de vida intrauterino.18-21
∎ Poluição do ar em especial
o relacionado com partículas finas, bem como o ar interior, por substâncias provenientes de produtos de limpeza, colas, vernizes, tintas etc. (especialmente em casa) ou irritantes químicos no local de trabalho.
∎ Foi postulado que o uso do paracetamol ou acetaminofen pode aumentar o risco de desenvolver asma devido aos seus efeitos pró-oxidantes (por depleção do antioxidante glutationa do tecido pulmonar).22 Vários estudos descreveram a associação do uso de paracetamol ou na gravidez ou na primeira infância ou em adultos e o desenvolvimento de asma brônquica.23-25
Genética e Fatores Étnicos
A
asma é uma doença poligênica e multifatorial, e os genes relacionados à asma podem ser identificados
pela técnica conhecida por clonagem posicional ou examinando-se os genes candidatos.
Existem pelo menos doze regiões genômicas relacionadas à asma. Como a asma
está associada à atopia, os genes que a predispõem têm sido pesquisados, havendo
vários lócus relacionados, como o do receptor IgE de alta afinidade FcεRIβ no cromossomo 11 q; a IL-4 no braço longo do cromossomo 5, na posição 5q23-31 dentro de
um complexo que contém genes para outras citocinas, como a IL-3, 4, 5, 9,
12 e 13, além do receptor β2 (β-AR); e o receptor IL-4
(IL-4R cadeia a) no cromossomo 16p12.22-30 A ligação entre hiper-responsividade
brônquica e IgE sérica total tem sido demonstrada no cromossomo 5;28 a eosinofilia está associada ao cromossomo 6 e o receptor de célula T ao cromossomo
14q. O cromossomo 12 contém os genes que codificam o interferon-γ (IFN-γ),
o fator de crescimento do mastócito (MGF), o fator de crescimento da insulina
(IGF) e a sintase do óxido nítrico constitutiva (NOS). Na  Tabela 1 são apresentados os genes
candidatos investigados, os lócus relacionados e a função desempenhada na
asma e atopia. Tabela 1 são apresentados os genes
candidatos investigados, os lócus relacionados e a função desempenhada na
asma e atopia.
Análises sistemáticas em todo o genoma têm sido executadas
para os genes que predispõem a asma, testando-se as características genéticas
relacionadas à atopia, aos testes cutâneos, à IgE sérica total, à contagem
dos eosinófilos sanguíneos e à responsividade brônquica. Associações potenciais
têm sido identificadas nos cromossomos 4, 6, 7, 11, 13 e 16,31 o que indica
que a predisposição genética para a asma pode ser muito complexa.
Membros da Universidade de SouThampton
junto à Schering-Plough e à Genome Therapeutics Corporation publicaram
descoberta de um gene relacionado à asma.32 Foi o primeiro gene de susceptibilidade à asma clonado posicionalmente, o que significa que sua posição exata no genoma foi identificada antes de se conhecer a função do gene. Trata-se do gene
ADAM33 (A desintegrin and metalloprotease 33), membro do subgrupo da família da metaloprotease zinco-dependente, fortemente associado à hiper-responsividade brônquica. Neste estudo, através
da técnica de clonagem posicional, utilizando larga e minuciosa varredura
do genoma, investigaram 460 famílias inglesas e americanas, de raça branca,
com pelo menos duas crianças com o diagnóstico confirmado de asma e
em uso de medicação específica para a doença. Uma análise de 135 polimorfismos
em 23 genes identificou o gene ADAM33 (cromossomo 20p13) com forte associação
à asma, utilizando-se estudos de casos-controle, desequilíbrio de ligação e análises dos haplótipos. A variação polimórfica do ADAM33 tem sido associada à asma, hiper-responsividade brônquica e comprometimento da função pulmonar na infância, declínio acelerado da função pulmonar que ocorre na asma grave e, mais recentemente, na DPOC.19
Em
maio de 2003, após seis anos de pesquisas pela técnica de clonagem posicional,
o grupo do Professor William O.C.M. Cookson e da Dra. Miriam F. Moffatt, da University of Oxford's Wellcome Trust Centre for Human Genetics anunciaram
online34 um novo gene, o PhF11, no lócus do cromossomo 13q14, que
influencia os níveis de IgE na asma. O gene PhF11 (B cell transcription factor)
contém dois dedos de zinco PHD e provavelmente regula a transcrição
da IgE.
Outros genes para a asma foram posteriormente identificados, utilizando esta abordagem: VDR, DPP10 (Dipeptidyl protease 10), HLA-G (Human lymphocyte antigen G), e GPR154 (G-protein receptor 154).35 Acredita-se que estes genes possam estar implicados na atopia, nos níveis elevados de IgE, na hiper-responsividade brônquica, e outras particularidades relacionadas à asma.
O primeiro GWAS (Genome-wide association studies) de asma foi publicado em 2007 por Moffatt et al.36 Este estudo relatou que a variação genética no cromossomo 17q12-21 estava associada à asma infantil. Os  polimorfismos de nucleotídeo únicos associados à asma neste lócus foram relacionados aos níveis de expressão de mRNA de ORM1-like-3 (orosomucoid 1-like 3, ORMDL3) em linhagem de células linfoblásticas usando mapeamento eQTL (expression quantitative trait locus), que associa SNPs à expressão gênica. As investigações que se sucederam também ligaram SNPs neste lócus ao GSDMA, GSDMB, CRKRS, ZBPB2 e à expressão IKZF2 em células do sangue total e do tecido pulmonar.37-39 O lócus 17q12-21 foi associado à asma de início na infância, mas não à asma de início na idade adulta como foi posteriormente confirmado por outros estudos.40,41 polimorfismos de nucleotídeo únicos associados à asma neste lócus foram relacionados aos níveis de expressão de mRNA de ORM1-like-3 (orosomucoid 1-like 3, ORMDL3) em linhagem de células linfoblásticas usando mapeamento eQTL (expression quantitative trait locus), que associa SNPs à expressão gênica. As investigações que se sucederam também ligaram SNPs neste lócus ao GSDMA, GSDMB, CRKRS, ZBPB2 e à expressão IKZF2 em células do sangue total e do tecido pulmonar.37-39 O lócus 17q12-21 foi associado à asma de início na infância, mas não à asma de início na idade adulta como foi posteriormente confirmado por outros estudos.40,41
Um dos mais importantes estudos da genética da asma até hoje efetuado foi realizado em 2010 por um consórcio de mais de cem centros em todo o mundo.42 Foi elaborado um largo estudo GWAS, o estudo GABRIEL, que genotipou 10.365 pessoas com asma e 16.110 pessoas não afetadas para testar a associação entre 582.892 SNPs e asma. Este grande estudo identificou genes nos cromossomos 2 [ IL1RL1 / IL18R1 (Interleukin 1 receptor-like 1)], 6 [ HLA-DQ (Human lymphocyte antigen Q)], 9 [ IL33 (Interleukin 33)], 15 [ gene Sma SMAD3 (MoThers against
decapentaplegic
(Mad) homolog 3)], 17 [ORMDL3 (ORM1-like3)/ GSDMB] e 22 [IL2RB (Interleukin 2 Receptor subunit beta)] associados à asma. O gene ORMDL3, em particular, foi associado ao início da doença na infância, enquanto o gene HLA-DQ estava relacionado à asma de início tardio. Além disso, os resultados mostraram que 38% de todos os casos de asma na infância foram atribuídos a uma combinação dos genes identificados.
O estudo também encontrou associação entre IgE sérica total e o gene HLA-DRB1 dentro da região de classe II do complexo principal de histocompatibilidade (MHC) no cromossomo 6. No entanto, esse lócus não estava associado à asma; a maioria dos lócus de suscetibilidade identificados para asma não foi associada à IgE, sugerindo que a elevação da IgE sérica total tem apenas um papel menor no desenvolvimento da asma.
Outra metanálise de estudos de associação de todo o genoma em dez lócus ou próximos a TLR6, C11orf30, STAT6, SLC25A46, HLA-DQB1, IL1RL1, LPP, MYC, IL-2 e HLA-B estimou como sendo os responsáveis por pelo menos 25% da sensibilização alérgica e rinite alérgica.43
Uma revisão dos estudos de associação do genoma (2020) permitiu a identificação de 128 SNPs associados à asma (97 relatados nos últimos 4 anos).44
Asma e Atopia
A exposição a alérgenos, particularmente nos primeiros anos
de vida, pode determinar inflamação crônica alérgica nas vias aéreas de indivíduos
geneticamente suscetíveis. Outros fatores de risco para o desenvolvimento
de resposta inflamatória são: infecções virais na infância,14,15 ausência de amamentação
com leite materno,45 exposição ambiental domiciliar à fumaça do tabaco de pais
fumantes46 (Figura 2), poluição atmosférica47 e dietas com baixos teores de antioxidantes ou ácidos
graxos poli-insaturados durante a gravidez.48 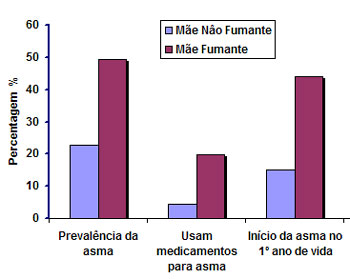
A origem da asma e de outras doenças alérgicas pode estar ligada
ao ambiente uterino, onde a presença de citocinas do tipo Th2 é necessária para o bom êxito da gravidez, incluindo as interleucinas IL-4, IL-10 e IL-13, encontradas no líquido amniótico. Ao nascer, células mononucleares
com perfil de citocinas do tipo Th2 estão
presentes no cordão umbilical. A maioria das crianças ao nascer perde esta
resposta Th2 fetal dominante, emergindo então resposta do tipo Th1, também conhecida como "desvio
imune". Todavia, nas crianças cujos pais são atópicos e nas quais os
sintomas alérgicos se desenvolvem,
esta
transição é retardada e respostas Th2 persistem.49 Investigações do ambiente intrauterino são essenciais para elucidar os mecanismos pelos quais os bebês que manifestam resposta imune alterada ao nascer
desenvolvem subsequente doença alérgica.
A elevação dos níveis séricos da IgE configura uma das características
das doenças atópicas porém, deve ser salientado que a IgE não atravessa a
barreira placentária. O feto só é capaz de sintetizá-la a partir da
11a semana de gestação. A dosagem da IgE do cordão umbilical
tem sido utilizada como parâmetro preditivo para a atopia em crianças.
Algumas pesquisas sugerem que a IgE do cordão umbilical é capaz de antecipar
a sensibilização precoce do feto. Em 1988, Magnusson50 demonstrou que
cerca de 50% dos recém-natos que desenvolviam atopia antes dos 18 meses de
idade apresentaram IgE do cordão aumentada. O mesmo autor descreveu que 30–40%
das crianças atópicas apresentavam história familiar negativa, sugerindo
que uma pesquisa mais ampla deveria englobar todos os recém-nascidos.50 Edenharter et al.51 em associação ao Estudo Alemão Multicêntrico
de Alergia encontraram forte associação entre a elevação da IgE do cordão
umbilical e a sensibilização precoce aos 12 meses de idade. Kaan et al.
determinaram que a história de asma materna era o fator mais forte para a
elevação da IgE do cordão.52 Outro fator era a época do nascimento, sendo que as crianças
nascidas no inverno apresentavam maior risco para a alta da imunoglobulina
E.52 Um dado técnico importante a ser considerado é a possibilidade da
contaminação do sangue do cordão umbilical pelo sangue materno, o que pode
determinar uma falsa elevação dos níveis de IgE do cordão umbilical.
A história de doença atópica na mãe tem se mostrado um fator de risco mais importante para o feto do que a alergia paterna. Embora a IgE não atravesse a placenta ela se difunde passivamente até o líquido amniótico onde pode ser deglutido pelo feto, existindo correlação entre o nível materno da IgE e sua concentração no líquido amniótico. Este fato pode ter papel importante na sensibilização a alérgenos e subsequente desenvolvimento de doença alérgica, pois os alérgenos também podem se difundir da mãe para o feto pelo mesmo mecanismo. Ao nível da 16ª semana de gravidez, as concentrações de alérgenos no líquido correspondem a aproximadamente 10% dos níveis circulantes da mãe.53 As interações materno-placenta-feto parecem também incluir o intestino delgado. Entre a 14–16ª semanas pode-se evidenciar a presença de células apresentadoras de antígenos (APCs) neste sítio, ocorrendo a possibilidade do reconhecimento de antígenos pelo feto. Neste período da gravidez já são detectadas nos folículos linfoides do intestino fetal as moléculas do complexo principal de histocompatibilidade MHC Classe II. Quando estas células entram em contato com os alérgenos contidos no líquido amniótico, com a IgE materna e citocinas Th2, pode ocorrer uma facilitação da apresentação do alérgeno às células T do feto. A importância destas considerações necessita de confirmação.
Hipótese da Higiene
A chamada "hipótese da higiene" busca explicar o
notável aumento das doenças mediadas via IgE, como a asma, o eczema e a rinite,
que ocorreu durante as últimas décadas, relacionada ao ambiente.54 Esta
exacerbação é mais prevalente em países industrializados, ocidentais, e é
paralela ao desenvolvimento de estilos de vida ocidentalizados. A conexão
entre sensibilização alérgica e estilo de vida, conduziu a elaboração desta
teoria, na qual o aumento da higiene e asseio, o uso difundido de antibióticos,
de água potável purificada e as imunizações por vacinas podem ter privado
o sistema imune em desenvolvimento, de estímulos ambientais moldados pela
evolução, para manter a imunidade adaptativa longe das respostas Th2.
Em síntese, ocorre uma redução nas taxas de estimulação microbiana na infância.55,56
Dados epidemiológicos confirmam que a prevalência de atopia
em crianças que moram em fazendas e granjas, e que estão em contato direto
com a criação de animais, é bem menor do que aquela de crianças morando nas
mesmas cidades e que não têm, entretanto, o mesmo estilo de vida rural.56-59 Isto ocorre em decorrência da alta exposição das crianças aos produtos bacterianos,
como, por exemplo, a endotoxina.
A exposição aos "micróbios", através de infecção ativa ou mesmo na ausência de infecção, pode iniciar resposta protetora. Na ausência de infecção, podem estar envolvidos, tanto os componentes viáveis como os não viáveis ou fragmentos de uma ampla variedade de microrganismos encontrados em diferentes concentrações e em diversos ambientes. Estes derivados bacterianos são primariamente reconhecidos pelo sistema imune inato, podem levar a respostas protetoras, especialmente ao nível das citocinas. A exposição aos derivados bacterianos pode apresentar um papel importante no desenvolvimento de respostas imunes principalmente nas fases de maturação imune das crianças, resultando no desenvolvimento de tolerância imune a potenciais alérgenos.
A endotoxina é um lipossacarídeo que forma a camada exterior
da membrana celular de todas as bactérias gram-negativas. Os níveis de endotoxinas
variam amplamente, mas tendem a ser mais altos em ambientes onde se encontram
os animais de fazenda, como vacas, cavalos e porcos, pois a flora intestinal
de mamíferos maiores é a fonte principal de endotoxina. A endotoxina também
é encontrada na poeira das casas e no ar. Quando em suspensão as endotoxinas
podem ser inaladas ou engolidas, atuando como potente molécula
imunoestimulatória através dos lipídios que a compõem. A endotoxina
estimula a produção pelas células dendríticas, de IL-12 que induz as células
Th1 e as
células assassinas “natural killer” a produzirem o interferon-γ e, desse modo, desviam o sistema imune para uma resposta Th1,
com ação protetora contra a alergia. O receptor para lipossacarídeos nas células dendríticas é o CD14, uma molécula
capaz de interagir com componentes bacterianos, incluindo Mycobacterium
tuberculosis.
Dois mecanismos tentam explicar a teoria da higiene: o primeiro
aceito relaciona-se à diminuição na estimulação antigênica decorrente
da redução na frequência de infecções na infância, resultando em diminuição
nos níveis de citocinas reguladoras, especificamente a IL-10, a IL-12
e o TGF-β. O segundo mecanismo relaciona-se à estimulação do sistema
imune inato pela endotoxina, desempenhando importante papel na ontogênese
do sistema imune normal.
Na mesma linha de raciocínio, alguns estudos sugerem que a
falta de infecções virais na infância possa predispor ao desenvolvimento da
asma. Por exemplo, crianças que contraem sarampo apresentam menor probabilidade
para atopia do que aquelas que receberam imunização através de vacinas. Os
micróbios constituem-se, provavelmente, no principal estímulo da imunidade
mediada via Th1.
Alguns estudos apóiam a hipótese da "teoria da higiene".
Por exemplo:
∎ Em um estudo coorte de 262 crianças em Guiné-Bissau, na
África Ocidental, a incidência de sarampo era inversamente proporcional
à atopia60
∎ Na Itália, em alunos da Escola da Força Aérea, a prevalência
de atopia era menor entre aqueles que apresentavam soropositividade
para o vírus A da hepatite61
∎ No Japão, um grupo de crianças em idade escolar que recebeu
vacina BCG e que apresentava forte reação à tuberculina apresentava baixa
incidência de asma e de níveis de IgE sérica62
∎ Na Finlândia, um estudo comparou um grupo controle a outro com história pregressa
de tuberculose. A análise em função da idade, sexo e região geográfica
detectou que a história de tuberculose ativa na infância reduzia significantemente
a ocorrência de asma subsequente em pacientes do sexo feminino63
∎ Braun-Fahrälander et al. mediram os
níveis de endotoxinas bacterianas na poeira de colchões de 812 crianças
(média de idade de 9,5 anos) que habitavam áreas rurais, em fazendas ou
não. Constataram que quanto maior o nível de endotoxina menor era a ocorrência
de rinite alérgica, asma atópica e sensibilização alérgica. Crianças que
foram expostas aos níveis mais elevados de endotoxina apresentaram incidência
80% menor de doenças alérgicas do que aquelas expostas aos mais baixos níveis.
A exposição à endotoxina correlacionava-se inversamente à produção de
várias citocinas pelos leucócitos (TNF-a, IFN-γ, IL-10 e IL-12)
configurando uma downregulation das respostas imunes64
∎ Stein et al. avaliaram a imunidade inata e risco de asma em crianças de dois povos semelhantes, que vivem em comunidades, afastados da sociedade, em ambientes agrários, e possuem perfis genéticos semelhantes: os Amish e Hutterites. Os Amish apresentam, entretanto, a incidência de asma três quartos inferior que os Hutterites. Os autores investigaram o sistema imunológico e o perfil genético de 60 crianças de 7 a 14 anos – 30 de cada população, além de recolherem amostras de ar, poeira do chão e colchões de uma dezena de casas de cada comunidade. O pó colhido nas casas dos Amish tinha cerca de 6 vezes mais endotoxinas que o das casas dos Hutterites, o que deve ter modulado a resposta do sistema imunológico das crianças. Um ponto importante que os diferencia e corrobora a hipótese é que enquanto os Amish cultivam suas terras de forma tradicional, com a ajuda de animais – cavalos e bois, os Hutterites praticam a mecanização em larga escala65
No entanto,
as relações entre exposições microbianas e resultados de doenças não são simples ou unimodais. A hipótese da higiene não consegue explicar o aumento da alergia mesmo em áreas que carecem de serviços de higiene básica, assim como a ausência de redução das doenças alérgicas em pessoas expostas às doenças virais próprias da infância. Dois estudos de levantamento epidemiológico observaram maior prevalência de asma com níveis mais elevados de endotoxina nos EUA (National Survey of Lead and Allergens in Housing Study)66 e no sul de Manchester, Reino Unido,67 implicando a endotoxina como uma exposição respiratória tóxica também em ambientes domésticos.
É importante ressaltar, porém, que no início da vida, algumas infecções não oferecem proteção contra alergias, como as causadas pelos vírus sincicial respiratório (VSR) ou rinovírus (RV). Estas infecções, reconhecidas há bastante tempo como afetando o trato respiratório inferior, estão fortemente ligadas a um aumento no risco de desenvolvimento de asma.68
Contrapondo-se à hipótese da higiene, propondo maior interação com microrganismos que habitam o ambiente natural e o microbioma humano na regulação imunológica, se propôs maior interação com os chamados “velhos amigos” [como helmintos, bactérias ambientais não patogênicas [pseudocomensais] ou certos comensais intestinais e probióticos] que impulsionam a imunorregulação e bloqueiam condições inflamatórias. Desta forma os microrganismos que compõem a microbiota são importantes para habilitar nosso sistema imunológico a reconhecer patógenos de risco. Ademais, sua diversidade seria essencial, uma vez que estudos mostram que um desequilíbrio na flora respiratória (disbiose respiratória) favorecida através de estilo de vida ocidental leva às alterações na regulação imunológica e ao aparecimento de atopia e alergia.
São propostas de mudanças no estilo de vida visando a interações micróbio-hospedeiro, permitindo a disseminação de microrganismos essenciais entre os membros da família. Combinar estratégias para restauração do microbioma através de parto natural, amamentação, uso criterioso de antibióticos, maior exposição social por meio de atividades ao ar livre e esportivas.69
A "hipótese dietética" está relacionada ao aumento
na industrialização dos alimentos nas últimas três décadas, com substancial
acréscimo no número de bebidas e alimentos processados
com aditivos químicos. Em paralelo, ocorreu a diminuição
do consumo de alimentos frescos, como os peixes, frutas e vegetais,
que contêm
ácidos graxos poli-insaturados e antioxidantes (vitaminas A,
C e E). O aumento de risco de desenvolver asma tem sido relacionado aos baixos
níveis de zinco, magnésio e manganês na dieta. Existem algumas evidências de que o aumento da ingestão de frutas e vegetais leva à melhoria no controle da asma e à redução do risco de exacerbações.70
Outros Fatores que Influenciam o Desenvolvimento da Asma
A obesidade, hoje considerada uma doença, está em franco aumento na população mundial, constituindo-se em um fator de risco para asma, especialmente nas mulheres e relacionada à asma mais severa. Fatores endócrinos como as leptinas e outras adipocinas, como a adiponectina e resistina, também têm ações nas células imunes e inflamatórias, podendo afetar a função das vias aéreas e aumentar a probabilidade para o desenvolvimento da asma.71,72 A perda de peso nestes pacientes é acompanhada de melhora e controle mais efetivo da asma.
Outra hipótese para a asma relaciona-a a certas infecções,
pela detecção nas vias aéreas, principalmente em pacientes com asma severa, de Mycoplasma pneumoniae e Chlamydia pneumoniae pela reação em cadeia da polimerase
(PCR). Alguns estudos, embora em pequena escala, corroboram esta teoria, demonstrando
melhora estatisticamente significante na função pulmonar e na redução da responsividade
brônquica à histamina, após tratamento com macrolídios.73,74
Em relação ao fator ambiental suspeita-se de que exista um potencial papel das condições climáticas na etiologia da asma e alergias.75-77 A maioria dos estudos sobre os efeitos do clima foi efetuada correlacionando-se as variações climáticas por curtos períodos ou sob certas condições meteorológicas, com a ocorrência e/ou gravidade dos sintomas de doenças atópicas. Pouco foi descrito sobre os efeitos das condições climáticas a longo prazo na prevalência da asma.
Um estudo de grande escala, envolvendo crianças de 50 países (146 centros), concluiu que as taxas de asma e do eczema alérgico podem ser afetadas pelo clima. Este estudo publicado no Occupational and Environmental Medicine78 foi baseado em análise de mais de 650.000 crianças. A pesquisa faz parte de um projeto maior de pesquisa internacional, o ISAAC – International Study of AsThma and Allergies in Childhood. As pesquisas levaram em conta vários fatores relacionados ao clima, incluindo altitude, latitude, temperatura e umidade. Concluíram que todos são capazes de afetar a asma e o eczema atópico, sendo que o elemento mais importante foi a umidade relativa do ar no interior das residências.
Na Europa Ocidental (57 centros em 12 países) para um aumento médio anual estimado de 10% na umidade relativa do ar no interior das casas, a prevalência de sintomas de asma reportada aumentou 2,7%, para um IC95% – 1,0% – 4,5%. Uma possível explicação pode ser decorrente da preferência dos ácaros da poeira doméstica por ambientes úmidos, assim como a maior presença de fungos que podem causar reações alérgicas.78 Nesta publicação, a prevalência de sintomas de asma era inversamente relacionada à altitude e à variação anual da temperatura e à umidade relativa (externa) do ar. O eczema atópico tinha sua prevalência positivamente associada à latitude e negativamente à temperatura.
Menos asma foi informada em países onde a umidade relativa do ar era inferior a 50% durante pelo menos um mês ao ano. A prevalência era menor nos locais de maior altitude ou onde ocorriam maiores variações na temperatura.
A fumaça do cigarro é também um importante fator que contribui para a gravidade da asma,79 atuando através do aumento da resistência dos pacientes aos corticoides79 e por induzir uma intensa resposta neutrofílica.81 Determina mais sintomas, exacerbações frequentes e mais severas além de acelerar o declínio da função pulmonar ao longo do tempo.82-84 Estudos de metanálise demonstraram que a exposição ao fumo passivo aumenta a incidência de sibilos e asma em crianças e adultos jovens em cerca de 20% e que em casais que não fumam a incidência de asma em seus filhos é muito mais baixa.84
O estresse pode também desencadear a asma de forma multimodal, endócrina, neural, imune e comportamental. Existem evidências observacionais de que eventos severos negativos na vida de crianças e adolescentes possam aumentar o risco de ataques de asma nas semanas subsequentes ao fato.85 Uma associação entre eventos da vida cotidiana e riscos de asma tem sido reportada em estudos retrospectivos87-89 e em pelo menos um estudo prospectivo entre adultos.
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
Referências
01.Dunnill MS. The paThology of asThma wiTh special
reference to changes in The bronchial mucosa. J Clin PaThol 1960; 13:27-33.
02.Beasley R, Roche WR, Roberts JA, Holgate ST.
Cellular events in The bronchi in mild asThma and after bronchial provocation. Am Rev Respir Dis 1986; 139:806-17.
03.Jeffrey PK, Wardlaw AJ, Nelson FC, Collins JV, Kay AB.
Bronchial biopsies in asThma: an ultrastructural quantification study and
correlation wiTh hiperreactivity. Am Rev Respir Dis 1989; 140:1745-53.
04.Kavuru MS, Raed A, Dweik MD, Thomassen MJ. Role of
bronchoscopy in asThma research. Clin Chest Med 1999; 20:153-89.
05.Fahy JV, Wong H, Liu J, Boushey HA.
Comparison of samples
collect by sputum induction and bronchoscopy from asThmatic and healThy subjects. Am J Respir Crit Care Med 1995; 152:53-8.
06.Grootendorst DC, Sont JK, Willems LNA, et al. Comparison
of inflammatory cell counts in asThma: Induced sputum vs bronchoalveolar lavage
and bronchial biopsies. Clin Exp Allergy 1997; 27:769-79.
07.Maestrelli P, Saetta M, Di Stefano A, Calcagni PG, Turato G, Ruggieri MP, Roggeri A, Mapp CE, Fabbri LM.
Comparison
of leucocyte counts in sputum, bronchial biopsies and bronchoalveolar
lavage. Am J Respir Crit Care Med 1995; 152:1926-31.
08.Zhang J, Ma C, Yang A, Zhang R, Gong J, Mo F. Is preterm birTh associated wiTh asThma among children from birTh to 17 years old? - A study based on 2011-2012 US National Survey of Children's HealTh. Ital J Pediatr 2018; 44:151.
09.Jaakkola JJ, Ahmed P, Ieromnimon A, Goepfert P, Laiou E, Quansah R, Jaakkola MS. Preterm delivery and asThma: a systematic review and meta-analysis. J Allergy Clin Immunol 2006; 118:823-30.
10.Bisgaard H, Szefler S. Prevalence of asThma-like symptoms in young children. Pediatr Pulmonol 2007; 42: 723-728.
11.Kuehni CE, Strippoli MP, Low N, Brooke AM, Silverman M. Wheeze and asThma prevalence and related healTh-service use in white and souTh Asian pre-schoolchildren in The United Kingdom. Clin Exp Allergy 2007; 37:1738-1746.
12.Martinez FD, Wright AL, Taussig LM, Holberg CJ, Halonen M, Morgan WJ. AsThma and wheezing in The first six years of life. The Group HealTh Medical Associates. N Engl J Med 1995; 332:133-138.
13.Fuhlbrigge AL, Jackson B, Wright R. Gender and asThma. Immunol Allergy Clin NorTh Am 2002; 22:10 10.1016/S0889-8561(02)00022-X.
14.Hasegawa K, Dumas O, Hartert TV, Camargo CA Jr. Advancing our understanding of infant bronchiolitis Through phenotyping and endotyping: clinical and molecular approaches. Expert Rev Respir Med 2016; 10:891-9.
15.Régnier SA, Huels J. Association between respiratory syncytial vírus hospitalizations in infants and respiratory sequelae: systematic review and meta-analysis. Pediatr Infect Dis J 2013; 32:820-6.
16.Liu L, Pan Y, Zhu Y, Song Y, Su X, Yang L, Li M. Association between rhinovirus wheezing Illnes and The development of childhood asThma: a meta-analysis. BMJ Open 2017; 7:e013034.
17.Holgate ST. The epidemic of allergy and asThma. Nature 1999; 402(Suppl):B2-4.
18.Gopal SH, Mukherjee S, Das SK. Direct and Second Hand Cigarette Smoke Exposure and Development of Childhood AsThma. J Environ HealTh Sci 2016; 2(6):Direct and Second Hand Cigarette Smoke Exposure and Development of Childhood AsThma. doi: 10.15436/2378-6841.16.1122.
19.Simons E, To T, Moineddin R, Stieb D, Dell SD. Maternal second-hand smoke exposure in pregnancy is associated wiTh childhood asThma development. J Allergy Clin Immunol Pract 2014; 2:201-7.
20.Xepapadaki P, Manios Y, Liarigkovinos T, Grammatikaki E, Douladiris N, Kortsalioudaki C, Papadopoulos NG. Association of passive exposure of pregnant women to environmental tobacco smoke wiTh asThma symptoms in children. Pediatr Allergy Immunol 2009; 20:423-9.
21.Jaakkola JJ, Gissler M. Maternal smoking in pregnancy, fetal development, and childhood asThma. Am J Public HealTh 2004; 94:136-40.
22.McKeever TM, Lewis SA, Smit HA, Burney P, Bretton JR, Cassano PA. The association of acetaminophen, aspirin, ans ibuprfen wiTh respiratory disease and lung function. Am J Respir Crit Care Med 2005; 171:966-71.
23.Shaheen S, Potts J, Gnatiuc L, Makowska J, Kowalski ML, Joos G,
et al. The relation berween paracetamol use and asThma: a GA2LEN European case-control study. Eur Respir J 2008; 32:1231-6.
24.Shaheen SO, Newson RB, Sherriff A, Henderson AJ, Heron JE, Burney PG, Golding J; ALSPAC Study Team.
Paracetamol use in pregnancy and wheezing in early childwood. Thorax 2002; 57:958-63.
25.Shaheen SO, Sterne JA, Songhurst CE, Burney PG. Frequent paracetamol use and asThma in adults. Thorax 2000; 55:266-70.
26.Standford AJ, Shirakawa T, Moffatt MF, Daniels SE,
Ra C, Faux JA et al. Localisation of atopy and beta subunit of high-affinity
IgE receptor (Fc epsilon RI) on chromosome 11q. Lancet 1993; 341:332-4.
27.Doull IJ, Lawrence S, Watson M, Begishvili T, Beaslev
RW, Lampe F, Holgate T, Morton NE. Allelic association of gene markers on
chromosome 5q and 11q wiTh atopy and bronchial responsiveness. Am J Respir
Crit Care Med 1996; 153:1280-4.
28.Postma DS, Bleecker ER, Amelung PJ, Holroyd KJ, Xu
j, Panhuysen CI, Meyers DA, Levitt RC. Genetic susceptibility to asThma -
bronchial hyperresponsiveness coinherited wiTh a major gene for atopy. N Engl
J Med 1995; 333:894-900.
29.Marsh DG, Neely JD, Breazeale DR, Ghosh B, Freidhoff LR, Ehrlich-Kautzky E, Schou C, Krishnaswamy G, Beaty Th.
Linkage analysis of IL-4 and oTher chromosome
5q31.1 markers and total serum immunoglobulin E concentrations. Science 1994;
264:1152-6.
30.Walley AJ, Cookson WO. Investigation of an interleukin-4
promoter polymorphism for associations wiTh asThma atopy. J Med Genet 1996;
33:689-92.
31.Daniels SE, Bhattacharrya S, James A, Leaves NI, Young A, Hill MR, Faux JA, Ryan GF, le Söuef PN, LaThrop GM, Musk AW, Cookson WO. Genome-wide search for quantitative trait loci
underlying asThma. Nature 1996; 383:247-50.
32.van Eerdewegh P, Little RD, Dupuis J, Del Mastro
RG, Falls K, Simon J, Torrey D, Pandit S, Mckenny J ey al. Association of
The ADAM33 gene wiTh asThma and bronchial hyperresponsiveness. Nature 2002;
418:426-30.
33.Holgate ST, Yang Y, Haitchi HM, Powell RM, Holloway JW, Yoshisue H, Pang YY, Cakebread J, Davies DE. The genetics of asThma: ADAM33 as an example of a susceptibility gene. Proc Am Thorac Soc 2006; 3:440-3.
34.Zhang Y, Leaves N I, Anderson GG, Ponting CP, Broxholme
J, Holt R, Edser P, Bhattacharyya S, Dunham A, Adcock IM, Pulleyn L, Barnes
PJ, Harper JI, Abecasis G, Cardon L, White M, Burton J, MatThews
L, Mott R, Ross M, Cox R, Miriam F Moffatt MF, Cookson WOCM. Positional cloning
of a quantitative trait locus on chromossome 13q14 That influences immunoglobulin
E levels and asThma. [online] Disponível na Internet via www URL:http://www.nature.com/cgitaf/DynaPage.taf?file=/ng/journal/vaop/ncurrent/abs/ng1166.html. Arquivo capturado em 18 de maio de 2003.
35.Weiss ST, Raby BA, Rogers A. AsThma genetics and genomics 2009. Curr Opin Genet Dev 2009; 19:279-82.
36.Moffatt MF, Kabesch M, Liang L, Dixon AL, Strachan D, HeaTh S, Depner M, von Berg A, Bufe A, Rietschel E, Heinzmann A, Simma B, Frischer T, Willis-Owen SA, Wong KC, Illig T, Vogelberg C, Weiland SK, von Mutius E, Abecasis GR, Farrall M, Gut IG, LaThrop GM, Cookson WO.
Genetic variants regulating ORMDL3 expression contribute to The risk of childhood asThma. Nature 2007; 448:470–73.
37.Halapi E, Gudbjartsson DF, Jonsdottir GM, Bjornsdottir US, Thorleifsson G, Helgadottir H, Williams C, Koppelman GH, Heinzmann A, Boezen HM, Jonasdottir A, Blondal T,
et al. A sequence variant on 17q21 is associated wiTh age at onset and severity of asThma. Eur J Hum Genet 2010; 18:902–08.
38.Hao K, Bossé Y, Nickle DC, Paré PD, Postma DS, Laviolette M, Sandford A, Hackett TL, Daley D, Hogg JC, Elliott WM, et al. Lung eQTLs to help reveal The molecular underpinnings of asThma. PLoS Genet 2012; 8:e1003029.
39.Nieuwenhuis MA, Siedlinski M, van den Berge M, Granell R, Li X, Niens M, van der Vlies P, Altmüller J, Nürnberg P, Kerkhof M, van Schayck OC, Riemersma RA, van der Molen T, de Monchy JG, Bossé Y, Sandford A, Bruijnzeel-Koomen CA, GerTh van Wijk R, Ten Hacken NH, Timens W, Boezen HM, Henderson J, Kabesch M, Vonk JM, Postma DS, Koppelman GH. Combining genome wide association study and lung eQTL analysis provides evidence for novel genes associated wiTh asThma. Allergy Eur J Allergy Clin Immunol 2016; 71:1712–20.
40.Ferreira MAR, MaThur R, Vonk JM, et al. Genetic architectures of childhood- and adult-onset asThma are partly distinct. Am J Hum Genet 2019; 104:665–84.
41.Pividori M, Schoettler N, Nicolae DL, Ober C, Im HK. Shared and distinct genetic risk factors for childhood-onset and adult-onset asThma: genome-wide and transcriptome-wide studies. Lancet Respir Med 2019; 7:509–22.
42.Moffatt MF, Gut IG, Demenais F, Strachan DP, Bouzigon E, HeaTh S, von Mutius E, Farrall M, LaThrop M, Cookson WOCM; GABRIEL Consortium.
A large-scale, consortium-based genomewide association study of asThma. N Engl J Med 2010; 363:1211-1221.
43.Bønnelykke K, MaTheson MC, Pers Th, Granell R, Strachan DP, Alves AC, Linneberg A, Curtin JA, Warrington NM, Standl M, Kerkhof M. et al. Meta-analysis of genome-wide association studies identifies ten loci influencing allergic sensitization. Nat Genet 2013; 45:902-906.
44.El-Husseini ZW, Gosens R, Dekker F, Koppelman GH. The genetics of asThma and The promise of genomics-guided drug target discovery. Lancet Respir Med 2020; 8:P1045-1056.
45.Greer FR, Sicherer SH, Burks AW; COMMITTEE ON NUTRITION; SECTION ON ALLERGY AND IMMUNOLOGY. The Effects of Early Nutritional Interventions on The Development of Atopic Disease in Infants and Children: The Role of Maternal Dietary Restriction, Breastfeeding, Hydrolyzed Formulas, and Timing of Introduction of Allergenic Complementary Foods. Pediatrics 2019; 143(4):e20190281.
46.Burke H, Leonardi-Bee J, Hashim A, Pine-Abata H, Chen Y, Cook DG, Britton JR, McKeever TM. Prenatal and passive smoke exposure and incidence of asThma and wheeze: systematic review and meta-analysis. Pediatrics 2012; 129:735-44.
47.Bowatte G, Lodge C, Lowe AJ, Erbas B, Perret J, Abramson MJ, MaTheson M, Dharmage SC. The influence of childhood traffic-related air pollution exposure on asThma, allergy and sensitization: a systematic review and a meta-analysis of birTh cohort studies. Allergy 2015; 70:245-56.
48.Hansen S, Strøm M, Maslova E, Dahl R, Hoffmann HJ, Rytter D, Bech BH, Henriksen TB, Granström C, Halldorsson TI, Chavarro JE, Linneberg A, Olsen SF. Fish oil supplementation during pregnancy and allergic respiratory disease in The adult offspring. J Allergy Clin Immunol 2017; 139:104-111.e4.
49.Holt PG. Key factors in The development of asThma:
atopy. Am J Respir Crit Care Med 2000; 161:S172-5.
50.Magnusson CGM. Cord serum IgE in relation to amily
history and as predictor of atopic disease in early infancy. Allergy 1988;
43:241-51.
51.Edenharter G, Bergmann RL, Bergmann KE, Wahn V, Foster
J, Zepp F, Sahn U. Cord blood-IgE as a risk factor and predictor for atopic
diseases. Clin Exp Allergy 1998; 28:671-8.
52.Kaan A, Dimich-Ward H, Manfreda J, Becker A, Watson
W, Ferguson A, Chan H, Chan-Yeung M. Cord blood IgE: Its determinants and
prediction of development of asThma and oTher allergic disorders at 12 monThs.
Ann Allergy, AsThma Immunol 2000; 84:37-42.
53.Jones CA, Holloway JA, Warner JO. Does atopic disease start in foetal life? Allergy 2000; 55:2-10.
54.von Mutius E. The environmental predictors of allergic
disease. J Allergy Clin Immunol 2000; 105:9-19.
55.Romagnani S. The role of lymphocytes in allergic
disease. J Allergy Clin Immunol 2000; 105:399-408.
56.Romagnani S. Regulation of Th2. evelopment in allergy. Curr Opin Immunol 1994; 6:838-46.
57.Kilpelainen M, Terho EO, Helenius H, Koskenvuo M.
Farm environment in childhood prevents The development of allergies. Clin
Exp Allergy 2000; 30:201-8.
58.Riedler J, Eder W, Oberfeld G, Schreuer M. Austrian
children living on a farm have less hay fever, asThma and allergic sensitization. Clin Exp Allergy 2000; 30:194-200.
59.Von Ehrenstein OS, Von Mutius E, Lili S et al. Reduced
risk of hay fever and asThma among children of farmers. Clin Exp Allergy 2000;
30:187-93.
60.Shaheen SO, Aaby P, Hall AJ, Barker DJ, Heyes CB, Shiell AW, Goudiaby A.
Measles and atopy
in Guinea-Bissau. Lancet 1996; 347:1792-6.
61.Matricardi PM, Rosmini F, Ferrigno L, Nisini R, Rapicetta M, Chionne P, Stroffolini T, Pasquini P, D'Amelio R.
Cross-sectional retrospective study of prevalence of atopy among Italia
Matricardi PM, Rosmini F, Ferrigno L, Nisini R, Rapicetta M, Chionne P, Stroffolini T, Pasquini P, D'Amelio R.
n military
students wiTh antibodies against hepatitis A virus. BMJ 1997; 314:999-1003.
62.Shirakawa T, Enomoto T, Shimazu S, Hopkin JM. The
inverse association between tuberculin responses and atopic disorder. Science 1997; 275:77-9.
63.von Hertzen L, Klaukka T, Mattila H, Haahtela T.
Mycobacterium tuberculosis infection and The subsequent development of asThma
and allergic conditions. J Allergy Clin Immunol 1999; 104:1211-4.
64.Braun-Fahrländer C, Riedler J, Herz U, Eder W, Waser M, Grize L, Maisch S, Carr D, Gerlach F, Bufe A, Lauener RP, Schierl R, Renz H, Nowak D, von Mutius E; Allergy and Endotoxin Study Team. Environmental exposure to endotoxin and its relation to asThma and
allergic disease. N Engl J Med 2002; 347:869-77.
65.Stein MM, Hrusch CL, Gozdz J, Igartua C, Pivniouk V, Murray SE, Ledford JG, Marques Dos Santos M, Anderson RL, Metwali N, Neilson JW, Maier RM, Gilbert JA, Holbreich M, Thorne PS, Martinez FD, von Mutius E, Vercelli D, Ober C, Sperling AI.
Innate immunity and asThma risk in Amish and Hutterite farm children. N Engl J Med 2016; 375:411-421.
66.Thorne PS, Kulhánková K, Yin M, Cohn R, Arbes SJ Jr, Zeldin DC. Endotoxin exposure is a risk factor for asThma: The national survey of endotoxin in United States housing. Am J Respir Crit Care Med 2005; 172:1371-7.
67.Tavernier G, Fletcher G, Gee I, Watson A, Blacklock G, Francis H, Fletcher A, Frank T, Frank P, Pickering CA, Niven R. IPEADAM study: indoor endotoxin exposure, family status, and some housing characteristics in English children. J Allergy Clin Immunol 2006; 117:656-62.
68.Feldman AS, He Y, Moore ML, Hershenson MB, Hartert TV. Toward primary prevention of asThma. Reviewing The evidence for early-life respiratory viral infections as modifiable risk factors to prevent childhood asThma. Am J Respir Crit Care Med 2015; 191:34-44.
69.Bloomfield SF, Rook GA, Scott EA, Shanahan F, Stanwell-SmiTh R, Turner P. Time to abandon The hygiene hypoThesis: new perspectives on allergic disease, The human microbiome, infectious disease prevention and The role of targeted hygiene. Perspect Publ 2016; 136:213-24.
70.Wood LG, Garg ML, Smart JM, Scott HA, Barker D, Gibson PG. Manipulating antioxidant intake in asThma: a randomized controlled trial. Am J Clin Nutr 2012; 96:534-43.
71.Shore SA, Fredberg JJ. Obesity, smooTh muscle, and airway hyperresponsiveness. J Allergy Clin Immunol 2005; 115(5):925.
72.BeuTher DA, Weiss ST, SuTherland ER. Obesity and asThma. Am J Respir Crit Care Med 2006;174(2):112-9.
73.Ekici A, Ekici M, Erdemoglu AK. Effect of aziThromycin
on The severity of bronchial hyperresponsiveness in patients wiTh mild asThma. J AsThma 2002; 39:181-5.
74.Kraft M, Cassell GH, Pak J, et al. Mycoplasma pneumoniae
and Chlamydia pneumoniae in asThma: effect of clariThromycin. Chest 2002;
121:1782-8.
75.Tromp SW. Influence of weaTher and climate on asThma and bronchitis. Rev Allergy 1968; 22:1027-44.
76.Cullen KJ. Climate and chest disoreders in schoolchildren. BMJ 1972; 4:65-7.
77.Corey MJ, Cordon I. AsThma and climatic conditions:experience from Bermuda, an isolated island community. BMJ 1986; 293:843-4.
78.Weiland SK, Husing A, Strachan DP, Rzehak P, Pearce N, and The ISAAC Phase One Study Group. Climate and The prevalence of symptoms of asThma, allergic rhinitis, and atopic eczema in children. Occup Environ Med 2004; 61:609-15.
79.ten Brinke A, Zwinderman AH, Sterk PJ, Rabe KF, Bel EH. Factors associated wiTh persistent airflow limitation in severe asThma. Am J Respir Crit Care Med 2001; 164:744-8.
80.Thompson NC, Spears M. The influence of smoking on The treatment response in patients wiTh asThma. Curr Opin Allergy Clin Immunol 2005; 5: 57-63.
81.Pedersen B, Dahl R, Karlstrom R, Peterson CG, Venge P. Eosinophil and neutrophil activity in asThma in a one-year trial wiTh inhaled budesonide: The impact of smoking. Am J Respir Crit Care Med 1996; 153:1519-29.
82.Silverman RA, Boudreaux ED, Woodruff PG, Amargo CA Jr. Cigarette smoking among asThmatic adults presenting to 64 emergency departments. Chest 2003; 123:1472-9.
83.Sturdy PM, Butland BK, Anderson HR, et al. DeaThs certified as asThma and use of medical services: a national case-control study. Thorax 2005; 60:909-15.
84.Busselton HealTh Study: The effects of asThma and cigarette smoking. Am J Respir Crit Care Med 2005; 171:109-14.
85.Burke H, Leonardi-Bee J, Hashim A, et al. Prenatal and passive exposure and incidence of asThma and wheeze: systematic review and meta-analysis. Pediatrics 2012; 129:735-44.
86.Sandeberg S, Paton JY, Ahola S, et al. The role of acute and chronic stress in asThma attacks in children. Lancet 2000; 256:982-7.
87.Kipelainen M, Koskenvuo M, Helenius H et al. Stressful events promote The manifestation of asThma and atopic diseases. Clin Exp Allergy 2002; 32:256-63.
88.Lefevre F, Moreau D, Semon E, et al. Maternal depression related to infant's wheezing. Pediatr Allergy Immunol 2011; 22:608-13.
89.Levitan H. Onset of asThma during intense mourning. Psycosomatics 1985; 26:939-41.
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|