|
Asma
Resposta Tardia da Asma
CÉLULAS EPITELIAIS
O dano epitelial é uma característica patológica observada em todos os fenótipos de asma.1 |
|
O epitélio das vias aéreas é uma barreira ao meio ambiente, um regulador do conteúdo líquido da superfície das vias aéreas e uma fonte de citocinas e outros produtos que regulam a sua fisiologia. O epitélio protege as vias aéreas e o pulmão distal de lesões, patógenos e alérgenos. Em síntese, o epitélio das vias aéreas assume uma importante função como ponto de contato crítico entre o organismo e o mundo externo, desempenhando um papel fundamental na regulação da estabilidade interna diante das influências ambientais. (Figura 1)
A origem do epitélio das vias aéreas superiores não é a mesma quando relacionada ao desenvolvimento do epitélio das vias aéreas inferiores e alveolar. A característica do epitélio muda em regiões específicas, sendo um epitélio colunar pseudoestratificado no nariz, traqueia e brônquios, passando para células cuboidais nos bronquíolos e formando um epitélio
alveolar denso de uma única célula,2,3 altamente vascularizado responsável pelas trocas gasosas.
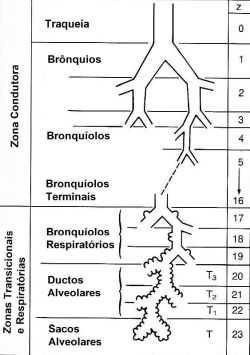 A análise mais aceita da anatomia normal das vias aéreas continua sendo a de Weibel4 que numerou gerações sucessivas de vias aéreas da traqueia (geração 0) até os sacos alveolares (geração 23) (Figura 2). Esta fórmula indica uma traqueia, dois brônquios principais, quatro brônquios lobares, 16 brônquios segmentares e assim por diante. A região de transição entre os bronquíolos terminais e os alvéolos é conhecida como junção do ducto bronquíolo-alveolar.
Nos alvéolos os pneumócitos do Tipo I são células epiteliais de forma plana que facilitam a transferência de oxigênio para a corrente sanguínea,5 enquanto que os pneumócitos do Tipo II são células em forma cuboidal que servem como células progenitoras para os pneumócitos Tipo I e contribuem para o tecido alveolar regenerando-o após lesão. Elas participam da produção de surfactante para reduzir a tensão superficial na interface ar-líquido do pulmão, e desempenham
uma função essencial como facilitadoras de diversas atividades das células do sistema imunológico relacionadas aos mecanismos de defesa antiviral.6,7 A análise mais aceita da anatomia normal das vias aéreas continua sendo a de Weibel4 que numerou gerações sucessivas de vias aéreas da traqueia (geração 0) até os sacos alveolares (geração 23) (Figura 2). Esta fórmula indica uma traqueia, dois brônquios principais, quatro brônquios lobares, 16 brônquios segmentares e assim por diante. A região de transição entre os bronquíolos terminais e os alvéolos é conhecida como junção do ducto bronquíolo-alveolar.
Nos alvéolos os pneumócitos do Tipo I são células epiteliais de forma plana que facilitam a transferência de oxigênio para a corrente sanguínea,5 enquanto que os pneumócitos do Tipo II são células em forma cuboidal que servem como células progenitoras para os pneumócitos Tipo I e contribuem para o tecido alveolar regenerando-o após lesão. Elas participam da produção de surfactante para reduzir a tensão superficial na interface ar-líquido do pulmão, e desempenham
uma função essencial como facilitadoras de diversas atividades das células do sistema imunológico relacionadas aos mecanismos de defesa antiviral.6,7
O epitélio brônquico é formado por cinco tipos principais de células (célula basal, colunar ciliada, célula em clava, célula caliciforme e suprabasais) e células raras como ionócitos, células neuroendócrinas pulmonares e células em tufo/escova,8 que juntas, formam uma camada pseudoestratificada.9 As células em clava podem dar origem a células ciliadas e caliciformes, apresentando a extraordinária capacidade de se desdiferenciar em células basais, se necessário (p. ex. após lesão/perda de células basais).10,11 A camada epitelial repousa sobre um substrato de tecido conjuntivo, consistindo de membrana basal, lâmina própria e submucosa, contendo fibras musculares, glândulas e cartilagem (Figura 1).
As células basais são encontradas no epitélio das vias aéreas desde a traqueia decrescendo em número até os bronquíolos respiratórios.12 Ficam abaixo das células colunares, dando origem à aparência pseudoestratificada e estão ausentes nos bronquíolos. São as células-tronco responsáveis por produzir novas células epiteliais e caliciformes. Elas são células-tronco candidatas nas vias aéreas, responsáveis pela "reposição" celular normal e remodelamento epitelial após lesão pulmonar.13
As células ciliadas, o tipo celular predominante no epitélio das vias aéreas, são caracterizadas pelo citoplasma transparente aos elétrons e são responsáveis pela propulsão da secreção traqueobrônquica em direção à faringe. Estas células também influenciam a composição do líquido periciliar e, posteriormente, a batida dos cílios.
As células caliciformes e as células serosas, ao contrário das células epiteliais ciliadas, têm grânulos com elétrons densos contendo, respectivamente, mucina ácida e neutra, que proporcionam a cobertura mucosa com propriedades viscoelásticas específicas requeridas para batimento ciliar eficaz e depuração mucociliar.
As células em clava possuem a capacidade de se renovar autonomamente e de produzir células ciliadas para regenerar o tecido danificado das vias respiratórias.
A presença de células basais contribui para a aparência pseudoestratificada do epitélio nos grandes brônquios e traqueia e desempenham um papel na ligação das células superficiais à membrana basal das vias respiratórias. Embora as células mucosas e serosas tenham se mostrado capazes de divisão, as células basais são consideradas as células-tronco (progenitoras) das outras células epiteliais.14 Na presença de IL-13, as células ciliadas também sofrem transdiferenciação em células caliciformes.15
Na asma, as glândulas mucosas são encontradas em toda a árvore brônquica, presentes inclusive nos bronquíolos periféricos, onde normalmente estão ausentes. As glândulas mucosas nos brônquios segmentares de pacientes com asma estão consideravelmente aumentadas, com volume duas vezes maior do que em normais. O aumento das células caliciformes pode ser obscurecido pela descamação epitelial. As secreções glandulares excessivas, provavelmente são desencadeadas pela degranulação dos mastócitos e parecem ter importante contribuição para a mortalidade do estado asmático.16
O epitélio brônquico na visão tradicional constituía-se somente em uma barreira física passiva aos agentes nocivos e ao ambiente externo, preservando o isolamento dos tecidos internos de possíveis ameaças externas. Hoje sabe-se que as células epiteliais das vias aéreas desempenham um papel importante nas funções imunológicas inatas dos pulmões e são essenciais na manutenção da homeostase das vias aéreas porém, ao mesmo tempo, podem iniciar e perpetuar a inflamação que pode resultar em sério dano às vias aéreas. Assim, a capacidade do epitélio de atuar como uma barreira física depende da integridade das células que o compõem e de suas conexões, especialmente as junções estreitas e aderentes.17 Somente nas últimas décadas a influência do epitélio brônquico na inflamação começou a ser conhecida. Mesmo em pacientes com asma leve, extensas áreas de epitélio danificado podem ser evidenciadas. O epitélio desenvolve um papel metabólico ativo, tendo participação importante na modulação da inflamação.
O epitélio exerce influência na resposta inflamatória como células alvo e como células efetoras. As células epiteliais são alvo de estímulos tanto endógenos como exógenos que influenciam respostas que variam de mudanças na dinâmica ciliar, regulação do transporte de íons e fluidos, produção, secreção e mobilização de muco, na produção de mediadores, incluindo substâncias antibacterianas (lactoferrina e lisozima), antiproteases, sistemas antioxidantes (superóxido dismutase, catalase, ciclo redox da glutationa) e inclusive a apresentação de antígenos e substâncias estranhas às células imunológicas das vias aéreas. O epitélio das vias aéreas é dinâmico e continuamente reabastecido por células progenitoras basais.18,19
As células epiteliais das vias aéreas expressam receptores de reconhecimento de padrões (PRRs), genes indutíveis por ácido retinóico (RIG) – receptores semelhantes ao gene I induzível pelo ácido retinoico (RLRs), que coordenam a expressão de interferons Tipo I e outros genes essenciais, os quais colaboram para estabelecer uma eficaz resposta antiviral; assim como receptor ativado por protease (PAR)-2, que reconhece agentes bacterianos e alérgenos respectivamente. Outros receptores de padrões que 'equipam' as células epiteliais são os receptores toll-like (TLRs) que detectam e iniciam rapidamente uma resposta imunológica a ameaças microbianas e os receptores de citocinas, incluindo o TNFR1, que lhes permitem responder a sinais produzidos por células imunológicas, como os macrófagos das vias aéreas.20 Outras classes de receptores são os de reconhecimento de padrões citoplasmáticos – receptores semelhantes a domínio de oligomerização de ligação a nucleotídeos (NOD) (NLRs), receptores de lectina tipo C (CLRs) e receptores purinérgicos também identificados.21,22,23
"Os PRRs (receptores de reconhecimento de padrões) presentes nas células epiteliais das vias aéreas são capazes de identificar tanto PAMPs (padrões moleculares associados a patógenos), derivados de microrganismos, quanto DAMPs (padrões moleculares associados a danos), liberados em situações de morte celular ou lesão tecidual. Quando ativados por esses padrões, os PRRs desencadeiam a produção de citocinas, que, por sua vez, recrutam e estimulam a atividade de células do sistema imune inato e adaptativo."24
A ativação desses receptores provoca a liberação de uma série de moléculas efetoras de defesa, que compreendem fatores antimicrobianos (lisozima, defensinas, colectinas e pentraxinas), citocinas antivirais (interferons), eicosanoides, peptidases, óxido nítrico e citocinas pró-inflamatórias (IL-1, IL-6), TNF-a) bem como o fator estimulante de colônias de granulócitos e macrófagos (GM-CSF).25,26
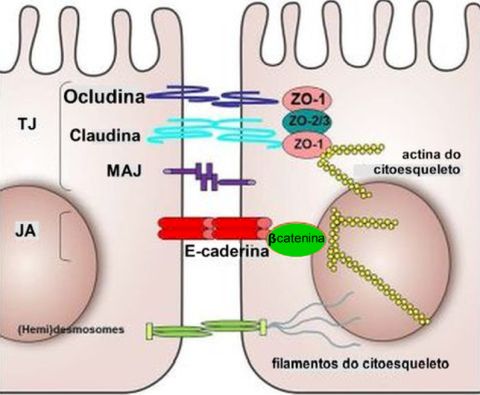
O epitélio brônquico forma uma camada contínua, compacta, e deste modo protege o tecido subjacente contra agentes nocivos, mantendo a arquitetura tecidual. A integridade é mantida por vários mecanismos de adesão.27 Uma das principais características do remodelamento epitelial na asma é a perda de proteínas de contato célula-célula, que mecanicamente conectam células epiteliais adjacentes, promovendo assim a manutenção de uma barreira intacta. A impermeabilidade da barreira epitelial é assegurada pelas junções estreitas [tight junctions], junções aderentes [adherens junctions] e desmossomos [macula adherens], o que mantém as células unidas e mantém a polaridade ápicobasal (Figura 3).21,28,29
As junções estreitas estão localizadas na parte mais apical da célula, são formadas por proteínas como claudinas, ocludinas e
as proteínas de ancoragem da zonula occludens (ZO-1, ZO-2 e ZO-3), tendo como função controlar o transporte paracelular das partículas inaladas e o fluxo de moléculas que ocupam o espaço intercelular no epitélio.30 As junções aderentes são formadas por proteínas como caderinas (especiallmente E-caderina), glicoproteínas dependentes de cálcio, ligadas ao citoesqueleto da actina. Promovem adesão estável entre células vizinhas e coordenam com as junções estreitas ações para manter o epitélio coeso. Tem relevante ação na manutenção estrutural e sinalização intracelular. Os desmossomos são compostos por proteínas como desmogleínas e desmocolinas ligadas ao citoesqueleto de filamentos intermediários, com a função de conferir resistência mecânica e suporte estrutural. Essas estruturas são as principais reguladoras da permeabilidade epitelial.30
A alteração das estruturas do epitélio conduz a complicações de relevância em doenças respiratórias como na asma onde a E-caderina que é uma molécula transmembrana, se liga à E-caderina da célula vizinha. No lado citoplasmático, a E-caderina se liga a ß-catenina. Na asma a quebra das junções pode liberar ß-catenina, ativando vias inflamatórias. A redução da E-caderina (por IL-4, IL-13) diminui a ligação da ß-catenina à membrana, promovendo sua função como sinalizador nuclear. A ß-catenina por sua vez se liga a α-catenina que se conecta aos filamentos de actina do citoesqueleto. A expressão interrompida de E-caderina, ß-catenina, ZO-1 e occludina foi observada no epitélio das vias aéreas de pacientes asmáticos,17,22,31 prejudicando a função de barreira do epitélio.32,33 Em particular, o fenômeno das E-caderinas pode ser atribuído à transição epitélio-mesenquimal (TEM), na qual as células epiteliais perdem sua polaridade, capacidade adesiva e ancoragem à membrana basal, adquirindo, em contrapartida, características mesenquimais, como maior habilidade migratória.34-36 Um dos fatores mais proeminentes para induzir à TEM é o fator de crescimento transformador ßeta (TGF-ß).37
As partículas fecais do ácaro da poeira doméstica (Dermatophagoides pteronyssinus) contêm muitos alérgenos (Derp1-) que aumentam a permeabilidade do epitélio brônquico medida por diminuição na resistência elétrica transepitelial, diretamente através da ativação da proteases e indiretamente através do receptor ativado de protease (PAR2).38-40 Essa ruptura das junções estreitas na camada epitelial não apenas desregula a diferenciação das células epiteliais, mas também favorece a penetração de outros alérgenos e patógenos, que desencadeiam ou exacerbam a asma.41-43 Este processo se caracteriza pela expressão diminuída de proteínas estruturais que compõem as junções estreitas como ocludinas, ZOs, e claudinas nas células epiteliais.43,44
Já está bem comprovado que a presença do vírus sincicial respiratório ou rinovírus nas vias aéreas e a subsequente infecção das células epiteliais das vias aéreas por esses vírus, causam a desintegração das junções aderentes epiteliais e induzem à maior permeabilidade do epitélio das vias aéreas.
Tanto em biópsias de pacientes com asma leve como naqueles com asma severa, constatam-se alterações do epitélio brônquico, caracterizadas pelo desnudamento epitelial com a perda de sua integridade. O dano epitelial é decorrente da ação da proteína básica maior (MBP) e de outros mediadores inflamatórios liberados por eosinófilos ativados; por infecções virais; pela exposição ao ozônio, a sensibilizantes químicos e a alérgenos; pela ação de radicais livres; pela atuação de proteases liberadas por células inflamatórias; todos com ações altamente tóxicas sobre o epitélio respiratório.
Os ácaros do pó doméstico, baratas, fungos e extratos de mofo, todos são potencialmente capazes de romper as junções epiteliais via ativação do receptor PAR-2.45
A função prejudicada de barreira epitelial é acompanhada por respostas ao interferon comprometidas na asma, resultando em aumento da replicação viral após infecção por rinovírus em comparação com culturas epiteliais não derivadas de asma.46 Vários estudos in vitro mostraram que os alérgenos podem romper a barreira epitelial das vias aéreas.47 Além das infecções virais,48-51 o tabagismo,52 a colonização bacteriana e fatores ambientais relacionados à poluição,53-55 podem conduzir à disfunção da barreira epitelial com o rompimento das junções estreitas.
Vários estudos confirmaram associação entre a lesão epitelial da asma e o grau de hiper-responsividade brônquica.56-59 Esta associação pode ser explicada por vários mecanismos.
■ O dano epitelial resultaria em perda da função de barreira, permitindo que agentes nocivos ou alérgenos penetrem diretamente na parede brônquica e alcancem a submucosa. Na submucosa, estas substâncias podem ativar células inflamatórias capazes de liberar mediadores inflamatórios e que modulam o tônus do músculo liso peribrônquico.
■ O dano epitelial pode expor terminações nervosas aferentes desmielinizadas. Em consequência, estes nervos podem ser facilmente estimulados por mediadores inflamatórios ou partículas inaladas, conduzindo a reflexo axonal e subsequente liberação de neuropeptídios que determinam inflamação neurogênica.60
■ O epitélio secreta substâncias que podem contribuir para suprimir a broncoconstrição (fatores relaxantes), tais como as prostaglandinas (PGE2), a prostaciclina, o óxido nítrico e o
fator relaxante derivado do epitélio (EpDRF).61 A perda destes fatores pode contribuir para a hiper-responsividade brônquica.
■ As células epiteliais brônquicas contêm a enzima endopeptidase neutra (NEP), que participa do metabolismo de uma variedade de peptídios, com efeitos contráteis sobre a musculatura lisa. O dano epitelial com a perda da atividade da NEP pode diminuir a degradação química destes peptídios e desta forma aumentar a broncoconstrição.62,63
■ O dano epitelial é capaz de desencadear a produção e liberação de mediadores, como a PGE2a o HODE (13-hydroxy-linoleic acid) e a endotelina-1 (ET-1), que podem também afetar a hiper-responsividade.64
■ A própria broncoconstrição
proporciona um fenômeno mecânico pró-inflamatório que comprime a camada epitelial, causando uma aglomeração celular patológica que determinaria por sua vez pronunciada extrusão de células epiteliais, que danifica as vias aéreas com ruptura da barreira epitelial com subsequente inflamação, secreção de muco e liberação de mediadores inflamatórios.65
O epitélio medeia processos inflamatórios complexos em resposta à exposição a alérgenos ou gatilhos não alérgicos, incluindo a liberação de um trio de citocinas epiteliais, conhecidas como "alarminas".66 As alarminas IL-25, IL-33 e linfopoetina estromal tímica (TSLP) estimulam respostas inflamatórias por meio de inúmeras vias, incluindo endótipo Tipo 2 (IL-4, IL-13 e IL-5) e outros, como vias conduzidas por TH1 – ou TH17 – (IL-17), resultando em vários desdobramentos fisiopatológicos que podem levar a sintomas de asma e exacerbações.66,67 A lesão epitelial desencadeia a liberação de diferentes citocinas, quimiocinas e peptídios antimicrobianos, os quais recrutam e ativam tanto células imunes inatas quanto adaptativas, desempenhando um papel essencial na mediação das respostas imunes e antivirais necessárias, seguidas pelo processo de reparo do epitélio. (Figura 4)
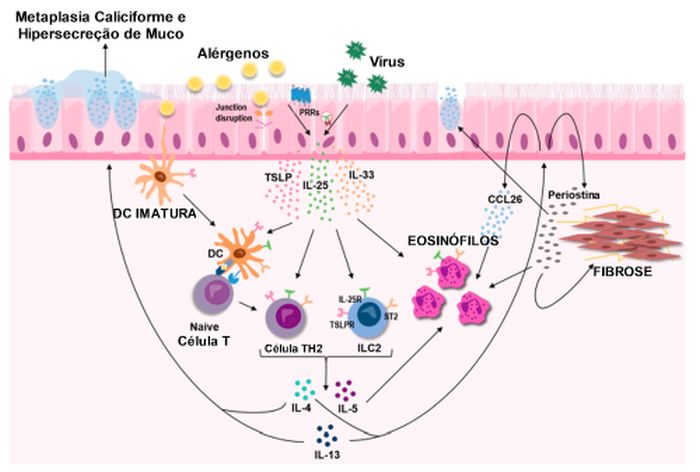
Figura 4 – As citocinas epiteliais, conhecidas como "alarminas" TSLP, IL-25, IL33, são secretadas em reação a diversos estímulos, incluindo alérgenos e vírus respiratórios. Elas desempenham um papel central como as principais impulsionadoras iniciais da inflamação Tipo 2 nas vias aéreas, influenciando tanto células imunes inatas quanto adaptativas. Figura retirada de Calvén J et al. Int J Mol Sci 2020 Nov 24;21(23):8907.
A IL-25 é expressa no epitélio das vias aéreas como uma citocina pré-formada e armazenada no citoplasma, permitindo assim uma rápida liberação após estimulação celular por gatilhos ambientais, inclusive alérgenos.68
A IL-25 provoca um tipo de inflamação TH2-skewed marcada por superexpressão das citocinas IL-4, IL-5 e IL-13, observando-se que em pacientes com asma isso leva a um aumento nos níveis séricos de IgE, eosinofilia sanguínea e alterações patológicas nos pulmões caracterizadas por aumento de produção de muco e hiperplasia de células epiteliais.57,69 A liberação de IL-25 pelas células epiteliais das vias aéreas contribui para muitas outras características patogênicas da asma, incluindo o recrutamento de eosinófilos e remodelação das vias aéreas. A ativação de eosinófilos por IL-25 aumenta a expressão gênica e a liberação de várias quimiocinas, incluindo proteína quimioatraente de monócito-1 (MCP-1), proteína inflamatória do macrófago-1a (MIP-1a) e citocinas IL-8 e IL-6.70 Além disso, IL-25 demonstrou aumentar significativamente a expressão de superfície da molécula de adesão intercelular-1 (ICAM-1) enquanto suprime ICAM-3 e L-selectina em eosinófilos, facilitando assim transmigração endotelial.71 A IL-25 se liga a um receptor heterodimérico, o IL-17RA/IL-17RB (IL-25R), o qual está presente em diversos tipos celulares, incluindo ILC2s, células TH2 de memória ativada, células dendríticas (DCs) ativadas por TSLP, mastócitos, eosinófilos e células endoteliais.72-76 A IL-25 contribui para a angiogênese na asma, aumentando a expressão do receptor do fator de crescimento endotelial vascular (VEGF) / VEGF nas células endoteliais.77
A IL-33 é uma molécula que após dano do epitélio pode orquestrar o recrutamento e ativação de células responsáveis pela inflamação. A expressão de IL-33 é regulada positivamente na mucosa brônquica de pacientes asmáticos, relacionada à gravidade da doença.78,79 Nos brônquios, a liberação de IL-33 foi proposta como responsável pelo desencadeamento e exacerbação da hiper-responsividade das vias aéreas e asma.80,81
A IL-33 é altamente expressa no epitélio brônquico de pacientes com asma69 com expressão aumentada após exposição a alérgenos ambientais,69,82,83 sendo uma das primeiras citocinas liberadas em resposta a alérgenos e sua concentração elevada se correlaciona com a gravidade da doença.84 A IL-33 induz diretamente à produção de citocinas, incluindo IL-4, IL-5, IL-13 e IL-9 em células T CD4+.85
A IL-33 se liga a um receptor heterodimérico composto pelo receptor 1 de IL-1 (IL1RL1, também chamado de ST2) e pela proteína acessória do receptor de IL-1, resultando na ativação das vias de sinalização NF-kB e MAPK.72,86,87 A função mais estabelecida da IL-33 é a ativação de células imunes que expressam ST2 envolvidas na imunidade T2, como ILC2s, células TH2, mastócitos, eosinófilos, DCs e basófilos.88-93
A IL-33 favorece a degranulação dos mastócitos e a produção de quimiocinas, aumentando a magnitude da resposta individual dos mastócitos.94 IL-33 modifica o fenótipo e a infiltração de mastócitos.
Inicialmente, foi observado que a TSLP estimula respostas alérgicas ao agir sobre as DCs, aumentando a expressão do ligante OX40 (OX40L), CD80 e CD86. Esse processo, por sua vez, facilita a diferenciação de células T CD4+naive em células TH2 pró-inflamatórias, que secretam IL-4, IL-5, IL-13 e TNF, contribuindo assim para a cascata inflamatória característica dessas respostas alérgicas.95,96
Os níveis de TSLP no lavado broncoalveolar e nas biópsias brônquicas estão elevados em pacientes com asma em comparação com indivíduos saudáveis e se correlacionam com a gravidade da doença, apresentando uma correlação negativa com a função pulmonar definida pelo volume expiratório forçado em 1 segundo (VEF1).97-100 A TSLP inicia múltiplas respostas imunológicas inatas e adaptativas downstream envolvidas na inflamação da asma.95,96, 101-103
Em resposta a estímulos patogênicos ou lesão mecânica, a TSLP exacerba a inflamação alérgica ativando muitas células efetoras que participam da cascata imune, incluindo células linfoides inatas ILC2s DCs mieloides.69,104-107 A TLSP produzida pelas células basais estimula as DCs, promovendo a maturação do fenótipo de células TH2 e a liberação de IL-4, IL-5 e IL-13.108
Os receptores TSLP foram descritos em mastócitos108 bem como em basófilos.110 Os mastócitos também demonstraram regular a expressão de TSLP,111 sugerindo que a TSLP derivada do epitélio pode afetar diretamente a função dos mastócitos e os mastócitos, por sua vez, podem regular a expressão de TSLP epitelial. Os mastócitos que são estimulados pela TSLP agem sinergicamente com IL-1β e TNF-a para liberar IL-5, IL-13, IL-6, IL-8, IL-10, GM-CSF e quimiocinas CXCL8 e CCL1, enquanto suprime a liberação de TGF-β.109
Existe uma hipótese de que o epitélio é capaz de regular o calibre das vias aéreas pela secreção de substâncias que alteram a responsividade e o relaxamento da musculatura lisa.112 A principal prostaglandina com características relaxantes sintetizada pelo epitélio é a PGE2. Embora pequenas quantidades de PGF2a sejam também produzidas pelo epitélio, podendo causar contração e hiper-responsividade muscular, a sua liberação é insignificante quando comparada às grandes quantidades de PGE2. Outra substância relaxante não prostanoide secretada pelo epitélio é o fator relaxante derivado do epitélio (EpDRF). Danos ao epitélio com remoção do mesmo por descamação podem estar associados à redução na produção do EpDRF e consequente broncoconstrição. Lesões epiteliais decorrentes de agentes infecciosos,113 principalmente os vírus, ou de poluentes atmosféricos alteraram a responsividade das vias aéreas em normais, sendo mais intensa em asmáticos, constituindo-se os vírus em um dos principais fatores de risco para o desenvolvimento e exacerbação da asma.
Como células efetoras as células epiteliais respondem a estes estímulos produzindo mediadores inflamatórios como as prostaglandinas (PGE2 e PGF2a), o ácido 15-(s) hidroxieicosatetraênico (15-HETE), o fator ativador de plaquetas (PAF), o óxido nítrico (NO), peptídios, citocinas (IL-6, IL-8, IL-11, GM-CSF, G-CSF) e quimiocinas. Além das quimiocinas tradicionais da família CC (MCP-1, MIP-1a, MIP-1ß, MIP-3a, RANTES, eotaxina-1, MCP-4, TARC, MDC, GRO-a, ENA-78, IL-8, IP-10) e das quimiocinas da família CXC (GRO-a, ENA-78, IL-8, IP-10), as células epiteliais das vias aéreas também expressam outras quimiocinas.114-121 Ao expressar e secretar quimiocinas, as células epiteliais das vias aéreas desempenham um papel importante na patogênese da inflamação das vias aéreas na asma, em resposta a estímulos alérgicos, microbianos e virais.122,123
Em asmáticos ocorre um aumento da síntese de IL-8117,124,125 pelas células epiteliais, desempenhando função de quimioatração para neutrófilos e linfócitos T,126,127 com potencial ação quimiotáxica para eosinófilos previamente expostos ao GM-CSF e IL-3.128 A IL-6 está ligada à ativação e proliferação de células T. O GM-CSF é uma das citocinas mais estudadas na asma, por contribuir para inflamação pelo aumento da sobrevida e ativação de eosinófilos, ativação de neutrófilos e de macrófagos, que passam a desenvolver atividade citotóxica aumentada, com a geração de mediadores e fagocitose.129,130 Os mecanismos pelos quais ocorre aumento na expressão GM-CSF pelo epitélio brônquico em asmáticos são desconhecidos, porém a estimulação pela IL-1 pode ter participação, pois os níveis da IL-1 estão elevados nas vias aéreas destes pacientes.131 Quando do uso de nedocromil sódico, um anti-inflamatório utilizado por inalação no tratamento da asma, ocorre redução do GM-CSF induzido pela IL-1 em mais de 40%, porém sem efeitos na produção da IL-1.132 A produção de RANTES pelas células epiteliais estimuladas em asmáticos contribui para o recrutamento de eosinófilos, pois o RANTES é quimiotáxico para eosinófilos, linfócitos T de memória e monócitos.133,134
No epitélio brônquico as ILC2s
são ativadas em resposta às citocinas epiteliais IL-25 e IL-33 e TSLP.
Em resposta às citocinas epiteliais as ILC2s são ativadas, expressam então fatores de transcrição ROR-a e GATA3 e receptores para citocinas epiteliais.135 As ILC2s apresentam muitas ações análogas às células TH2, entretanto são as únicas a secretar a IL-9 capaz de promover metaplasia de células caliciformes e estimular não só o crescimento como a sobrevivência dos mastócitos.136 Produzem grandes quantidades de PGD2 que causa a ativação das ILC2s de forma autócrina por agir no receptor CRTH2. A anfirregulina derivada de ILC2 desempenha um papel importante na regeneração epitelial e reparo do dano tecidual.135,137,138 As células ILC2 também induzem a produção de IgE e são reconhecidas como promotoras de respostas TH2 através da ativação de DCs em nível local.139,140
Quando de dano epitelial, ocorre liberação de um grande número de citocinas e quimiocinas dentre elas a liberação de citocinas fibrogênicas, incluindo IL-1β, interferon (IFN)-γ, fator de necrose tumoral (TNF), IL-4 e IL-13. Essas citocinas têm o potencial de diminuir a expressão das proteínas juncionais, criando um ciclo de lesão epitelial, remodelação das vias aéreas e inflamação.141
A periostina, uma proteína matricelular, é produzida a partir de células epiteliais das vias aéreas e fibroblastos pulmonares pela IL-13 e IL-4, envolvida na inflamação alérgica do paciente com asma e na fibrose. Atua promovendo remodelamento das vias aéreas, aumentando a secreção de muco e colabora ativamente no recrutamento de eosinófilos. Seus níveis séricos servem como biomarcador de inflamação.142
Na asma alérgica as células dendríticas são as principais células apresentadoras de antígenos (APCs) e entre as APCs são as únicas a ativar as células T naïves. Elas expressam uma ampla gama de receptores em sua superfície celular e desempenham um importante papel na resposta imune a alérgenos inalados.143 São encontradas no epitélio brônquico, onde são 4 a 8 vezes mais potentes do que os macrófagos alveolares como APCs.144 As CDs têm um papel importante não apenas na sensibilização a alérgenos, mas também na asma, sendo que o seu número se encontra bastante elevado na mucosa desses pacientes.145
Os receptores para a fração Fc da IgE – FcεRI e FcεRII/CD23 IgE são expressos diretamente em células epiteliais brônquicas humanas,146,147 sendo que estudos detectaram que a expressão de FcεRI está elevada no epitélio das vias aéreas de pacientes com asma quando comparado a controles.148
O muco reveste as vias aéreas condutoras até os bronquíolos terminais, compondo o que se convencionou chamar de manta mucociliar, que impulsiona o muco para cima até a traqueia, contra a gravidade, pelo epitélio ciliado. O muco no pulmão normal é composto essencialmente por 97% de água e um composto de mucinas, outras proteínas, sais, lipídios e resíduos celulares. Essa camada de muco serve a distintas funções como proteção, hidratação (manter as vias aéreas úmidas), transporte mucociliar, limpeza (captura de partículas), defesa imunológica e regulação ambiente.
As propriedades reológicas, no contexto do muco, têm sérias implicações na asma, principalmente na viscosidade, elasticidade e aderência.
A viscosidade é uma propriedade dos líquidos que descreve a resistência ao fluxo, geralmente determinada pela quantidade de moléculas presentes em uma substância. A elasticidade, por sua vez, refere-se à resistência à força de cisalhamento, resultante da reticulação das moléculas dentro de uma substância.149 As mucinas poliméricas que compõem o muco desempenham papéis importantes na determinação de ambos os parâmetros. As duas mucinas primárias encontradas no pulmão humano são MUC5B e MUC5AC.
Sua secreção envolve um processo complexo que inclui glicosilação, polimerização e acondicionamento em grânulos secretores desidratados, que se expandem após a hidratação na luz da via aérea.150,151 Elas têm padrões de expressão distintos, com MUC5B sendo secretada em altos níveis em glândulas submucosas e células secretoras nas vias aéreas distais, enquanto MUC5AC é secretada por células caliciformes.152 Atuam na primeira zona de defesa na superfície epitelial das vias aéreas na formação e manutenção da camada de muco que reveste a superfície.153
Sabe-se que na asma as células caliciformes sofrem hiperplasia e metaplasia com maior predomínio nas vias aéreas distais, sendo acompanhadas por alterações na secreção em excesso das mucinas, que podem ser muito difícil de se remover. MUC5AC e MUC5B são os principais componentes do muco das vias aéreas. Na asma a expressão da mucina se apresenta alterada, pois a produção da MUC5AC, cuja expressão é restrita geralmente às células caliciformes no trato respiratório alto e baixo,154,155 é regulada positivamente, enquanto a produção da MUC5B está reduzida. Isto resulta em um gel de muco heterogêneo das vias aéreas compreendendo 'domínios' MUC5AC e MUC5B distintos. É um muco intrinsecamente anormal em seu perfil biofísico, apresentando-se com viscosidade alterada. Se acumula, formam-se tampões mucosos que obstruem as vias aéreas.156 Isto configura a terceira alteração reológica, aderência aumentada, dificultando ainda mais a sua remoção. Os tampões mucosos na asma levam a maus desfechos. Nas exacerbações os tampões de muco obstruem as vias aéreas, contribuindo para o aprisionamento de ar e atelectasias, dificultando o tratamento. Na asma fatal esses tampões bloqueiam as vias respiratórias e assim as trocas gasosas, causando asfixia e morte. Altos níveis de coloração de MUC5AC são vistos nos tampões de muco de casos fatais de asma.157 O clearance mucociliar está prejudicado na asma.158 A frequência do batimento ciliar está reduzida na asma moderada e grave em comparação com controles159 e a direção do batimento ciliar é anárquico.160 Observou-se um aumento de até 15% no teor de mucina em situações de obstrução.161
O aumento da proteína MUC5AC e MUC5B foi relatado no escarro de indivíduos com asma.162 Em uma coorte de asma, uma proporção mais alta de MUC5AC para MUC5B correlacionou-se com inflamação Tipo 2.163 O MUC5AC é também um gene de susceptibilidade para a asma moderada a grave, mas não foi associado à asma leve.164
O epitélio brônquico pode expressar moléculas de adesão que se ligam a células inflamatórias como eosinófilos e neutrófilos. As consequências são de natureza estrutural e funcional: estrutural, pois tal expressão permite a ligação de células inflamatórias e funcional porque a expressão pode modificar a natureza do processo inflamatório.
As células do epitélio brônquico podem expressar a molécula MHC-classe II e, por conseguinte, como outras células epiteliais tais como os queratinócitos ou células M, serem capazes de desempenhar a função de células apresentadoras de antígenos. Esta capacidade, entretanto, é muito limitada, não tendo a mesma dimensão das DCs.
Ainda não é evidente se as células epiteliais podem ou não ser ativadas diretamente por alérgenos inalados. Vários alérgenos são proteases que podem ativar os receptores PAR-2, os quais apresentam expressão aumentada nas células epiteliais das vias aéreas de pacientes com asma.165 O grupo de Montpellier – França, descreveu através de uma comunicação,166 que as células epiteliais de pacientes com asma, porém não as de indivíduos sãos, apresentam receptores FceRI e FceRII capazes de serem diretamente ativados por anticorpos anti-IgE, sendo possível que estas células possam ser ativadas diretamente por alérgenos.
Referências
01.Papi A, Brightling C, Pedersen SE, Reddel HK. Asthma. Lancet 2018; 391:783-800.
02.Rock JR, Onaitis MW, Rawlins EL, Lu Y, Clark CP, Xue Y, Randell SH, Hogan BL. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc Natl Acad Sci U S A 2009; 106:12771-5.
03.Hiemstra PS, McCray PB Jr, Bals R. The innate immune function of airway epithelial cells in inflammatory lung disease. Eur Respir J 2015; 45:1150-62.
04.Weibel ER. Morphometry of Human Lung. Springer, Heildelberg and Academic Press. New York. 1963.
05.Weibel ER. On the tricks alveolar epithelial cells play to make a good lung. Am J Respir Crit Care Med 2015; 191:504-513.
06.Hogan B. Stemming lung disease? N Engl J Med 2018; 378:2439-2440.
07.Madan T, Biswas B, Varghese PM, Subedi R, Pandit H, Idicula-Thomas S, Kundu I, Rooge S, Agarwal R, Tripathi DM, Kaur S, Gupta E, Gupta SK, Kishore U. A Recombinant Fragment of Human Surfactant Protein D Binds Spike Protein and Inhibits Infectivity and Replication of SARS-CoV-2 in Clinical Samples. Am J Respir Cell Mol Biol 2021l; 65:41-53.
08.Luecken MD, Zaragosi LE, Madissoon E, Sikkema L, Firsova AB, De Domenico E, Kümmerle L, Saglam A, Berg M, Gay ACA, Schniering J, Mayr CH, Abalo XM, Larsson L, Sountoulidis A, Teichmann SA, van Eunen K, Koppelman GH, Saeb-Parsy K, Leroy S, Powell P, Sarkans U, Timens W, Lundeberg J, van den Berge M, Nilsson M, Horváth P, Denning J, Papatheodorou I, Schultze JL, Schiller HB, Barbry P, Petoukhov I, Misharin AV, Adcock IM, von Papen M, Theis FJ, Samakovlis C, Meyer KB, Nawijn MC. The discovAIR project: a roadmap towards the Human Lung Cell Atlas. Eur Respir J 2022; 60:2102057.
09.Crystal RG, Randell SH, Engelhardt JF, Voynow J, Sunday ME. Airway epithelial cells: current concepts and challenges. Proc Am Thorac Soc 2008; 5:772–7.
10.Basil MC, Katzen J, Engler AE, Guo M, Herriges MJ, Kathiriya JJ, Windmueller R, Ysasi AB, Zacharias WJ, Chapman HA, Kotton DN, Rock JR, Snoeck HW, Vunjak-Novakovic G, Whitsett JA, Morrisey EE. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell 2020; 26:482-502.
11.Tata PR, Mou H, Pardo-Saganta A, Zhao R, Prabhu M, Law BM, Vinarsky V, Cho JL, Breton S, Sahay A, Medoff B Lambrecht BN, Hammad H. The airway epithelium in asthma. Nat Med. 2012 May 4;18(5):684-92. D, Rajagopal J. Dedifferentiation of committed epithelial cells into stem cells in vivo. Nature 2013; 503:218-23.
12.Boers JE, Ambergen AW, Thunnissen FB. Number and proliferation of basal and parabasal cells in normal human airway epithelium. Am J Respir Crit Care Med 1998; 157:2000–2006.
13.Rawlins EL, Hogan BL . Epithelial stem cells of the lung: privileged few or opportunities for many? Development 2006; 133:2455–2465.
14.Montoro DT, Haber AL, Biton M, Vinarsky V, Lin B, Birket SE, Yuan F, Chen S, Leung HM, Villoria J, Rogel N, Burgin G, Tsankov AM, Waghray A, Slyper M, Waldman J, Nguyen L, Dionne D, Rozenblatt-Rosen O, Tata PR, Mou H, Shivaraju M, Bihler H, Mense M, Tearney GJ, Rowe SM, Engelhardt JF, Regev A, Rajagopal J. A revised airway epithelial hierarchy includes CFTR-expressing ionocytes. Nature 2018; 560(7718):319-324.
15.Turner J, Roger J, Fitau J, Combe D, Giddings J, Heeke GV, Jones CE. Goblet cells are derived from a FOXJ1-expressing progenitor in a human airway epithelium. Am J Respir Cell Mol Biol 2011; 44:276-84.
16.Widdicombe JH, Wine JJ. Airway Gland Structure and Function. Physiol Rev 2015; 95:1241-319.
17.Xiao C, Puddicombe SM, Field S, Haywood J, Broughton-Head V, Puxeddu I, Haitchi HM, Vernon-Wilson E, Sammut D, Bedke N, Cremin C, Sones J, Djukanovic R, Howarth PH, Collins JE, Holgate ST, Monk P, Davies DE. Defective epithelial barrier function in asthma. J Allergy Clin Immunol 2011; 128:549-556.e541-512.
18.Rock JR, Onaitis MW, Rawlins EL, Lu Y, Clark CP, Xue Y, Randell SH, Hogan BL. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc Natl Acad Sci U S A 2009; 106:12771-5.
19.Pardo-Saganta A, Law BM, Tata PR, Villoria J, Saez B, Mou H, Zhao R, Rajagopal J. Injury induces direct lineage segregation of functionally distinct airway basal stem/progenitor cell subpopulations. Cell Stem Cell 2015; 16:184-97.
20.Lehmann R, Müller MM, Klassert TE, Driesch D, Stock M, Heinrich A, Conrad T, Moore C, Schier UK, Guthke R, Slevogt H. Differential regulation of the transcriptomic and secretomic landscape of sensor and effector functions of human airway epithelial cells. Mucosal Immunol 2018; 11:627-642.
21.Heijink IH, Kuchibhotla VNS, Roffel MP, Maes T, Knight DA, Sayers I, Nawijn MC. Epithelial cell dysfunction, a major driver of asthma development. Allergy 2020; 75:1902-1917.
22.Pinto, AM, Todo-Bom, A. A intervenção da célula epitelial na asma. Rev Port Pneumol 2009; 15:461-472.
23.Liu T, Zhou YT, Wang LQ, Li LY, Bao Q, Tian S, Chen MX, Chen HX, Cui J, Li CW. NOD-like receptor family, pyrin domain containing 3 (NLRP3) contributes to inflammation, pyroptosis, and mucin production in human airway epithelium on rhinovirus infection. J Allergy Clin Immunol 2019; 144:777-787.e9.
24.Lambrecht BN, Hammad H. The airway epithelium in asthma. Nat Med 2012; 18:684-92.
25.Bonser LR, Erle DJ. The airway epithelium in asthma. Adv Immunol 2019; 142:1-34.
26.Yang D, Han Z, Oppenheim JJ. Alarmins and immunity. Immunol Rev 2017; 280:41-56.
27.Bai A, Eidelman DH, Hogg JC, James AL, Lambert RK, Ludwig MS, Martin J, McDonald DM, Mitzner WA, Okazawa M, Pack RJ, Paré PD, Schellenberg RR, Tiddens HAW, Wagner EM, Yager D. Proposed nomenclature for quantifying subdivisions of the bronchial wall. J Appl Physiol 1994; 77:1011-4.
28.Davis JD, Wypych TP. Cellular and functional heterogeneity of the airway epithelium. Mucosal Immunol 2021; 14:978-990. Erratum in: Mucosal Immunol 2022; 15:528.
29.Whitsett J, Alenghat T. Respiratory epithelial cells orchestrate pulmonary innate immunity. Nat Immunol 2015; 16:27–35.
30.Hartsock A, Nelson WJ. Adherens and tight junctions: structure, function and connections to the actin cytoskeleton. Biochim Biophys Acta 2008; 1778:660-669.
31.de Boer WI, Sharma HS, Baelemans SM, Hoogsteden HC, Lambrecht BN, Braunstahl GJ. Altered expression of epithelial junctional proteins in atopic asthma: possible role in inflammation. Can J Physiol Pharmacol 2008; 86:05-112.
32.Hackett TL, Singhera GK, Shaheen F, Hayden P, Jackson GR, Hegele RG, Van Eeden S, Bai TR, Dorscheid DR, Knight DA. Intrinsic phenotypic differences of asthmatic epithelium and its inflammatory responses to respiratory syncytial virus and air pollution. Am J Respir Cell Mol Biol 2011; 45:1090-100.
33.Heijink IH, Brandenburg SM, Noordhoek JA, Postma DS, Slebos DJ, van Oosterhout AJM. Characterisation of cell adhesion in
airway epithelial cell types using electric cell-substrate impedancesensing. Eur Respir J 2010; 35:894-903.
34.Hackett TL, Warner SM, Stefanowicz D, Shaheen F, Pechkovsky DV, Murray LA, Argentieri R, Kicic A, Stick SM, Bai TR, Knight DA. Induction of epithelial-mesenchymal transition in primary airway epithelial cells from patients with asthma by transforming growth factor-beta1. Am J Respir Crit Care Med 2009; 180:122-33.
35.de Boer WI, Sharma HS, Baelemans SM, Hoogsteden HC, Lambrecht BN, Braunstahl GJ. Altered expression of epithelial junctional proteins in atopic asthma: possible role in inflammation. Can J Physiol Pharmacol 2008; 86:105-12.
36.Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest 2009; 119:1420-8.
37.Sinha A, Mehta P, Fan C, Zhang J, Marvin DL, van Dinther M, Ritsma L, Boukany PE, Ten Dijke P. Visualizing Dynamic Changes During TGF-ß-Induced Epithelial to Mesenchymal Transition. Methods Mol Biol 2022; 2488:47-65.
38.Takai T, Ikeda S. Barrier dysfunction caused by environmental proteases in the pathogenesis of allergic diseases. Allergol Int 2011; 60:25-35.
39.Wan H, Winton HL, Soeller C, Taylor GW, Gruenert DC, Thompson PJ, Cannell MB, Stewart GA, Garrod DR, Robinson C. The transmembrane protein occludin of epithelial tight junctions is a functional target for serine peptidases from faecal pellets of Dermatophagoides pteronyssinus. Clin Exp Allergy 2001; 31:279-94.
40.Wan H, Winton HL, Soeller C, Tovey ER, Gruenert DC, Thompson PJ, Stewart GA, Taylor GW, Garrod DR, Cannell MB, Robinson C. Der p 1 facilitates transepithelial allergen delivery by disruption of tight junctions. J Clin Invest 1999; 104:123-33.
41.Rohde G, Message SD, Haas JJ, Kebadze T, Parker H, Laza-Stanca V, Khaitov MR, Kon OM, Stanciu LA, Mallia P, Edwards MR, Johnston SL. CXC chemokines and antimicrobial peptides in rhinovirus-induced experimental asthma exacerbations. Clin Exp Allergy 2014; 44:930-39.
42.Ravanetti L, Dijkhuis A, Dekker T, Sabogal Pineros YS, Ravi A, Dierdorp BS, Erjefält JS, Mori M, Pavlidis S, Adcock IM, Rao NL, Lutter R. IL-33 drives influenza-induced asthma exacerbations by halting innate and adaptive antiviral immunity. J Allergy Clin Immunol 2019; 143:1355-1370.e16.
43.Steelant B, Farré R, Wawrzyniak P, Belmans J, Dekimpe E, Vanheel H, Van Gerven L, Kortekaas Krohn I, Bullens DMA, Ceuppens JL, Akdis CA, Boeckxstaens G, Seys SF, Hellings PW. Impaired barrier function in patients with house dust mite-induced allergic rhinitis is accompanied by decreased occludin and zonula occludens-1 expression. J Allergy Clin Immunol 2016; 137:1043-1053.e5.
44.Sweerus K, Lachowicz-Scroggins M, Gordon E, LaFemina M, Huang X, Parikh M, Kanegai C, Fahy JV, Frank JA. Claudin-18 deficiency is associated with airway epithelial barrier dysfunction and asthma. J Allergy Clin Immunol 2017; 139:72-81.e1.
45.Winter MC, Shasby SS, Ries DR, Shasby DM. PAR2 activation interrupts E-cadherin adhesion and compromises the airway epithelial barrier: protective effect of beta-agonists. Am J Physiol Lung Cell Mol Physiol 2006; 291:L628-L635.
46.Wark PA, Johnston SL, Bucchieri F, Powell R, Puddicombe S, Laza-Stanca V, Holgate ST, Davies DE. Asthmatic bronchial epithelial cells have a deficient innate immune response to infection with rhinovirus. J Exp Med 2005; 201:937-47.
47.Heijink IH, Noordhoek JA, Timens W, van Oosterhout AJ, Postma DS. Abnormalities in airway epithelial junction formation in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2014; 189:1439-1442.
48.Holgate ST, Roberts G, Arshad HS, Howarth PH, Davies DE. The role of the airway epithelium and its interaction with environmental factors in asthma pathogenesis. Proc Am Thorac Soc 2009; 6:655-9.
49.Masaki T, Kojima T, Okabayashi T, Ogasawara N, Ohkuni T, Obata K, Takasawa A, Murata M, Tanaka S, Hirakawa S, Fuchimoto J, Ninomiya T, Fujii N, Tsutsumi H, Himi T, Sawada N. A nuclear factor-?B signaling pathway via protein kinase C d regulates replication of respiratory syncytial virus in polarized normal human nasal epithelial cells. Mol Biol Cell 2011; 22:2144-56.
50.Comstock AT, Ganesan S, Chattoraj A, Faris AN, Margolis BL, Hershenson MB, Sajjan US. Rhinovirus-induced barrier dysfunction in polarized airway epithelial cells is mediated by NADPH oxidase 1. J Virol 2011; 85:6795-808.
51.Looi K, Troy NM, Garratt LW, Iosifidis T, Bosco A, Buckley AG, Ling KM, Martinovich KM, Kicic-Starcevich E, Shaw NC, Sutanto EN, Zosky GR, Rigby PJ, Larcombe AN, Knight DA, Kicic A, Stick SM. Effect of human rhinovirus infection on airway epithelium tight junction protein disassembly and transepithelial permeability. Exp Lung Res 2016; 42:380-395.
52.Aghapour M, Raee P, Moghaddam SJ, Hiemstra PS, Heijink IH. Airway epithelial barrier dysfunction in chronic obstructive pulmonary disease: role of cigarette smoke exposure. Am J Respir Cell Mol Biol 2018; 58:157-169.
53.De Grove KC, Provoost S, Brusselle GG, Joos GF, Maes T. Insights in particulate matter-induced allergic airway inflammation: focus on the epithelium. Clin Exp Allergy 2018; 48:773-786.
54.Kim N, Han DH, Suh MW, Lee JH, Oh SH, Park MK. Effect of lipopolysaccharide on diesel exhaust particle-induced junctional dysfunction in primary human nasal epithelial cells. Environ Pollut 2019; 248:736-742.
55.Michaudel C, Mackowiak C, Maillet I, Fauconnier L, Akdis CA, Sokolowska M, Dreher A, Tan HT, Quesniaux VF, Ryffel B, Togbe D. Ozone exposure induces respiratory barrier biphasic injury and inflammation controlled by IL-33. J Allergy Clin Immunol 2018; 142:942-958.
56.Bousquet J, Chanez P, Lacoste JY, Berneon G, Ghavanian N, Enander I, Venge P, Ahlstedt S, Simony-Lafontaine J, Godard P, Michel FB. Eosinophilic inflammation in asthma. N Engl J Med 1990; 323:1033-39.
57.Beasley R, Roche WR, Roberts JA, Holgate ST. Cellular events in the bronchi in mild asthma and after bronchial provocation. Am Rev Respir Dis 1989; 139:806-17.
58.Jeffery PK, Wardlaw AJ, Nelson FC, Collins JV, Kay AB. Bronchial biopsies in asthma. An ultrastructural, quantitative study and correlation with hyperreactivity. Am Rev Respir Dis 1989; 140:1745-53.
59.Laitinen LA, Heino M, Laitinen A, Kava T, Haahtela T. Damage of the airway epithelium and bronchial reactivity in patients with asthma. Am Rev Respir Dis 1985; 131:599-606.
60.Barnes PJ. Asthma as an axon reflex. Lancet 1986; 1:242-5.
61.Raeburn D, Webber SE. Proinflammatory potential of the airway epithelium in bronchial asthma. Eur Respir J 1994; 7:2226-33.
62.Nadel JA, Borson DB. Modulation of neurogenic inflammation by neutral endopeptidase. Am Rev Respir Dis 1991; 143:S33-6.
63.Baraniuk JN, Ohkubo K, Kwon OJ, Mak J, Ali M, Davies R, Twort C, Kaliner M, Letarte M, Barnes PJ. Localization of neutral endopeptidase (NEP) mRNA in human bronchi. Eur Respir Dis 1995; 8:1458-64.
64.Henricks PA, Engels F, van der Vliet H, Nijkamp FP. 9- and 13-hydroxy-limoleic acid´possess chemotactic activity for bovine and human polymorphonuclear leukocytes. Prostaglandins 1991; 41:21-7.
65.Bagley DC, Russell T, Ortiz-Zapater E, Stinson S, Fox K, Redd PF, Joseph M, Deering-Rice C, Reilly C, Parsons M, Brightling C, Rosenblatt J. Bronchoconstriction damages airway epithelia by crowding-induced excess cell extrusion. Science 2024; 384:66-73.
66.Mitchell PD, O'Byrne PM. Epithelial-derived cytokines in asthma. Chest 2017; 151:1338–1344.
67.Porsbjerg CM, Sverrild A, Lloyd CM, et al. Anti-alarmins in asthma: targeting the airway epithelium with next-generation biologics. Eur Respir J 2020; 56:2000260 [https://doi.org/10.1183/ 13993003.00260-2020].
68.Xu M, Dong C. IL-25 in allergic inflammation. Immunol Rev 2017; 278:185–191.
69.Wang W, Li Y, Lv Z, Chen Y, Li Y, Huang K, Corrigan CJ, Ying S. Bronchial Allergen Challenge of Patients with Atopic Asthma Triggers an Alarmin (IL-33, TSLP, and IL-25) Response in the Airways Epithelium and Submucosa. J Immunol 2018; 201:2221-2231.
70.Wong CK, Cheung PF, Ip WK, Lam CW. Interleukin-25-induced chemokines and interleukin-6 release from eosinophils is mediated by p38 mitogen-activated protein kinase, c-Jun N-terminal kinase, and nuclear factor-kappaB. Am J Respir Cell Mol Biol 2005; 33:186-94.
71.Cheung PF, Wong CK, Ip WK, Lam CW. IL-25 regulates the expression of adhesion molecules on eosinophils: mechanism of eosinophilia in allergic inflammation. Allergy 2006; 6:878-85.
72.
Calvén J, Ax E, Rådinger M. The Airway Epithelium-A Central Player in Asthma Pathogenesis. Int J Mol Sci 2020; 21:8907.
73.Wang, YH, Liu, YJ. The IL-17 cytokine family and their role in allergic inflammation. Curr Opin Immunol 2008; 20:697–702.
74.Wang YH, Angkasekwinai P, Lu N, Voo KS, Arima K, Hanabuchi S, Hippe A, Corrigan CJ, Dong C, Homey B, Yao Z, Ying S, Huston DP, Liu YJ. IL-25 augments type 2 immune responses by enhancing the expansion and functions of TSLP-DC-activated Th2 memory cells. J Exp Med 2007; 204:1837-47.
75.Wang YH, Ito T, Wang YH, Homey B, Watanabe N, Martin R, Barnes CJ, McIntyre BW, Gilliet M, Kumar R, Yao Z, Liu YJ. Maintenance and polarization of human TH2 central memory T cells by thymic stromal lymphopoietin-activated dendritic cells. Immunity 2006; 24:827-838.
76.Corrigan CJ, Wang W, Meng Q, Fang C, Eid G, Caballero MR, Lv Z, An Y, Wang YH, Liu YJ, Kay AB, Lee TH, Ying S. Allergen-induced expression of IL-25 and IL-25 receptor in atopic asthmatic airways and late-phase cutaneous responses. J Allergy Clin Immunol 2011; 128:116-24.
77.
Corrigan CJ, Wang W, Meng Q, Fang C, Wu H, Reay V, Lv Z, Fan Y, An Y, Wang YH, Liu YJ, Lee TH, Ying S. T-helper cell type 2 (Th2) memory T cell-potentiating cytokine IL-25 has the potential to promote angiogenesis in asthma. Proc Natl Acad Sci U S A 2011; 108:1579-84.
78.Bianchetti L, Marini MA, Isgrò M, Bellini A., Schmidt M, Mattoli S. IL-33 promotes the migration and proliferation of circulating fibrocytes from patients with allergen-exacerbated asthma. Biochem Biophys Res Commun 2012; 426:116-121.
79.Li Y, Wang W, Lv Z., Li Y, Chen Y, Huang K, Corrigan CJ., Ying S Elevated Expression of IL-33 andTSLP in the Airways of Human Asthmatics In Vivo: A Potential Biomarker of Severe Refractory Disease J Immunol 2018; 200:2253-2262.
80.Whetstone CE, Ranjbar M, Omer H, Cusack RP, Gauvreau GM. The Role of Airway Epithelial Cell Alarmins in Asthma. Cells 2022; 11:1105. doi: 10.3390/cells11071105.
81.Kaur D, Gomez E, Doe C, Berair R, Woodman L, Saunders R, Hollins F, Rose FR, Amrani Y, May R, Kearley J, Humbles A, Cohen ES, Brightling CE. IL-33 drives airway hyper-responsiveness through IL-13-mediated mast cell: airway smooth muscle crosstalk. Allergy 2015; 70:556-67.
82.Préfontaine D, Nadigel J, Chouiali F, Audusseau S, Semlali A, Chakir J, Martin JG, Hamid Q. Increased IL-33 expression by epithelial cells in bronchial asthma. J Allergy Clin Immunol 2010; 125:752-4.
83.Al-Sajee D, Sehmi R, Hawke TJ, El-Gammal A, Howie KJ, Watson RM, Londei M, Gauvreau GM,O'Byrne PM. Expression of IL-33 and TSLP and Their Receptors in Asthmatic Airways after Inhaled Allergen Challenge. Am J Respir Crit Care Med 2018; 198:805-807.
84.Préfontaine D, Lajoie-Kadoch S, Foley S, Audusseau S, Olivenstein R, Halayko AJ, Lemière C, Martin JG, Hamid Q. Increased expression of IL-33 in severe asthma: evidence of expression by airway smooth muscle cells. J Immunol 2009; 183:5094-103.
85.Blom L, Poulsen BC, Jensen BM, Hansen A, Poulsen LK. IL-33 induces IL-9 production in human CD4+ T cells and basophils. PLoS One 2011; 6(7):e21695.
86.Schmitz J, Owyang A, Oldham E, Song Y, Murphy E, McClanahan TK, Zurawski G, Moshrefi M, Qin J, Li X, Gorman DM, Bazan JF, Kastelein RA. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines. Immunity 2005; 23:479-90.
87.Palmer G, Lipsky BP, Smithgall MD, Meininger D, Siu S, Talabot-Ayer D, Gabay C, Smith DE. The IL-1 receptor accessory protein (AcP) is required for IL-33 signaling and soluble AcP enhances the ability of soluble ST2 to inhibit IL-33. Cytokine 2008; 42:358-64.
88.Blom L, Poulsen LK. IL-1 family members IL-18 and IL-33 upregulate the inflammatory potential of differentiated human Th1 and Th2 cultures. J Immunol 2012; 189:4331-7.
89.Allakhverdi Z, Smith DE, Comeau MR, Delespesse G. Cutting edge: The ST2 ligand IL-33 potently activates and drives maturation of human mast cells. J Immunol 2007; 179:2051-4.
90.Rank MA, Kobayashi T, Kozaki H, Bartemes KR, Squillace DL, Kita H. IL-33-activated dendritic cells induce an atypical TH2-type response. J Allergy Clin Immunol 2009; 123:1047-54.
91.Besnard AG, Togbe D, Guillou N, Erard F, Quesniaux V, Ryffel B. IL-33-activated dendritic cells are critical for allergic airway inflammation. Eur J Immunol 2011; 41:1675-86.
92.Pecaric-Petkovic T, Didichenko SA, Kaempfer S, Spiegl N, Dahinden CA. Human basophils and eosinophils are the direct target leukocytes of the novel IL-1 family member IL-33. Blood 2009; 113:1526-34.
93.Barlow JL, Peel S, Fox J, Panova V, Hardman CS, Camelo A, Bucks C, Wu X, Kane CM, Neill DR, Flynn RJ, Sayers I, Hall IP, McKenzie AN. IL-33 is more potent than IL-25 in provoking IL-13-producing nuocytes (type 2 innate lymphoid cells) and airway contraction. J Allergy Clin Immunol 2013; 132:933-41.
94.Joulia R, L'Faqihi FE, Valitutti S, Espinosa E. IL-33 fine tunes mast cell degranulation and chemokine production at the single-cell level. J Allergy Clin Immunol 2017; 140:497-509.e10.
95.Soumelis V, Reche PA, Kanzler H, Yuan W, Edward G, Homey B, Gilliet M, Ho S, Antonenko S, Lauerma A, Smith K, Gorman D, Zurawski S, Abrams J, Menon S, McClanahan T, de Waal-Malefyt Rd R, Bazan F, Kastelein RA, Liu YJ. Human epithelial cells trigger dendritic cell mediated allergic inflammation by producing TSLP. Nat Immunol 2002; 3:673-80.
96.Ito T, Wang YH, Duramad O, Hori T, Delespesse GJ, Watanabe N, Qin FX, Yao Z, Cao W, Liu YJ. TSLP-activated dendritic cells induce an inflammatory T helper type 2 cell response through OX40 ligand. J Exp Med 2005; 202:1213-23.
97.Mitchell PD, Salter BM, Oliveria JP, El-Gammal A, Tworek D, Smith SG, Sehmi R, Gauvreau GM, O Apos Byrne PM. IL-33 and Its Receptor ST2 after Inhaled Allergen Challenge in Allergic Asthmatics. Int Arch Allergy Immunol 2018; 176:133-142.
98.Ying S, O'Connor B, Ratoff J, Meng Q, Mallett K, Cousins D, Robinson D, Zhang G, Zhao J, Lee TH, Corrigan C. Thymic stromal lymphopoietin expression is increased in asthmatic airways and correlates with expression of Th2-attracting chemokines and disease severity. J Immunol 2005; 174:8183-90.
99.Shikotra A, Choy DF, Ohri CM, Doran E, Butler C, Hargadon B, Shelley M, Abbas AR, Austin CD, Jackman J, Wu LC, Heaney LG, Arron JR, Bradding P. Increased expression of immunoreactive thymic stromal lymphopoietin in patients with severe asthma. J Allergy Clin Immunol 2012; 129:104-11.e1-9.
100.Ying S, O'Connor B, Ratoff J, Meng Q, Fang C, Cousins D, Zhang G, Gu S, Gao Z, Shamji B, Edwards MJ, Lee TH, Corrigan CJ. Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease. J Immunol 2008; 181:2790-8.
101.Kaur D, Doe C, Woodman L, Heidi Wan WY, Sutcliffe A, Hollins F, Brightling C. Mast cell-airway smooth muscle crosstalk: the role of thymic stromal lymphopoietin. Chest 2012; 142:76-85.
102.Allakhverdi Z, Comeau MR, Jessup HK, Yoon BR, Brewer A, Chartier S, Paquette N, Ziegler SF, Sarfati M, Delespesse G. Thymic stromal lymphopoietin is released by human epithelial cells in response to microbes, trauma, or inflammation and potently activates mast cells. J Exp Med . 2007; 204:253-8.
103.Watanabe N, Hanabuchi S, Soumelis V, Yuan W, Ho S, de Waal Malefyt R, Liu YJ. Human thymic stromal lymphopoietin promotes dendritic cell-mediated CD4+ T cell homeostatic expansion. Nat Immunol 2004; 5:426-34.
104.Han H, Headley MB, Xu W, Comeau MR, Zhou B, Ziegler SF. Thymic stromal lymphopoietin amplifies the differentiation of alternatively activated macrophages. J Immunol 2013; 190:904-12.
105.Pattarini L, Trichot C, Bogiatzi S, Grandclaudon M, Meller S, Keuylian Z, Durand M, Volpe E, Madonna S, Cavani A, Chiricozzi A, Romanelli M, Hori T, Hovnanian A, Homey B, Soumelis V. TSLP-activated dendritic cells induce human T follicular helper cell differentiation through OX40-ligand. J Exp Med 2017; 214:1529-1546.
106.Salter BM, Oliveria JP, Nusca G, Smith SG, Watson RM, Comeau M, Sehmi R, Gauvreau GM. Thymic stromal lymphopoietin activation of basophils in patients with allergic asthma is IL-3 dependent. J Allergy Clin Immunol 2015; 136:1636-1644.
107.Cook EB, Stahl JL, Schwantes EA, Fox KE, Mathur SK. IL-3 and TNFa increase Thymic Stromal Lymphopoietin Receptor (TSLPR) expression on eosinophils and enhance TSLP-stimulated degranulation. Clin Mol Allergy 2012; Jul 28;10(1):8.
108.Soumelis V, Reche PA, Kanzler H, Yuan W, Edward G, Homey B, Gilliet M, Ho S, Antonenko S, Lauerma A, Smith K, Gorman D, Zurawski S, Abrams J, Menon S, McClanahan T, de Waal-Malefyt Rd R, Bazan F, Kastelein RA, Liu YJ. Human epithelial cells trigger dendritic cell mediated allergic inflammation by producing TSLP. Nat Immunol 2002; 3:673-80.
109.Allakhverdi Z, Comeau MR, Jessup HK, Yoon BR, Brewer A, Chartier S, Paquette N, Ziegler SF, Sarfati M, Delespesse G. Thymic stromal lymphopoietin is released by human epithelial cells in response to microbes, trauma, or inflammation and potently activates mast cells. J Exp Med 2007; 204:253-8.
110.Salter BM, Oliveria JP, Nusca G, Smith SG, Watson RM, Comeau M, Sehmi R, Gauvreau GM. Thymic stromal lymphopoietin activation of basophils in patients with allergic asthma is IL-3 dependent. J Allergy Clin Immunol 2015; 136:1636-1644.
111.Miyata M, Hatsushika K, Ando T, Shimokawa N, Ohnuma Y, Katoh R, Suto H, Ogawa H, Masuyama K, Nakao A. Mast cell regulation of epithelial TSLP expression plays an important role in the development of allergic rhinitis. Eur J Immunol 2008; 38:1487-92.
112.White SR. – Epitelium as a Target. In : Peter J. Barnes, Grunstein MM, Leff AR and Woolcock AJ. Asthma. Philadelphia: Lippincott-Raven Publishers; 1997:875-899.
113.Empey DW, Laitinen LA, Jacobs L, GoldWH, Nadel JA. Mechanism of bronchial hyperreactivity in normal and asthmatic subjects after upper respiratory tract infection. Am Rev Respir Dis 1976; 113:131-9.
114.Alam R, York J, Boyars M, Stafford S, Grant JA, Lee J, Forsythe P, Sim T, Ida N. Increased MCP-1, RANTES, and MIP-1alpha in bronchoalveolar lavage fluid of allergic asthmatic patients. Am J Respir Crit Care Med 1996; 153(4 Pt 1):1398-404.
115.Berkman N, Krishnan VL, Gilbey T, Newton R, O'Connor B, Barnes PJ, Chung KF. Expression of RANTES mRNA and protein in airways of patients with mild asthma. Am J Respir Crit Care Med 1996; 154:1804-11.
116.Laberge S, Ernst P, Ghaffar O, Cruikshank WW, Kornfeld H, Center DM, Hamid Q. Increased expression of interleukin-16 in bronchial mucosa of subjects with atopic asthma. Am J Respir Cell Mol Biol 1997; 17:193-202.
117.Mattoli S, Marini M, Fasoli A. Expression of the potent inflammatory cytokines, GM-CSF, IL-6, and IL-8, in bronchial epithelial cells of asthmatic patients. Chest 1992; 101:27S-29S.
118.Taha RA, Minshall EM, Miotto D, Shimbara A, Luster A, Hogg JC, Hamid QA. Eotaxin and monocyte chemotactic protein-4 mRNA expression in small airways of asthmatic and nonasthmatic individuals. J Allergy Clin Immunol 1999; 103(3 Pt 1):476-83.
119.Gao W, Li L, Wang Y, Zhang S, Adcock IM, Barnes PJ, Huang M, Yao X: Bronchial epithelial cells: The key effector cells in the pathogenesis of chronic obstructive pulmonary disease? Respirology 2015; 20:722–729.
120.Erle DJ, Sheppard D: The cell biology of asthma. J Cell Biol 2014; 205:621–631.
121.Guerreiro R, Santos-Costa Q, Azevedo-Pereira JM: The chemokines and their receptors: Characteristics and physiological functions. Acta Medica Portuguesa 2011; 24 Suppl 4:S967–S976.
122.Smit JJ, Lukacs NW: A closer look at chemokines and their role in asthmatic responses. Eur J Pharmacol 2006; 533:277–288.
123.Renois F, Jacques J, Talmud D, Deslée G, Lévêque N, Andréoletti L: Respiratory echovirus 30 and coxsackievirus B5 can induce production of RANTES, MCP-1 and IL-8 by human bronchial epithelial cells. Virus Res 2010; 152:41–49.
124.Marini M, Vittori E, Hollemborg J, Mattoli S. Expression of the potent inflammatory cytokines, granulocyte-macrophage colony-stimulating factor and interleukin-6 and interleukin-8 in bronchial epithelial cells of patients with asthma. J Allergy Clin Immunol 1992; 89:1001-09.
125.Wang JH, Trigg CJ, Devalia JL, Jordan S, Davies RJ. Effect of inhaled beclomethasone dipropionate on expression of proinflammatory cytokines and activated eosinophils in the bronchial epithelium of patients with mild asthma. J Allergy Clin Immunol 1994; 94:1025-34.
126.Larsen CG, Anderson AO, Appella E, Oppenheim JJ, Matsushima K. The neutrophil activating protein (NAP-1) is also chemotactic for T lymphocytes. Science 1989; 243:1464-6.
127.Taub DD, Anver M, Oppenheim JJ, Longo DL, Murphy WJ. T lymphocyte recruitment by interleukin-8 (IL-8): IL-8-induced degranulation pf neutrophils releases potent chemoattractants for human T lymphocytes both in vitro and in vivo. J Clin Invest 1996; 97:1931-41.
128.Warringa RA, Koenderman L, Kok PT, Kreukniet J, Bruijnzeel PL. Modulation and induction of eosinophil chemotaxis by granulocyte-macrophage colony-stimulating factor and interleukin-3. Blood 1991; 77(12):2694-700.
129.Lopez AF, Williamson DJ, Gamble JR, Begley CG, Harlan JM, Klebanoff SJ, Waltersdorph A, Wong G, Clark SC, Vadas MA. Recombinant human granulocyte-macrophage colony-stimulating factor stimulates in vitro mature human neutrophil and eosinophil function, surface receptor expression, and survival. J Clin Invest 1986; 78:1220-8.
130.Ruef C, Coleman DL. Granulocyte-macrophage colony-stimulating factor: pleiotropic cytokine with potential clinical usefulness. Rev Infect Dis 1990; 12:41-62.
131.Mattoli S, Mattoso VL, Soloperto M, Allegra L, Fasoli A. Cellular and biochemical characteristics of bronchoalveolar lavage fluid in symptomatic nonallergic asthma. J Allergy Clin Immunol 1991; 87:794-802.
132.Marini M, Soloperto M, Zheng Y, Mezzetti M, Mattoli S. Protective effect of nedocromil sodium on the IL-1-induced release of GM-CSF from cultured human bronchial epithelial cells. Pulm Pharmacol 1992; 5:61-5.
133.Rot A, Krieger M, Brunner T, Bischoff SC, Schall TJ, Dahinden CA. RANTES and macrophage inflammatory protein 1a induce the migration and activation of normal human eosinophil granulocytes. J Exp Med 1992; 176:1489-95.
134.Meurer R, Van Riper G, Feeney W, Cunningham P, Hora D Jr, Springer MS, MacIntyre DE, Rosen H. Formation of eosinophilic and monocytic intradermal inflammatory sites in the dog by injection of human RANTES but not human monocyte chemoattractant protein 1, human macrophage inflammatory protein 1 alpha, or human interleukin 8. J Exp Med 1993; 178:1913-21.
135.Lambrecht BN, Hammad H, Fahy JV. The Cytokines of Asthma. Immunity 2019; 50:975-991.
136.Goswami R, Kaplan MH. A brief history of IL-9. J Immunol 2011; 186:3283-8.
137.Klose CSN, Artis D. Innate lymphoid cells control signaling circuits to regulate tissue-specific immunity. Cell Res 2020; 30:475-491.
138.Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. Innate lymphoid cells: 10 years on. Cell 2018 23;174:1054-1066.
139.Gon Y, Hashimoto S. Role of airway epithelial barrier dysfunction in pathogenesis of asthma. Allergol Int 2018; 67:12-17.
140.Halim TY, Steer CA, Mathä L, Gold MJ, Martinez-Gonzalez I, McNagny KM, McKenzie AN, Takei F. Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation. Immunity 2014; 40:425-35.
141.Frey A, Lunding LP, Ehlers JC, Weckmann M, Zissler UM, Wegmann M. More Than Just a Barrier: The Immune Functions of the Airway Epithelium in Asthma Pathogenesis. Front Immunol 2020; 11:761.
142.Takahashi K, Meguro K, Kawashima H, Kashiwakuma D, Kagami SI, Ohta S, Ono J, Izuhara K, Iwamoto I. Serum periostin levels serve as a biomarker for both eosinophilic airway inflammation and fixed airflow limitation in well-controlled asthmatics. J Asthma 2019; 56:236-243.
143.Lambrecht BN, Hammad H. Biology of lung dendritic cells at the origin of asthma. Immunity 2009; 31:412-24.
144.Lambrecht BN. Allergen uptake and presentation by dendritic cells. Curr Opin Allergy Clin Immunol 2001; 1:51-9.
145.Hammad H, Lambrecht BN. The basic immunology of asthma. Cell 2021; 184:1469-1485.
146.Campbell AM, Vignola AM, Chanez P, Godard P, Bousquet J. Low-affinity receptor for IgE on human bronchial epithelial cells in asthma. Immunology 1994; 82:506-8.
147.Campbell AM, Vachier I, Chanez P, et al.“Expression of the High-Affinity Receptor for IgE on Bronchial Epithelial Cells of Asthmatics.” Am J Respir Cell Mol Biol 1998; 19:92–97.
148.Humbert M, Grant JA, Taborda-Barata L, et al.“High-Affinity IgE Receptor (FcepsilonRI)-bearing Cells in Bronchial Biopsies From Atopic and Nonatopic Asthma,” Am J Respir Crit Care Med 1996; 153:1931–1937.
149.Aegerter H, Lambrecht BN. The Pathology of Asthma: What Is Obstructing Our View? Annu Rev Pathol 2023; 18:387–409.
150.Forstner G. Signal transduction, packaging and secretion of mucins. Annu Rev Physiol 1995; 57:585-605.
151.Thornton DJ, Rousseau K, McGuckin MA. Structure and function of the polymeric mucins in airways mucus. Annu Rev Physiol 2008; 70:459-86.
152.Thornton DJ, Rousseau K, McGuckin MA. Structure and function of the polymeric mucins in airways mucus. Annu Rev Physiol 2008; 70:459–86
153.Fahy JV, Dickey BF. Airway mucus function and dysfunction. N Engl J Med 2010; 363:2233–2247.
154.Audie JP, Janin A, Porchet N, Copin MC, Gosselin B, Aubert JP. Expression of human mucin genes in respiratory, digestive, and reprucdutive tracts ascertained by in situ hybridization. J Histochem Cytochem 1993; 41:1479-85.
155.Reid CJ, Gould S, Harris A. Developmental exprssion of mucin genes in thw human respiratory tract. Am J Respir Cell Mol Biol 1997; 17:592-98.
156.Bonser LR, Erle DJ. The airway epithelium in asthma. Adv Immunol 2019; 142:1-34.
157.Bonser LR , Zlock L, Finkbeiner W, Erle DJ. Epithelial tethering of MUC5AC-rich mucus impairs mucociliary transport in asthma. J. Clin. Investig 2016; 126:2367–71.
158.Hilding AC. The relation of ciliary insufficiency to death from asthma and other respiratory diseases. Ann Otol Rhinol Laryngol 1943; 52:5–19.
159.Thomas B, Rutman A, Hirst RA, Haldar P, Wardlaw AJ, Bankart J, Brightling CE, O'Callaghan C. Ciliary dysfunction and ultrastructural abnormalities are features of severe asthma. Journal of Allergy and Clinical Immunology 2010; 126:722–9.
160.Laitinen LA, Heino M, Laitinen A, Kava T, Haahtela T. Damage of the airway epithelium and bronchial reactivity in patients with asthma. Am Rev Respir Dis 1985; 131:599–606.
161.Fahy JV, Dickey BF. Airway mucus function and dysfunction. N Engl J Med 2010; 363:2233-47.
162.Kirkham S, Sheehan JK, Knight D, Richardson PS, Thornton DJ. Heterogeneity of airways mucus: Variations in the amounts and glycoforms of the major oligomeric mucins MUC5AC and MUC5B. Biochem J 2002; 361:537–546.
163.Lachowicz-Scroggins ME, Yuan S, Kerr SC, Dunican EM, Yu M, Carrington SD, Fahy JV. Abnormalities in MUC5AC and MUC5B Protein in Airway Mucus in Asthma. Am J Respir Crit Care Med 2016; 194:1296–1299.
164.Shrine N, Portelli MA, John C, Soler Artigas M, Bennett N, Hall R, Lewis J, Henry AP, Billington CK, Ahmad A, Packer RJ, Shaw D, Pogson ZEK, Fogarty A, McKeever TM, Singapuri A, Heaney LG, Mansur AH, Chaudhuri R, Thomson NC, Holloway JW, Lockett GA, Howarth PH, Djukanovic R, Hankinson J, Niven R, Simpson A, Chung KF, Sterk PJ, Blakey JD, Adcock IM, Hu S, Guo Y, Obeidat M, Sin DD, van den Berge M, Nickle DC, Bossé Y, Tobin MD, Hall IP, Brightling CE, Wain LV, Sayers I. Moderate-to-severe asthma in individuals of European ancestry: a genome-wide association study. Lancet Respir Med 2019; 7:20-34.
165.Knight DA, Lim S, Scaffidi AK et al. Protease-activated receptors in human airways: upregulation of PAR-2in respiratory epithelium from patients with asthma. J Allergy Clin Immunol 2001; 108:797-803.
166.Godard PH, Chanez P. Epithelium et asthme.(online) Disponível na internet via www. URL: http://www.remcomp.fr/asmanet/epithelium-asthme.html
|