|
Asma
TIPOS DE ASMA
ASMA NOTURNA
Muitos pacientes com asma apresentam exacerbação intermitente da doença durante a noite (asma relacionada ao sono). Acordam entre 3 e 4 h da manhã — (Figura 1),1 com sibilância, dispneia e tosse, que muitas vezes pode ser o único sintoma. Os sintomas noturnos contribuem para a privação do sono, sonolência diurna, fadiga e irritabilidade.
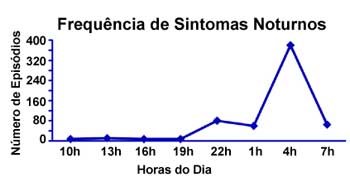 Muitos são os fatores que podem explicar a asma noturna, porém acordar à noite devido à asma significa doença malcontrolada. Asmáticos estáveis durante o dia pioram à noite. Turner-Warwick2,3 estudou cerca de 7.729 pacientes ambulatoriais e constatou que 94% acordavam pelo menos uma noite por mês, 74% tinham sintomas de asma noturna, acordando-os pelo menos uma vez por semana, enquanto que 39% acordavam toda noite. Até 80% das exacerbações fatais de asma em pacientes hospitalizados ocorrem durante a noite/ao amanhecer.4,5 Dados mais recentes do Estado de Victória — Austrália, indicam que cerca de 53% dos óbitos em asmáticos ocorreram no período noturno.6 Muitos são os fatores que podem explicar a asma noturna, porém acordar à noite devido à asma significa doença malcontrolada. Asmáticos estáveis durante o dia pioram à noite. Turner-Warwick2,3 estudou cerca de 7.729 pacientes ambulatoriais e constatou que 94% acordavam pelo menos uma noite por mês, 74% tinham sintomas de asma noturna, acordando-os pelo menos uma vez por semana, enquanto que 39% acordavam toda noite. Até 80% das exacerbações fatais de asma em pacientes hospitalizados ocorrem durante a noite/ao amanhecer.4,5 Dados mais recentes do Estado de Victória — Austrália, indicam que cerca de 53% dos óbitos em asmáticos ocorreram no período noturno.6
A cronobiologia é definida como uma ciência que quantifica e investiga mecanismos de estruturas temporais biológicas e a inclusão do tempo como um fator primordial nas investigações biológicas. Do ponto de vista cronobiológico, as condições fisiológicas e comportamentais de um organismo vivo mudam à medida que o tempo passa, percorrendo assim uma sequência de estados que se repete periodicamente. Inclui o estudo dos ritmos biológicos como, por exemplo, as oscilações periódicas em variáveis biológicas e seus mecanismos.7 Cada ritmo biológico tem a sua periodicidade. O ritmo circadiano [Do lat. circa diem, 'em torno do dia'.] tem a periodicidade de cerca de 24±4 horas, e é por demais conhecida a sua influência em inúmeros eventos fisiológicos e em várias doenças (cronopatologia), incluindo-se os aspectos temporais da asma e a sua cronoterapêutica.
O papel do transtorno circadiano na fisiopatologia da asma é complexo.8 Os ritmos de 24 h em fisiologia e comportamento9 são orquestrados – pelo marca-passo central no núcleo supraquiasmático do hipotálamo e por osciladores circadianos na maioria dos órgãos e tecidos do corpo, compondo o sistema circadiano. Este sistema de sincronização endógeno pode influenciar o sistema pulmonar e inflamatório por meio do sistema nervoso autônomo,10 fatores humorais11 e / ou relógios moleculares locais.12,13
Scheer et al.14 detectaram influências aditivas do sistema circadiano na asma, independentemente do sono e outros efeitos comportamentais ou ambientais. Indivíduos com a função pulmonar mais comprometida tendem a ter as maiores variações circadianas diárias e os maiores efeitos do ciclo comportamental na asma.
Do ponto de vista fisiológico, a caracterização da funcionalidade de um relógio biológico precisa muitas vezes ser inferida. Troyanov et al.15 constataram que o VEF1 e o PFE são igualmente preditivos do calibre das vias aéreas em um grupo heterogêneo de indivíduos normais e indivíduos com asma. Sabe-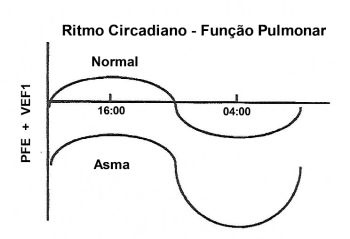 se, por exemplo, que a análise funcional pulmonar, mesmo em não asmáticos, apresenta melhores resultados por volta das 16 h. Em contrapartida, verificam-se os piores valores entre 3 e 4 h da manhã.7 (Figura 2) Na asma noturna, a responsividade brônquica está aumentada cerca de oito vezes, enquanto que em pacientes sem sintomas noturnos, somente duas vezes. Da mesma forma, a resistência das vias aéreas eleva-se progressivamente a partir de meia-noite até as primeiras horas da manhã. Os valores mais baixos do PFE, tanto em asmáticos como em normais, ocorrem nas primeiras horas da manhã. Os asmáticos apresentam valores mais baixos que os normais, indicando broncoconstrição. Clark e Hetzel16 demonstraram que a variabilidade na função pulmonar existe tanto em asmáticos como em não asmáticos. Todavia, a amplitude da variação é muito maior em pacientes com asma, devido à grande queda que ocorre no PFE às 4 h da manhã. Encontraram, em média, uma variabilidade diurna de 8% em indivíduos sem a doença e de 51% em asmáticos. se, por exemplo, que a análise funcional pulmonar, mesmo em não asmáticos, apresenta melhores resultados por volta das 16 h. Em contrapartida, verificam-se os piores valores entre 3 e 4 h da manhã.7 (Figura 2) Na asma noturna, a responsividade brônquica está aumentada cerca de oito vezes, enquanto que em pacientes sem sintomas noturnos, somente duas vezes. Da mesma forma, a resistência das vias aéreas eleva-se progressivamente a partir de meia-noite até as primeiras horas da manhã. Os valores mais baixos do PFE, tanto em asmáticos como em normais, ocorrem nas primeiras horas da manhã. Os asmáticos apresentam valores mais baixos que os normais, indicando broncoconstrição. Clark e Hetzel16 demonstraram que a variabilidade na função pulmonar existe tanto em asmáticos como em não asmáticos. Todavia, a amplitude da variação é muito maior em pacientes com asma, devido à grande queda que ocorre no PFE às 4 h da manhã. Encontraram, em média, uma variabilidade diurna de 8% em indivíduos sem a doença e de 51% em asmáticos.
Indivíduos saudáveis exibem variabilidade na avaliação funcional pulmonar ao longo de um período de 24 horas, mas em pacientes com asma esta resposta pode ser bem mais pronunciada.8,17,18 Por exemplo, uma variação circadiana média em VEF1 de 70mL está presente em indivíduos saudáveis, independente do ambiente e postura,17 mas em pacientes com asma persistente esse valor pode ser mais do que duplicado.19
Uma série de estudos tem demonstrado consistentemente maior inflamação e obstrução das vias aéreas às 4 h.15,20-24 Em pacientes com asma, o PFE e o VEF1 estão reduzidos à noite, quando se constata maior inflamação nas vias aéreas, em comparação ao período diurno.20,21,23
A responsividade brônquica não específica também aumenta à noite.25,26 Alguns estudos demonstraram que a responsividade à metacolina e histamina é maior durante a madrugada do que durante o período diurno.26,27 O aumento na responsividade pode ser tão severo que mesmo a inalação da solução salina utilizada como diluente pode determinar queda > 20% nos parâmetros de função pulmonar, quando a provocação é efetuada à noite.20
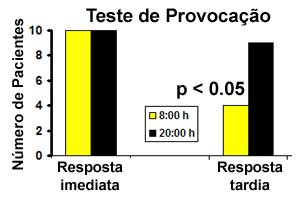 Mohiuddin e Martin25 avaliaram a resposta tardia da asma em dez pacientes após provocação alergênica às 8 h e 20 h, respectivamente. O teste de provocação efetuado durante a manhã determinou resposta tardia em 4 dos 10 pacientes. O mesmo teste às 20 h causou resposta tardia em 9 dos 10 pacientes, com diferença estatisticamente significativa (p<0,05) (Figura 2). O tempo decorrido entre a provocação e o início da resposta tardia foi de 9,4 ± 2,0 h no teste efetuado pela manhã, contra 3,1 ± 0,3 h à noite. A maior queda do VEF1 foi de 32,8 ± 5,6% pela manhã e 43,0 ± 3,1% à noite (p<0,05). Mohiuddin e Martin25 avaliaram a resposta tardia da asma em dez pacientes após provocação alergênica às 8 h e 20 h, respectivamente. O teste de provocação efetuado durante a manhã determinou resposta tardia em 4 dos 10 pacientes. O mesmo teste às 20 h causou resposta tardia em 9 dos 10 pacientes, com diferença estatisticamente significativa (p<0,05) (Figura 2). O tempo decorrido entre a provocação e o início da resposta tardia foi de 9,4 ± 2,0 h no teste efetuado pela manhã, contra 3,1 ± 0,3 h à noite. A maior queda do VEF1 foi de 32,8 ± 5,6% pela manhã e 43,0 ± 3,1% à noite (p<0,05).
Martin et al.22 analisaram a citologia do BAL obtido por broncofibroscopia em sete pacientes com asma noturna e compararam com o BAL de sete pacientes asmáticos sem sintomas noturnos. A contagem global de leucócitos não apresentava diferenças significativas às 16 h em ambos os grupos. Entretanto, às 4 h da manhã, importante alteração circadiana era evidenciada naqueles com asma noturna, com aumento no número total de leucócitos (24,0 ± 7,0 para 41,1 ± 9,9 x 104 células/ml – p<0,05) , de neutrófilos (1,1 ± 0,6 para 3,7 ± 1,5 x 104 células/ml – p<0,05), de eosinófilos (0,5 ± 0,1 para 1,7 ± 0,7 x 104 células/ml – p<0,05), de linfócitos (7,0 ± 2,0 para 10,8 ± x 104 células/ml) e de células epiteliais. Em todos os pacientes com asma noturna ocorreu queda do PFE, que se correlacionava com as mudanças nas contagens de neutrófilos (r = 0,54 – p<0,05), e de eosinófilos (r = 0,77 – p<0,05). Os autores concluíram que os pacientes com asma noturna apresentam uma resposta inflamatória celular intensa durante a noite, que não é vista em outros asmáticos sem sintomas noturnos.
Biópsias transbrônquicas em pacientes com asma noturna evidenciavam quatro vezes mais eosinófilos no tecido alveolar às 4 h em comparação com 16 h. Além de eosinófilos havia macrófagos que se acumulavam do mesmo modo em maior extensão no tecido alveolar.23
Kraft et al.29 demonstraram que indivíduos com asma noturna apresentam aumento significante no número de eosinófilos e linfócitos CD4+ (9,8 células/mm3 v. 1,5 células/mm3) às 4 h da manhã. Estes achados não foram evidenciados em pacientes com asma não noturna. O número de células CD4+ no tecido alveolar se correlacionava negativamente com o percentual teórico previsto para o VEF1 às 4 h e positivamente com o número de eosinófilos no tecido alveolar. Estes resultados sugerem que a elevação do número de CD4+ nos alvéolos à noite pode contribuir para o recrutamento e ativação de eosinófilos, conduzindo à piora noturna da função pulmonar.
Associada à redução circadiana do calibre brônquico, ocorre a participação do sono, aumentando ainda mais a resistência das vias aéreas (Rva), com piora adicional da função pulmonar. Ballard et al.30 mediram a Rva em pacientes com asma noturna, de meia-noite às 6 h, durante uma noite, quando os pacientes eram mantidos acordados, e em outra noite quando dormiam. Em ambas as ocasiões, a Rva encontrava-se aumentada; todavia, o aumento era duas vezes maior quando os pacientes dormiam durante o exame. Em outra publicação Ballard et al.25 estudaram as mudanças dos volumes pulmonares durante o sono em pessoas com e sem asma. Seus resultados evidenciaram uma redução na capacidade residual funcional (CRF de 20% em normais e 41% em asmáticos, quando comparados aos valores medidos na posição supina em acordados. Postularam que esta queda nos volumes pulmonares durante o sono poderia ser fator de importância no desencadeamento da broncoconstrição noturna. Sabe-se que durante o sono ocorre inibição na atividade tônica da musculatura inspiratória,31 sendo que os músculos intercostais inspiratórios são mais afetados que os diafragmas. Esta redução é mais importante na fase REM do que na NREM. A inibição da atividade tônica inspiratória pode explicar em parte a redução do volume pulmonar durante o sono.32
Outros fatores patogênicos ligados a exacerbações noturnas da asma podem ser relacionados:
| ❑ |
o cortisol que tem ação anti-inflamatória brônquica, tem seu pico plasmático de manhã, com níveis baixos no período noturno;11 |
| ❑ |
a adrenalina que relaxa a musculatura brônquica e inibe a liberação de histamina, tem seu pico de ação às 16 h com menor nível plasmático às 4 h da manhã;11 |
| ❑ |
a variação circadiana na função dos receptores adrenérgicos, com downregulation dos ß2 -receptores à noite em pacientes com asma noturna;33 |
| ❑ |
o pico da histamina circulante às 4 h da manhã,11 correspondendo ao dobro do valor obtido às 16 h (não observado em não asmáticos); |
| ❑ |
a eosinofilia das vias aéreas também demonstra capacidade de variação diurna;21-23,34 |
| ❑ |
a contagem de eosinófilos no lavado broncoalveolar às 4 h é duas vezes maior do que às 16 h em pacientes com asma;34,35 |
| ❑ |
os níveis significativamente maiores do LTE4 urinário à noite em pacientes com asma noturna, quando comparados aos níveis diurnos, são significativamente maiores em pacientes com asma noturna, quando comparados a pacientes sem asma noturna, ou com normais;35 |
| ❑ |
a hipertonia vagal noturna determinando aumento do tônus brônquico;36,37 |
| ❑ |
o aumento de superóxido, neutrófilos, linfócitos e eosinófilos no lavado broncoalveolar às 4 h da manhã,28,38 correlacionando-se com a queda do VEF1 no mesmo horário; |
| ❑ |
os linfócitos e neutrófilos demonstram redução de 33% no número de receptores ß-adrenérgicos às 4 h, apresentando resposta alterada à infusão de isoproterenol, quando comparada à resposta das mesmas células obtidas por BAL às 16 h;33 |
| ❑ |
a elevação importante da adenosina monofosfato cíclica (AMPc) às 4 h, com ciclo circadiano semelhante ao da adrenalina;11 |
| ❑ |
a redução da temperatura corporal durante a noite, com consequente vasoconstrição e subsequente resfriamento da mucosa das vias aéreas, determinando broncospasmo;39,40 |
| ❑ |
o contato prolongado com alérgenos do ácaro da poeira doméstica encontrados no leito do paciente; |
| ❑ |
o contato diurno com alérgenos que não provocam resposta imediata, porém determinam resposta tardia. |
No que concerne à genética, existem evidências que correlacionam a variante Gly-16 com o fenótipo da asma noturna. Nove polimorfismos do gene de receptor-ß2 foram descritos, dos quais dois são mais frequentes, determinando mudanças de aminoácidos na suposta região extracelular N-terminal do gene: ß2 AR-16 com substituição da arginina (Arg-16) pela glicina (Gly-16) e ß2 AR-27 com substituição da glutamina (Gln-27) pelo ácido glutâmico (Glu-27). A variante Gly-16 está associada à asma grave, sendo também mais frequente nos pacientes que apresentam asma noturna.41 A frequência do alelo Gly-16 é de 80% em pacientes com asma noturna quando comparado com 52% em pacientes com asma sem componente noturno.41 Tanto o número como a função dos receptores-ß2 estão significativamente reduzidos em pacientes com asma noturna, no período de 16 h às 4 h, quando comparados a asmáticos sem asma noturna e a indivíduos normais.33
Certos autores atribuem, ao decúbito supino e consequente congestão pulmonar, uma participação no agravamento noturno da asma. Fisiologicamente mesmo durante o período diurno, certos parâmetros da ventilação modificam-se na posição supina, ocorrendo redução da complacência pulmonar, aumento da resistência das vias aéreas e aumento do volume de reserva expiratório.42 Os volumes expiratórios forçados tendem a diminuir após a posição supina. Assim, a posição supina pode induzir à obstrução do fluxo de ar em asmáticos, e a postura pode ser um fator importante para a asma noturna.43
Normalmente no ciclo circadiano ocorre uma queda da temperatura corporal durante a noite, com um concomitante resfriamento das vias aéreas, que tem sido questionado como uma causa potencial da asma noturna.34,35 Como a temperatura corporal cai aproximadamente 1ºC durante o sono,44 Chen e Chai45 investigaram este potencial mecanismo de broncospasmo noturno, demonstrando que o ar administrado por máscara facial a 37ºC e 100% de umidade relativa não prevenia o broncospasmo, porém reduzia-o quando comparado à respiração do ar ambiente. O conjunto de resultados sugere que o resfriamento das vias aéreas que ocorre como consequência do resfriamento corporal, desempenha um papel significativo no desencadeamento da asma noturna.
Indivíduos com a combinação de asma e doença do refluxo gastresofágico (DRGE) apresentam maior prevalência de tosse noturna, sintomas relacionados ao sono e maior variabilidade do PFE do que indivíduos com asma isoladamente. Gislason et al.46revisaram uma população de 2.661 indivíduos de três países (Islândia, Bélgica e Suécia) a fim de estimar a possível associação entre sintomas de DRGE após a hora de dormir, distúrbios do sono e respiração e sono e sintomas respiratórios e asma. A asma foi relatada em 9% dos indivíduos com DRGE em comparação com 4% daqueles que não relataram DRGE (p<0,05). Além disso, a DRGE relacionada ao sono foi associada a sibilos [OR] 2,5 - (IC 95% 1,6-3,9), aperto no peito relacionado ao sono [OR] 2,3 – (IC 95% 1,4-3,8), tosse durante o sono – tempo [OR] 3,0, (IC 95% 1,9-4,9) e diagnóstico de asma [OR 2,2] (IC 95% 1,0-4,7).
A asma e a síndrome da apneia obstrutiva do sono (SAOS) podem coexistir. De acordo com análise publicada pelo Scientific Reports47 a prevalência SAOS em pacientes adultos com asma foi estimada em 50%. A pesquisa bibliográfica foi efetuada em banco de dados eletrônicos e metanálise, sendo a chance de SAOS 2,64 vezes maior em pacientes com asma do que em pacientes sem asma. A prevalência de risco para SAOS e respiração desordenada do sono (SDB) foi de 27,5% e 20%, respectivamente. As chances de ter risco para SAOS e SDB são de 3,73 e 1,73 vezes maiores (respectivamente) em pacientes com asma do que em pacientes sem asma. Pacientes com asma com SAOS também tiveram um IMC significativamente maior em comparação com pacientes sem asma.
A SAOS é extremamente comum na asma grave, com uma prevalência de até 80% na polissonografia.48 Existem alguns dados que sugerem um aumento da inflamação sistêmica na apneia do sono, fornecendo mecanismos de feedback pelos quais a gravidade da asma possa estar aumentada.49
O tratamento destes pacientes com CPAP (Continuous Positive Airway Pressure) propiciou uma melhor qualidade do sono e consequente condição de vida, no controle da doença, particularmente, com a redução das exacerbações noturnas da asma, reduzindo-se o número de casos considerados de difícil controle.50-52 O PFE medido tanto às 4 h como às 16 h obteve melhora significativa com a CPAP. Não existem relatos, entretanto, de melhora com a CPAP de pacientes com asma sem apneia do sono.53
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
Referências
01.Dethlefsen U, Repgas R. Ein neues therapieprinzip bei nechtlichen asthma. Klin Med 1985; 80:44-47.
02.Turner-Warwick M. Epidemiology of nocturnal asthma. Am J Med 1988; (suppl 1B):6-8.
03.Turner-Warwick M. Nocturnal asthma: a study in general practice. J R Coll Gen Pract 1989; 39:239-43.
04.Hetzel MR, Clark TJ, Branthwaite MA. Asthma: analysis of sudden deaths and ventilatory arrests in hospital. Br Med J 1977; 1:808-11.
05.Cochrane GM, Clark JH. A survey of asthma mortality in patients between ages 35 and 64 in the greater London hospitals in 1971. Thorax 1975; 30:300-05.
06.Robertson CE, Rubinfeld AR, Bowej G. Deaths from asthma in Victoria: A 12-month study. Med J Aust 1990; 152:511-517.
07.Pincus DJ, Beam WR, Martin RJ. Chronobiology and chronotherapy of asthma. Clin Chest Med 1995; 16:699-713.
08.Wang R, Murray CS, Fowler SJ, Simpson A, Durrington HJ. Asthma diagnosis. into the fourth dimension. Thorax 2021; 76:624-631.
09.Kalsbeek A, Palm IF, La Fleur SE, Scheer FA, Perreau-Lenz S, Ruiter M, Kreier F, Cailotto C, Buijs RM. SCN outputs and the hypothalamic balance of life. J Biol Rhythms 2006;21: 458-69.
10.Lewis MJ, Short AL, Lewis KE. Autonomic nervous system control of the cardiovascular and respiratory systems in asthma. Respir Med 2006; 100:1688-705.
11.Barnes P, FitzGerald G, Brown M, Dollery C. Nocturnal asthma and changes in circulating epinephrine, histamine, and cortisol. N Engl J Med 1980; 31; 303:263-7.
12.Gibbs JE, Beesley S, Plumb J, Singh D, Farrow S, Ray DW, Loudon AS. Circadian timing in the lung; a specific role for bronchiolar epithelial cells. Endocrinology 2009; 150:268-76.
13.Durrington HJ, Farrow SN, Loudon AS, Ray DW. The circadian clock and asthma. Thorax 2014; 69:90-2.
14.Scheer FAJL, Hilton MF, Evoniuk HL, Shiels SA, Malhotra A, Sugarbaker R, Ayers RT, Israel E, Massaro AF, Shea SA. The endogenous circadian system worsens asthma at night independent of sleep and other daily behavioral or environmental cycles. Proc Natl Acad Sci U S A 2021 Sep 14;118(37):e2018486118. doi: 10.1073/pnas.2018486118. PMID: 34493686; PMCID: PMC8449316.
15.Troyanov S, Ghezzo H, Cartier A, Malo JL.Comparison of circadian variations using FEV1 and peak expiratory flow rates among normal and asthmatic subjects. Thorax 1994; 49:775-780.
16.Clark TJ, Hetzel MR. Diurnal variation of asthma. Br J Dis Chest 1977; 71:87-92.
17.
Spengler CM, Shea SA. Endogenous circadian rhythm of pulmonary function in healthy humans. Am J Respir Crit Care Med 2000; 162:1038-46.
18.Reddel H, Jenkins C, Woolcock A. Diurnal variability--time to change asthma guidelines? BMJ 1999; 319:45-7.
19.Zhou D, Li H, Wang Y, et al. Quantitative characterization of circadian rhythm of pulmonary function in asthmatic patients treated with inhaled corticosteroids. J Pharmacokinet Pharmacodyn 2015; 42:391-9.
20.Martin RJ, Cicutto LC, Ballard RD. Factors related to the nocturnal worsening of asthma. Am Rev Respir Dis 1990; 141:33-8.
21.Durrington HJ, Gioan-Tavernier GO, Maidstone RJ, Krakowiak K, Loudon ASI, Blaikley JF, Fowler SJ, Singh D, Simpson A, Ray DW.
Time of day affects eosinophil biomarkers in asthma: implications for diagnosis and treatment. Am J Respir Crit Care Med 2018; 198:1578-81.
22.Martin RJ, Cicutto LC, Smith HR, Ballard RD, Szefler SJ.
Airways inflammation in nocturnal asthma. Am Rev Respir Dis 1991; 143:351-7.
23.Kraft M, Djukanovic R, Wilson S, Holgate ST, Martin RJ.
Alveolar tissue inflammation in asthma. Am J Respir Crit Care Med 1996; 154:1505-10.
24.Burioka N, Suyama H, Sako T, Shimizu E.
Circadian rhythm in peak expiratory flow: alteration with nocturnal asthma and theophylline chronotherapy. Chronobiol Int 2000; 17:513-9.
25.Bonnet R, Jörres R, Heitmann U, Magnussen H. Circadian rhythm in airway responsiveness and airway tone in patients with mild asthma. J Appl Physiol 1991; 71:1598-605.
26.van Aalderen WM, Postma DS, Koëter GH, et al. Circadian change in bronchial responsiveness and airflow obstruction in asthmatic children. Thorax 1989; 44:803-7.
27.Sly PD, Landau LI. Diurnal variation in bronchial responsiveness in asthmatic children. Pediatr Pulmonol 1986; 2:344-52.
28.Mohiuddin AA, Martin RJ. Circadian basis of the late asthmatic response. Am Rev Respir Dis 1990; 142:1153-57.
29.Kraft M, Martin RJ, Wilson S, Djukanovic R, Holgate ST. Lymphocyte and eosinophil influx into alveolar tissue in nocturnal asthma. Am J Respir Crit Care Med1999; 159:228-34.
30.Ballard RD, Irvin CG, Martin RJ, Pak J, Pandey R, White DP.
Influence of sleep on lung volume in asthmatic patients and normal subjects. J Appl Physiol 1990; 68:2034-41.
31.Ballard RD, Clover CW, White DP. Influence of non-REM sleep on inspiratory muscle activity and lung volume in asthmatic patients. Am Rev Respir Dis 1993; 147:880-86.
32.D'Ambrosio CM, Mohsenin V. Sleep in asthma. Clin Chest Med 1998; 19:127-137.
33.Szefler SJ, Ando R, Cicutto LC. Plasma histamine, epinephrine, cortisol and leukocyte beta-adrenergic receptors in nocturnal asthma. Clin Pharmacol Ther 1991; 49:59-68.
34.Mackay TW, Wallace WA, Howie SE, Brown PH, Greening AP, Church MK, Douglas NJ.
Role of inflammation in nocturnal asthma. Thorax 1994; 49:257-62.
35.
Bellia V, Bonanno A, Cibella F, Cuttitta G, Mirabella A, Profita M, Vignola AM, Bonsignore G.
Urinary leukotriene E 4 in the assessment of nocturnal asthma. J Allergy Clin Immunol 1996; 97:735-41.
36.Smolensky MH, D'Alonzo GE. Nocturnal asthma: mechanisms and chronotherapy, Touitou Y, :Haus E, eds. Biological Rhythms in Clinical and Laboratory Medicine. New York: Springer-Verlag, 1992:453-469.
37.
Postma DS, Keyzer JJ, Koëter GH, Sluiter HJ, De Vries K. Influence of the parasympathetic and sympathetic nervous system on nocturnal bronchial obstruction. Clin Sci 1985; 69:251-58.
38.Jarjour NN, Calhoum Wj, Busse WW. Enhanced metabolism of oxygen radicals in nocturnal asthma. Am Rev Respir Dis 1992; 146:905-11.
39.Chen WY, Horton DJ, Weiser PC. Airway obstruction induced by body cooling in asthmatics. Physiologist 1977; 20:16.
40.Chen WY, Horton DJ. Airway obstruction in asthmatics induced by body cooling. Scand J Respir Dis 1978; 59:13-20.
41.Turki J, Pak J, Green SA et al. Genetic polymorphisms of the beta-2-adrenergic receptor in nocturnal and no nocturnal asthma. Evidence that Gly-16 correlates with nocturnal phenotype. J Clin Invest 1995; 95:1635-41.
42.Behrakis PK, Baydur A, Jaeger MJ et al. Lung mechanics in sitting and horizontal body positions. Chest 1983; 83:643-46.
43.Jönsson E, Mossberg B. Impairment of ventilatory function by supine posture in asthma. Eur J Respir Dis 1984; 65:496-503.
44.Petersdorf RA. Disturbance of heat regulation. In: Wintrobe MM, Thorn GW, Adams RD, et al, editors. Harrison's principles of internal medicine. 7th ed. New York: McGraw-Hill, 1974.
45.Chen WY, Chai H. Airway cooling and nocturnal asthma. Chest 1982; 81:675-80.
46.Gislason T, Janson C, Vermeire P, Plaschke P, Björnsson E, Gislason D, Boman G. Respiratory symptoms and nocturnal gastroesophageal reflux: a population-based study of young adults in three European countries. Chest. 2002;121(1):158-163.
47.Kong DL, Qin Z, Shen H, Jin HY, Wang W, Wang ZF.
Association of Obstructive Sleep Apnea with Asthma: A Meta-Analysis.
Sci Rep 2017; 7:4088. doi: 10.1038/s41598-017-04446-6.
48.Julien JY, Martin JG, Ernst P, et al. Prevalence of obstructive sleep apnea-hypopnea in severe versus moderate asthma. J Allergy Clin Immunol 2009; 124:371-376.
49.Mehra R, Redline S. Sleep apnea: a proinflammatory disorder that coaggregates with obesity. J Allergy Clin Immunol 2008; 121:1096-1102.
50.Chan CS, Woolcock AJ, Sullivan CE. Nocturnal asthma: role of snoring and obstructive sleep apnea. Am Rev Respir Dis 1988; 137:1502-04.
51.Alkhalil M, Schulman ES, Getsy J. Obstructive sleep apnea syndrome and asthma: the role of continuous positive airway pressure treatment. Ann Allergy Asthma Immunol 2008; 101(4):350-7.
52.Salles C, Terse-Ramos R, Souza-Machado A, Cruz AA. Apneia obstrutiva do sono. J Bras Pneumol 2013; 39:604-612.
53.Martin RJ, Pak J. Nasal CPAP in nonapneic nocturnal asthma. Chest 1991; 100:1024-27.
54.Martin RJ. Martin RJ. Nocturnal asthma: Understanding chronobiology and chronotherapy. Allergology International 1997; 46:17-24.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|