|
Asma
TRATAMENTO DA ASMA
ANESTESIA, CIRURGIA E ASMA
A rápida expansão dos conhecimentos, o aparecimento de novos e sofisticados procedimentos diagnósticos, a evolução da anestesia no que concerne à utilização de novos fármacos, técnicas de ventilação e acurada monitorização do paciente no per e pós-operatório propiciaram cada vez mais procedimentos cirúrgicos de alta complexidade.
Em todos os pacientes em que haja indicação para cirurgia, torna-se necessária a avaliação do “risco”, o que permite a identificação dos pacientes que potencialmente poderão apresentar complicações no per e pós-operatório, em função da localização da cirurgia, tempo de duração do ato operatório, tipo de anestesia utilizada, idade do paciente, patologia de base e comorbidades. No paciente asmático não é diferente, e apesar de os avanços no seu tratamento permitirem a administração segura de qualquer um dos tipos de anestesia, a asma influencia a morbidade e a mortalidade operatórias, estando os pacientes com asma brônquica mal controlada mais propensos a complicações pulmonares. Cirurgias eletivas devem ser adiadas até que a asma esteja bem controlada.1
Embora a incidência de broncospasmo perioperatório grave seja relativamente baixa em asmáticos submetidos à anestesia, quando ocorre pode ser fatal. O broncospasmo após a intubação traqueal ou estimulação mecânica das vias aéreas é a principal complicação no per e pós-operatório do paciente asmático, seguindo-se a hipoxemia e possível hipercapnia, a tosse ineficaz e atelectasias, a infecção respiratória2 e a exposição ao látex.3,4 Estas complicações dependem do grau de hiper-responsividade brônquica, da intensidade da obstrução ao fluxo aéreo e hipersecreção de muco. A incidência de casos de anafilaxia por sensibilização ao látex já vem em queda, como resultado da identificação de doentes em risco e de medidas preventivas.5,6 No que concerne às crianças, a presença de um anestesista pediátrico experiente durante o manejo das vias aéreas demonstrou reduzir o risco de
eventos adversos respiratórios perioperatórios.7
Litvan8 em análise retrospectiva de 15.963 procedimentos anestésicos observou broncospasmo em 277, correspondendo a 1,73% do total. Destes, 75 se desenvolveram durante a anestesia (0,47%) e 202 no pós-operatório imediato (1,26%). Em 42 pacientes os episódios de broncospasmo foram classificados como severo. Em quase todos os casos (94%) o broncospasmo ocorreu após anestesia geral com intubação traqueal. Na população geral a ocorrência de broncospasmo intraoperatório é de 1,6 episódio para cada 1.000 cirurgias,9 enquanto que em pacientes com asma ele ocorre entre 6,5%9 e 7,1%.10 Nas crianças este percentual pode ascender a 22%.11 Warner et al.12 revendo dados de um grande número de pacientes com asma que se submeteram a cirurgias em hospitais de Rochester, em Minnesota – EUA, no período compreendido entre 1964 e 1983 identificaram 703 pacientes que preenchiam rigorosos critérios para o diagnóstico de asma brônquica. Para isto, todos os pacientes com idade superior a 50 anos e com VEF1 menor do que 50% do previsto foram eliminados do estudo, visando a excluir possíveis pacientes com DPOC que tenham sido erroneamente diagnosticados como asmáticos. Em 12 pacientes (1,7%) ocorreu broncospasmo durante a cirurgia, enquanto que no pós-operatório a insuficiência respiratória ocorreu em um paciente e o laringospasmo em outros dois. O início do broncospasmo ocorreu no pós-operatório em 2/3 dos pacientes, no terço restante durante a anestesia, persistindo no pós-operatório em um paciente. Em relação às complicações estas ocorreram somente nos pacientes que se submeteram à anestesia geral, com intubação traqueal. Quanto à idade as intercorrências foram mais frequentes nos pacientes mais velhos, e naqueles com doença ativa e nos que relatavam sintomas (o que significa maior hiper-responsividade brônquica) e utilização de medicação de alívio no período que antecedia a cirurgia.
A melhor medida profilática contra possíveis complicações é tratar o paciente a fim de torná-lo assintomático, e obter os valores do VEF1 e PFE normais ou próximo de seu melhor valor prévio pessoal. A variabilidade do PFE também pode ser utilizada para avaliação, pois se correlaciona bem com a hiper-responsividade brônquica. Em pacientes com indicação para cirurgia eletiva e que tenham apresentado infecção viral alta recente, deve-se postergar o procedimento por duas ou três semanas após a cura clínica.13,14 Um dado favorável nos pacientes com asma é a resposta terapêutica farmacológica que é nitidamente superior àquela dos pacientes com DPOC, quando a reversibilidade da obstrução muitas vezes não ocorre.
Um elemento de muita relevância na avaliação pré-operatória de qualquer paciente com asma é a verificação de utilização de corticoide inalatório nos meses que antecedem a cirurgia e se o tratamento ocorre regularmente e com a devida aderência. Para os pacientes que não estão com o tratamento otimizado a prednisolona é prescrita nos cinco dias que antecedem a cirurgia na dose de 0,5 mg/kg/dia.15 Para o paciente pediátrico as doses preconizadas para a prednisona são de 1 mg/kg/dia, máximo de 60 mg, por 3 a 5 dias antes da cirurgia; um curso de dois dias de dexametasona oral (0,3 mg/kg, máximo de 16 mg uma vez ao dia); ou 48 h antes da cirurgia uma dose única de metilprednisolona oral (1 mg/kg).16,17
Atualmente, a escolha do monitoramento anestésico, além da monitorização hemodinâmica  avançada, da determinação contínua do ritmo cardíaco por meio de cardioscopia e da monitorização contínua da saturação da oxihemoglobina por meio da oximetria de pulso, da monitorização de gases etc.18 deve, se possível, ser voltada para a avaliação da mecânica pulmonar através de volumes, pressões, fluxos das vias aéreas, relação I:E, complacência e das formas de ondas respiratórias. avançada, da determinação contínua do ritmo cardíaco por meio de cardioscopia e da monitorização contínua da saturação da oxihemoglobina por meio da oximetria de pulso, da monitorização de gases etc.18 deve, se possível, ser voltada para a avaliação da mecânica pulmonar através de volumes, pressões, fluxos das vias aéreas, relação I:E, complacência e das formas de ondas respiratórias.
A capnografia, através do monitoramento do CO2 expirado, pode ser utilizada como índice de avaliação do fluxo expiratório das vias aéreas.19,20 Na eventualidade de broncospasmo a capnografia além de útil é um método rápido de diagnóstico, através da visualização da ascensão lenta do CO2 expirado, com alteração na inclinação da extremidade ascendente da forma de onda do plateau alveolar do capnograma, em forma de "barbatana de tubarão". (Figura 1). Contudo, se houver piora gradual do broncospasmo, o gradiente de ETCO2 para PaCO2 se eleva, tornando o ETCO2 um indicador não confiável de PaCO2. Assim, nessa circunstância, uma cânula intra-arterial é introduzida para permitir monitorização da pressão arterial média (PAM) e uma visão global do transporte de oxigênio e da eficiência da ventilação.
Quanto ao tipo de anestesia a ser utilizado, deve-se salientar que a asma não contraindica a anestesia geral ou a intubação orotraqueal, entretanto, o estágio de gravidade e o controle da doença por ocasião do ato cirúrgico constituem fator de suma importância em sua determinação, levando-se também em consideração o porte da cirurgia a ser efetuada. Deve-se ressaltar ainda, que tanto a raquianestesia como o bloqueio peridural podem raramente desencadear broncospasmo,21,22 provavelmente por bloqueio neural ao nível da glândula suprarrenal e de vias de condução simpática do pulmão.23 Quanto ao bloqueio anestésico locorregional, que tem indicação em atos menores, deve ser ressaltado que o bloqueio do plexo braquial por via infraclavicular ou supraclavicular, pode resultar em pneumotórax com sérias consequências, principalmente naqueles com asma mal controlada.
Anestésicos Inalatórios
Os agentes inalatórios são alguns dos poucos agentes farmacológicos administrados como gases. Os anestésicos inalatórios desempenham papel de broncodilatador e atuam conjuntamente relaxando a musculatura lisa traqueal através de uma variedade de mecanismos, que incluem ações diretas e indiretas. Eles promovem o relaxamento da musculatura lisa das vias aéreas ao reduzir o cálcio livre intracelular, inibir a proteinoquinase C, diminuir a liberação de cálcio do retículo sarcoplasmático e modular os canais de cálcio dependentes de voltagem.24-26
No consenso quase unânime dos autores, os anestésicos halogenados são as drogas de eleição 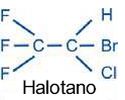 para a anestesia geral nos pacientes com asma. O halotano, introduzido em 1956, foi o primeiro anestésico inalatório halogenado moderno usado na prática clínica, com grande poder na abolição precoce dos reflexos faríngeos e laríngeos, reprimindo a tosse, promovendo broncodilatação.27 Causa menor depressão respiratória, apresentando, entretanto, maior potencial de interação com outras drogas, além de hepatotoxicidade, potencial arritmogênico e causar depressão direta da contratilidade miocárdica pela redução da concentração intracelular de Ca2+.28 para a anestesia geral nos pacientes com asma. O halotano, introduzido em 1956, foi o primeiro anestésico inalatório halogenado moderno usado na prática clínica, com grande poder na abolição precoce dos reflexos faríngeos e laríngeos, reprimindo a tosse, promovendo broncodilatação.27 Causa menor depressão respiratória, apresentando, entretanto, maior potencial de interação com outras drogas, além de hepatotoxicidade, potencial arritmogênico e causar depressão direta da contratilidade miocárdica pela redução da concentração intracelular de Ca2+.28
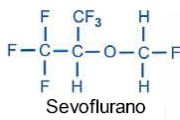
Os anestésicos voláteis que podem ser utilizados com segurança em pacientes com asma são: sevoflurano, desflurano e isoflurano. O sevoflurano não é irritante para as vias aéreas e é um potente broncodilatador. Devido a esta combinação de propriedades, o sevoflurano é o broncodilatador mais eficaz dos anestésicos inalatórios26 e o que pode ser benéfico em pacientes asmáticos. Desflurano e isoflurano causam muito mais irritação respiratória do que sevoflurano ou halotano.29 O desflurano é frequentemente considerado uma opção mais segura, pois é menos propenso a causar irritação das vias aéreas. Há evidências de que o desflurano provoca, entretanto, broncoconstrição em fumantes.30
Na escolha é essencial discutir a condição de cada paciente com as equipes médica e da anestesia, para ajustar o melhor plano anestésico de acordo com as necessidades do paciente, considerando a gravidade da asma, os medicamentos em uso e outros fatores individuais relevantes.
 Desflurano, isoflurano e sevoflurano causam muito menos depressão do miocárdio que o halotano.31 Pacientes que recebem sevoflurano ou isoflurano, em vez de halotano, têm muito menos probabilidade de desenvolver arritmia.
Desflurano, isoflurano e sevoflurano são muito menos arritmogênicos que o halotano e são agentes mais apropriados para manutenção da anestesia (e indução de anestesia no caso de sevoflurano) nesses pacientes.31,32 Como o sevoflurano é um gás não irritante, ele é geralmente utilizado para a indução e manutenção da anestesia em crianças com asma.33 Em países como o Japão o sevoflurano é considerado o agente anestésico de primeira escolha para o paciente asmático.34 Não causa sintomas de estimulação simpática nem irritação das vias aéreas mesmo durante indução rápida.34 Desflurano, isoflurano e sevoflurano causam muito menos depressão do miocárdio que o halotano.31 Pacientes que recebem sevoflurano ou isoflurano, em vez de halotano, têm muito menos probabilidade de desenvolver arritmia.
Desflurano, isoflurano e sevoflurano são muito menos arritmogênicos que o halotano e são agentes mais apropriados para manutenção da anestesia (e indução de anestesia no caso de sevoflurano) nesses pacientes.31,32 Como o sevoflurano é um gás não irritante, ele é geralmente utilizado para a indução e manutenção da anestesia em crianças com asma.33 Em países como o Japão o sevoflurano é considerado o agente anestésico de primeira escolha para o paciente asmático.34 Não causa sintomas de estimulação simpática nem irritação das vias aéreas mesmo durante indução rápida.34
Anestésicos Intravenosos
São drogas injetáveis utilizadas na asma por via intravenosa geralmente utilizadas para indução e intubação e que apresentam efeitos sobre o tônus das vias aéreas, – produzem perda da consciência em um tempo de circulação braço cérebro de aproximadamente 11 segundos.
O cloridrato de cetamina, um derivado da fenciclidina, apresenta ação broncodilatadora, não afetando o centro respiratório, relaxando a musculatura lisa brônquica através da liberação de catecolaminas endógenas e ação antimuscarínica, podendo ser utilizada com segurança durante a indução anestésica e durante a intubação traqueal (principalmente em situações de emergência),35 sendo ainda um efetivo analgésico.36 Em modelos animais, o propofol e a cetamina também produzem efeitos broncoprotetores locais, diminuindo a constrição das vias aéreas induzida por via vagal.16 O mecanismo de ação da cetamina se dá principalmente pelo antagonismo não competitivo do receptor do ácido N-metil D-aspártico (NMDA).37
O propofol, um derivado alquilfenol, é um hipnótico com ação sedativa, com rápido início de ação (inferior a um minuto) e com curta duração de ação (aproximadamente 10 minutos), podendo ser utilizado em bolus para a indução anestésica, para manutenção da anestesia ou para a sedação durante bloqueios regionais, podendo ser utilizado sob infusão contínua
através de bomba de infusão durante todo o procedimento.
O propofol está associado à menor resistência das vias aéreas em comparação com etomidato.38 Experimentalmente comprovou-se a sua ação na redução da resistência das vias aéreas, desconhecendo-se, entretanto, seu mecanismo de ação.
Acredita-se que o propofol exerça o seu efeito através da redução da dissociação do ácido gama-aminobutírico (GABA) dos receptores GABA no cérebro, intensificando assim os efeitos inibitórios desse neurotransmissor.39
O propofol tem a capacidade de suprimir o reflexo laríngeo e atenuar a broncoconstrição reflexa de forma mais eficaz do que os agentes anestésicos inalatórios, quando ocorre estimulação mecânica das vias aéreas. Em comparação com o tiopental, tiamilal ou metoexital, o propofol demonstrou superioridade na redução da responsividade das vias aéreas e na prevenção do broncospasmo durante a indução intravenosa.40
Em pediatria a chamada anestesia intravenosa total (TIVA) – indução intravenosa com manutenção intravenosa, substituindo a anestesia inalatória, demonstrou ocorrência de menor eventos adversos respiratórios perioperatórios.41,42
Os barbitúricos (tiopental, tiamilal) nas doses habituais são contraindicados para uso em asmáticos, por induzir a broncoconstrição através da liberação de histamina.34 A morfina e a meperidina, frequentemente utilizadas no per e pós-operatório, devem ser evitadas por afetarem o tônus broncomotor através da liberação de histamina ou através da modulação de receptores colinérgicos e não colinérgicos em células de músculo liso peribrônquicas. A morfina tem o potencial de precipitar ou exacerbar ataques asmáticos.43 Deprimem também a resposta central a hipoxemia e a hipercapnia, mesmo com baixas doses, especialmente em crianças, em pacientes debilitados e pneumopatas. Drogas narcóticas sintéticas como fentanil, alfentanil, sufentanil e remifentanil não liberam histamina e podem se constituir em outras opções para esses pacientes.43
Bloqueadores Neuromusculares
Quanto aos relaxantes musculares, estes estão divididos em dois grupos: os despolarizantes que se unem a receptores de acetilcolina (Ach) na membrana neuromuscular pós-juncional, determinando despolarização, e os não despolarizantes que agem por competição com a Ach na junção neuromuscular, prevenindo a despolarização da membrana pós-juncional. Estas drogas determinam broncospasmo pela liberação de histamina, principalmente a d-tubocurarina, mivacúrio, doxacúrio ou altas doses de atracúrio. Outro mecanismo é o colinérgico, quando se ligam a receptores muscarínicos M2 na mucosa traqueal, como pancurônio, atracúrio e mivacúrio.44,45
A administração de agentes bloqueadores neuromusculares não despolarizantes (atuam como antagonistas competitivos de receptores da Ach), com altas doses de corticoides por via sistêmica em pacientes com asma em grave insuficiência respiratória, pode determinar importante e prolongada fraqueza muscular,46 mesmo quando de curtos períodos (1–2 dias). Uma situação semelhante, embora não tão severa, pode ocorrer após utilização durante anestesia em pacientes com asma, recebendo de moderada a altas doses de corticoides por via sistêmica.47 A utilização concomitante de antibióticos do grupo dos aminoglicosídeos se constitui também em fator aditivo de risco para o desenvolvimento de prolongada fraqueza muscular, por potencializar estes agentes curarizantes.
O relaxante muscular mais utilizado e seguro na atualidade é o vecurônio, com rápido início de ação (90 segundos) e duração de ação intermediária (30–60 min), com poucos efeitos cardiovasculares em relação aos agentes não despolarizantes mais antigos (pancurônio) face a sua rápida distribuição e metabolismo,45,48,49 sendo que o cisatracúrio de duração intermediária, que também não libera histamina, se constitui em boa alternativa. Com o vecurônio a recuperação é geralmente espontânea sem necessidade de neostigmina para sua reversão, a menos que doses repetidas tenham sido administradas.
Alguns estudos têm demonstrado que os anestésicos locais bupivacaína e lidocaína sob a forma de aerossol são capazes de determinar broncospasmo em certos pacientes com asma.50,51 O mecanismo pelo qual a broncoconstrição é induzida não está ainda completamente elucidado, entretanto, o pré-tratamento com drogas anticolinérgicas atenua parcialmente a resposta broncoconstritora, sugerindo que possa ocorrer, em parte, via reflexo vagal.49,51-53 Existem evidências de que a inalação de lidocaína bloqueie os reflexos de broncodilatação via NANC, determinando resposta broncoconstritora.54 Todo paciente com asma deve, portanto, receber pré-medicação com broncodilatador antes de qualquer procedimento broncoscópico.
Tratamento no Pós-operatório
No pós-operatório algumas considerações necessitam de ser enfatizadas:
∎ O risco de broncospasmo é maior no pós-operatório do que durante o ato cirúrgico propriamente dito, o que requer monitorização contínua.
∎ Os pacientes devem ser extubados o mais prontamente e metodicamente possível, prescrevendo-se drogas broncodilatadoras por inalação em todos os pacientes.
Entretanto, mesmo que a extubação traqueal seja suave, o estágio de despertar pode iniciar um broncospasmo grave com uma via aérea desprotegida. O risco de regurgitação e aspiração está sempre presente.
∎ Reintroduzir o corticoide por via sistêmica ou por inalação, pois não há risco de interferência na cicatrização da ferida operatória.55,56
∎ Administrar analgesia precocemente, permitindo ao paciente inspirações profundas e tosse, facilitando a mobilização de secreções, impedindo atelectasias;
instituir espirometria de incentivo, exercícios de respiração profunda e mobilização precoce.57
∎ Evitar drogas como morfínicos e anti-inflamatórios não hormonais utilizados para a analgesia43 e ß-bloqueadores contra as taquiarritmias e hipertensão arterial por causarem broncospasmo.58
∎ Manter adequada hidratação e profilaxia contra o tromboembolismo venoso.
∎
A ventilação não invasiva com pressão positiva é uma opção em alguns asmáticos que apresentam broncospasmo persistente após a extubação traqueal.59
∎ Uso seletivo de sonda nasogástrica em caso de náuseas e vômitos no pós-operatório e na distensão abdominal sintomática com incapacidade de tolerar ingestão oral.
Anestésicos Locais e Broncofibroscopia
Aerossóis de anestésicos locais, tais como bupivacaína e lidocaína, podem causar eventualmente broncoconstrição em pacientes com asma.60,61 O grau de responsividade à histamina não prediz o desenvolvimento ou a extensão da broncoconstrição pós-inalação da lidocaína.61 O mecanismo local da broncoconstrição anestésico-induzida não está estabelecido. O pré-tratamento com drogas anticolinérgicas atenua parcialmente o broncospasmo, sugerindo que este possa ser decorrente de um reflexo em parte via vagal. Anestésicos locais inalados podem seletivamente inibir nervos broncodilatadores não adrenérgicos e não colinérgicos e assim permitir o tônus vagal sem oposição. Uma evidência para esta constatação é feita pela demonstração de que a inalação de lidocaína bloqueia reflexos de broncodilatação não adrenérgicos e não colinérgicos em seres humanos, determinando resposta broncoconstritora.62 É muito importante estar atento pois alguns pacientes com asma podem desenvolver broncoconstrição com anestesia tópica local durante a broncofibroscopia. Todo doente com asma deve receber pré-medicação anticolinérgica e broncodilatador antecedendo ao exame de broncoscopia.
Referências
01.Woods BD, Sladen RN. Perioperative considerations for the patient with asthma and bronchospasm. Br J Anaesth 2009; 103 Suppl1:i57-65.
02.Kingston HG, Hirshman CA. Perioperative management of the patient with asthma. Anseth Analg 1984; 63:844-55.
03.Slater JE. Latex allergy. J Allergy Clin Immunol 1994; 94:139-49.
04.Sussman GL, Beezohold DH. Allergy to latex rubber. Ann Intern Med 1995; 122:43-6.
05.Hepner DL, Castells MC. Anaphylaxis during the perioperative period. Anesth Analg 2003; 97:1381-1395.
06.Laxenaire M, Mertes P. Anaphylaxis during anaesthesia. Results of a two-year survey in France. Br J Anaesth 2001; 87:549-558.
07.von Ungern-Sternberg BS, Boda K, Chambers NA, Rebmann C, Johnson C, Sly PD, Habre W. Risk assessment for respiratory complications in paediatric anaesthesia: a prospective cohort study. Lancet 2010; 376:773-83.
08.Litvan H: Complicaciones respiratorias postoperatorias, en Formación Continuada de Anestesiología y Reanimacíon de Catalunya . Fundaicón Europea de enseñanza en Anestesiología. 1998, pp 165-179.
09.Shnider SM, Papper EM. Anesthesia for the asthmatic patient. Anesthesiology 1961; 22:886-92.
10.Gold MI, Helrich MA. A study of the complications related to anesthesia in asthmatic patients. Anesth Analg 1963; 42:238-93.
11.Vener DF, Long T, Lerman J. Perioperative respiratory complications after general anesthesia in children with asthma (abst.). Can J Anesth 1994; 41:A55.
12.Warner DO, Warner MA, Barnes RD, Offord KP, Schroeder DR, Gray DT, Yunginger JW.
Perioperative respiratory complications in patients with asthma. Anesthesiology 1996; 85:460-7.
13.Tisi GM. Preoperative evaluation of pulmonary function. State of art. Am Rev Respir Dis 1979; 119:293-310.
14.Pedersen T, Eliasen K, Herriksen E. A prospective study of risk factors and cardiopulmonary complications associated with anesthesia and surgery: risk indicators of cardiopulmonary morbidity. Acta Anesthesiol Scand 1990; 34:144-55.
15.Schuurmans MM, Steinack C, Solèr M. – Assessment for anaesthesia/surgery. In: Paolo Palange, Gernot Rohde. Eds. ERS / handbook Respiratory Medicine. 3 rd ed, Latimer Trend & Co:2019, 90-96.
16.Khara B, Tobias JD. Perioperative Care of the Pediatric Patient and an Algorithm for the Treatment of Intraoperative Bronchospasm. J Asthma Allergy 2023; 16:649-660.
17.Lauer R, Vadi M, Mason L. Anaesthetic management of the child with co-existing pulmonary disease. Br J Anaesth 2012; 109(Suppl 1):i47–i59.
18.BRASIL.Conselho Federal de Medicina. Prática do Ato Anestésico. Resolução 2174. Disponível em: https://www.sbahq.org/wp content/uploads/2018/03/RESOLUC%CC%A7A%CC%83O-2_174-de-14-de-dezembro-de-2017-Dia%CC%81rio-Oficial-da-Unia%CC%83o-Imprensa-Nacional.pdf
19.Woods BD, Sladen RN. Perioperative considerations for the patient with asthma and bronchospasm. Br J Anaesth 2009; 103 Suppl 1:i57-65.
20.You B, Peslin R, Duvivier C, Vu VD, Grilliat JP. Expiratory capnography in asthma: evaluation of various shape indices. Eur Respir J 1994; 7:318-23.
21.Mallampati SR. Bronchospasm during spinal anesthesia. Anesth Analg 1981; 60:839-40.
22.Wamg CY, Ong GSY. Severe bronchospasm during epidural anaesthesia. Anesthesiology 1993; 48:514-5.
23.Boushey JA, Holtzman MJ, Sheller JR, Nadel JA. Bronchial hyperreactivity. Am Rev Respir Dis 1980; 121:389-413.
24.Yamakage M, Namiki A. Cellular mechanisms of airway smooth muscle relaxant effects of anesthetic agents. J Anesth 2003; 17:251-258.
25.Stucke AG, Stuth EA, Tonkovic-Capin V, Tonkovic-Capin M, Hopp FA, Kampine JP, Zuperku EJ. Effects of sevoflurane on excitatory neurotransmission to medullary expiratory neurons and on phrenic nerve activity in a decerebrate dog model. Anesthesiology 2001; 95:485-91.
26.Rooke GA, Choi JH, Bishop MJ. The effect of isofluorane, halothane, sevoflurane, and thiopental/nitrous oxide on respiratory resistance after tracheal intubation. Anesthesiology 1997; 86:1294-1299.
27.Dueck R, Young I, Clausen J, Wagner PD. Altered distribution of pulmonary ventilation and bllod flow following induction of inhalation anesthesia. Anesthesiology 1980; 52:113-25.
28.Evers AS, Crowder CM. – General Anesthetics. In:Joel G. Hardman and Lee E. LimBird. Goodman & Gilman's Pharmacological Basis Of Thrapeutics. New York: MsGraw-Hill; 2001:337-365.
29.Stirt JA, Berger JM, Sillivan SF. Lack of arrythmia of isoflurane following administration of aminophylline in dogs. Anesth Analg 1983; 62:568-71.
30.Goff MJ, Arain SR, Ficke DJ, Uhrich TD, Ebert TJ. Absence of bronchodilation during desflurane anesthesia: a comparison to sevoflurane and thiopental. Anesthesiology 2000; 93:404-8.
31.Fee JP, Thompson GH. Comparative tolerability profiles of inhaled anaesthetics. Drug Saf 1997; 16:157-70.
32.Park KW. Cardiovascular effects of inhalational anaesthetics. Int Anaesthesiol Clin 2002; 40:1-14.
33.Habre W, Scalfaro P, Sims C, Tiller K, Sly PD. Respiratory mechanics during sevoflurane anesthesia in children with and without asthma. Anesth Analg 1999; 89:1177-81.
34.Ichinose M, Sugiura H, Nagase H, Yamaguchi M, Inoue H, Sagara H, Tamaoki J, Tohda Y, Munakata M, Yamauchi K, Ohta K; Japanese Society of Allergology. Japanese guidelines for adult asthma 2017. Allergol Int. 2017; 66:163-189.
35.Stoelting RK, Hillier SC. Nonbarbiturate intravenous anaesthetic drugs. In : Stoelting RK, Hillier SC, editors. Pharmacology and Physiology in Anaesthetic Practice . 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2006. pp. 155–78.
36.McGrath JC, MacKenzie JE, Millar RA. Effects of ketamina on central sympathetic discharge and the baroreceptor reflex during mechanical ventilation. Br J Anaesth 1975; 47:1141-7.
37.Kurdi MS, Theerth KA, Deva RS. Ketamine: Current applications in anesthesia, pain, and critical care. Anesth Essays Res 2014; 8:283-90.
38.Habre W, Petak F. Anaesthesia management of patients with airway susceptibilities: what have we learnt from animal models? Eur J Anaesthesiol 2013; 30:519-28.
39.Folino TB, Muco E, Safadi AO, Parks LJ. Propofol. 2023 Jul 24. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan–. PMID: 28613634.
40.Pizov R, Brown RH, Weiss YS, Baranov D, Hennes H, Baker S, Hirshman CA. Wheezing during induction of general anesthesia in patients with and without asthma. A randomized, blinded trial. Anesthesiology 1995; 82:1111-6.
41.Lauder GR. Total intravenous anesthesia will supercede inhalational anesthesia in pediatric anesthetic practice. Paediatr Anaesth 2015; 25:52-64.
42.von Ungern-Sternberg BS, Boda K, Chambers NA, Rebmann C, Johnson C, Sly PD, Habre W. Risk assessment for respiratory complications in paediatric anaesthesia: a prospective cohort study. Lancet 2010; 376:773-83.
43.Gutstein HG, Akil H. – Opioid Analgesics. In:Joel G. Hardman and Lee E. LimBird. Goodman & Gilman's Pharmacological Basis Of Thrapeutics. New York: MsGraw-Hill; 2001:569-620.
44.Hirshman CA. Perioperative management of the asthmatic patient. Can J Anaesth 1991; 38:R26-38.
45.Onkanlami OA, Fryer A, Hirshman CA. Interaction of nondepolarizing muscle relaxants with M2 and M3 muscarine receptors in guinea pig lung and heart. Anesthesiology 1996; 84:155-61.
46.Leatherman JW, Fluegel WL, David WS, Davies SF, Iber C. Muscle weakness in mechanically ventilated patients with severe asthma. Am J Respir Crit Care Med 1996; 153:1686-90.
47.Smith LJ, Winslow C. – Asthma and Surgery. In : Busse WW & Holgate ST. Asthma & Rhinitis. Oxford: Blackwell Science; 2000:1827-1838.
48.Fellini AA, Bernstein RL, Zauder HL. Bronchospasm due to suxamethonium. Br J Anaesth 1963; 35:657-9.
49.Wood M: Neuromuscular blocking agents. In: Wood M, Wood AJJ (eds). Drugs and Anesthesia: Pharmacology for Anesthesiologists. Baltimore: Williams & Wilkins; 1982:299-340.
50.Thomson NC. The effect of different pharmacological agents on respiratory reflexes in normal and asthmatic subjects. Clin Sci 1979; 56:235-41.
51.Weiss EB, Patwardhan AV. The response to lidocaine in bronchial asthma. Chest 1977; 72:429-38.
52.Fish JE, Peterman VI. Effect of inhaled lidocaine on airway function in asthmatic patients. Respiration 1979; 37:201-7.
53.Miller WC, Awe R. Effect of nebulized lidocaine on reactive airways. Am Rev Respir Dis 1975; 111:739-41.
54.Lammers J, Minette P, McCusker M, Chung KF, Barnes PJ. Nonadrenergic bronchodilatador mechanisms in normal human subjects in vivo . J Appl Physiol 1988; 64:1817-22.
55.Pien LC, Grammer LC, Petterson R. Minimal complications in a surgical population with severe asthma receiving prophylactic corticosteroids . J Allergy Clin Immunol 1988; 82:696-700.
56.Kabalin CS, Yarnold PR, Grammer LC. Low complication rate of corticosteroid-treated asthmatics undergoing surgical procedures. Arch Int Med 1995; 155:1379-84.
57.Qaseem A, Snow V, Fitterman N, Hornbake ER, Lawrence VA, Smetana GW, Weiss K, Owens DK, Aronson M, Barry P, Casey DE Jr, Cross JT Jr, Fitterman N, Sherif KD, Weiss KB; Clinical Efficacy Assessment Subcommittee of the American College of Physicians. Risk assessment for and strategies to reduce perioperative pulmonary complications for patients undergoing noncardiothoracic surgery: a guideline from the American College of Physicians. Ann Intern Med 2006; 144:575-80.
58.Opie LH. – Pharmacologic Optiions for Treatment of Ischemic Disease. In:Thomas W. Smith Ed. Cardiovascular Therapeutics. Philadelphia:W.B. Saunders; 1996:22-57.
59.Nowak R, Corbridge T, Brenner B. Noninvasive ventilation. J Allergy Clin Immunol 2009; 124(2 Suppl):S15-8.
60.Thomson N. The effect of different pharmacological agents on respiratory reflexes in normal and asthmatic subjects. Clin Sci 1979; 56:235-41.
61.McAlpine LG, Thomson NC. Lidocaine-induced bronchoconstrction in asthmatic patients. Relation to histamine airway responsiveness and effect of preservative. Chest 1989; 96: 1012-15.
62.Lammers J, Barnes P, Chung K. Nonadrenergic, noncholinergic airway inhibitory nerves. Eur Respir J 1992; 5:239-46.
|