|
Asma
QUITINASE
Pesquisadores do Departamento de Medicina Interna, Divisão de Pneumologia e Medicina de Pacientes Críticos da Escola de Medicina da Universidade de Yale, nos EUA, reportaram descoberta efetuada ao acaso em um modelo animal, utilizando ratos de laboratório BALB/c nos quais induziram à asma.1 Descreveram a presença da enzima quitinase após a purificação de cristais encontrados no tecido pulmonar dos animais de experimentação. Esta enzima não foi encontrada nos pulmões dos roedores do grupo controle.
As quitinases são enzimas que degradam a quitina, o segundo polissacarídeo biológico mais abundante na natureza, após a celulose, substância presente na superfície externa de certos nematódeos, crustáceos, fungos e exoesqueleto de insetos.2,3 A produção de quitinases é uma manifestação comum de alguns seres inferiores para uma resposta antiparasitária contra organismos que contêm quitina.
Os mamíferos não possuem a enzima para produzir a quitina (quitina-sintase), como os animais inferiores, porém utilizam as quitinases para repelir parasitas que dependem da quitina para sua proteção. O homem sintetiza proteínas quitinase-like e uma família de quitinases com cerca de meia dúzia de genes, resíduos da evolução. Altos níveis de uma destas enzimas humanas (quitinase 1, CHIT1 – quitotriosidase) está fortemente relacionada a uma rara doença, com padrão de herança autossômico recessivo, doença de depósito lipossômico, a doença deDoença de Gaucher.
Nos últimos anos, estas proteínas têm sido associadas à inflamação das vias aéreas.4 Outra enzima, a AMCase (acidic mammalian chitinase) objeto do protocolo de pesquisa do grupo de Yale, foi também relacionada ao processo inflamatório da asma, contribuindo para a patogênese de respostas imunes TH2.
A função precisa da CHIT1 em mamíferos ainda não se encontra totalmente esclarecida.
A CHIT é secretada principalmente por macrófagos ativados.
Integra com base em homologias e similaridades em sua estrutura e função a família das 18 glicosilases (GH18). A CHIT é a quitinase mais proeminente em humanos, podendo clivar a quitina e participar da resposta imunológica do corpo e está associada à inflamação, infecção, dano tecidual e remodelação.5 As quitinases podem ser ainda divididas em quitinases verdadeiras – quitotriosidase (CHIT1) e quitinase ácida de mamíferos (AMCase) – assim como as proteínas semelhantes à quitinase, estruturalmente relacionada YKL-40 (quitinase-3-like-1), que carecem de atividade enzimática.4 Embora tanto as quitinases quanto as proteínas semelhantes à quitinase possam se ligar à quitina com alta afinidade, apenas as quitinases verdadeiras podem clivá-la.
Os mamíferos contam com duas quitinases autênticas em seu arsenal: CHIT1 e AMCase. No que tange ao pulmão e à circulação humanos, destaca-se a CHIT1 como a quitinase predominante, responsável por toda a atividade quitinásica, ao passo que a contribuição da AMCase em seres humanos é praticamente nula.1,6
 |
|
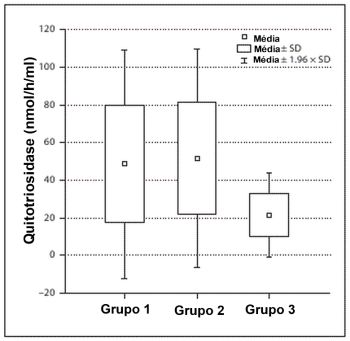
Figura 1 – Concentrações de quitotriosidase em pacientes com asma alérgica (grupo 1), asma não alérgica (grupo 2) e em controles (grupo 3). Bargagli et al. Respiration 2010; 79:437-438. |
|
Apesar da extensa investigação sobre o seu papel nas doenças alérgicas das vias respiratórias, ainda não há uniformidade nas opiniões sobre se são meros biomarcadores de doenças ou verdadeiros causadores de doenças.7 Independentemente do seu papel preciso na patogênese da asma, as proteínas da família das quitinases são altamente expressas nos pulmões de pacientes com asma.8 Embora
a CHIT1 tenha sido associada à origem da asma os resultados têm sido bastante controversos. James et al. relataram que a atividade da CHIT1 foi significativamente elevada em pacientes com asma leve a moderada em comparação com indivíduos saudáveis do grupo controle, mas não em pacientes com asma grave.9 Publicações anteriores já demostravam concentrações séricas mais altas de YKL-40 em pacientes com asma e indivíduos com hiper-responsividade comparados a controles.1,10,11 Na Figura 1 são apresentadas as concentrações de quitotriosidase em pacientes com asma alérgica (grupo 1), asma não alérgica (grupo 2) e em controles, onde Bargagli et al. puderam demonstrar diferenças significativas entre as concentrações da enzima em asmáticos e controles (p<0,05).12
Zhou Zhu e sua equipe,1 após induzirem a asma em camundongos, através de provocação com o aeroalérgeno ovoalbumina, detectaram em células epiteliais e macrófagos do tecido pulmonar níveis elevados da proteína e da AMCase mRNA, assim como no lavado broncoalveolar (LBA). O aumento da produção desta enzima está intimamente relacionado a outra proteína do sistema imune, secretada pelos linfócitos TH2, a interleucina 13 (IL-13), previamente imputada no processo inflamatório da asma.
Estudos foram feitos para avaliar o papel da AMCase na iniciação e perpetuação de respostas IL-13. A upregulation da AMCase não ocorre em ausência de IL-13. O processo inflamatório pela AMCase é predominante e seletivamente induzido durante a inflamação TH2 e sua indução é mediada, em grande escala, pela IL-13. Existe correlação positiva entre a quitinase nos pulmões de animais com asma induzida, a IL-13 e o grau de inflamação. Estes estudos demonstram que a AMCase não tem função na indução de citocinas TH2, mas, particularmente, medeia a patogênese, contribuindo para as respostas efetoras da IL-13, como na indução da produção de importantes quimocinas (p. ex. CCR2, CC10, MCP-1, eotaxina-1) para o recrutamento de células que participam das respostas alérgicas imunes, importantes no processo da cascata inflamatória tecidual que ocorre na asma. Ficou demonstrado que isto é devido, pelo menos em parte, a uma via independente STAT-6, que contribui para a expressão de quimocinas IL-13-induzidas. Quando a enzima era bloqueada através da administração de anticorpos anti-AMCase ou pelo antibiótico alosamidina, ocorria marcante redução da inflamação TH2 com diminuição dose-dependente da acumulação de eosinófilos e linfócitos no LBA e tecido broncopulmonar, com concomitante redução na hiper-responsividade brônquica.
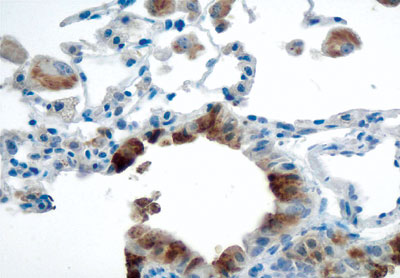 A partir dos achados em animais de laboratório (Figura 2) os autores analisaram a manifestação da AMCase em pulmão de humanos através de biópsia endobrônquica. Estudaram um grupo de dezesseis indivíduos, sendo que os achados puderam ser confirmados em tecido pulmonar de sete pacientes que apresentavam asma, quando encontraram elevados níveis de quitinase, que não foi detectada em nove indivíduos do grupo controle. A partir dos achados em animais de laboratório (Figura 2) os autores analisaram a manifestação da AMCase em pulmão de humanos através de biópsia endobrônquica. Estudaram um grupo de dezesseis indivíduos, sendo que os achados puderam ser confirmados em tecido pulmonar de sete pacientes que apresentavam asma, quando encontraram elevados níveis de quitinase, que não foi detectada em nove indivíduos do grupo controle.
Em indivíduos com asma, níveis séricos elevados de proteína semelhante à quitinase YKL-40, que é codificada pelo gene CHI3L1, estão associados à asma grave, comprometimento da função pulmonar e exacerbação da doença.8 Avaliou-se a correlação entre o nível sérico da proteína quitinase-like YKL-40 (também chamada HCgp-39 – glicoproteína 39 da cartilagem humana – e quitinase 3-like 1) e o diagnóstico e a gravidade da asma. A YKL-40 estava elevada no soro e nos pulmões de um subgrupo de pacientes com asma, no qual a expressão da quitinase em ambos os compartimentos se correlacionava com o estágio de gravidade da doença. Os níveis da YKL-40 se correlacionavam positivamente com a gravidade da asma e inversamente com o VEF1. Pacientes com YKL-40 elevada necessitaram de maior quantidade de broncodilatador para alívio, corticoides por via oral e apresentaram maiores índices de internação do que os pacientes com níveis mais baixos da proteína. A detecção desta proteína pode significar sua participação efetiva no processo inflamatório ou somente uma molécula sentinela ou marcadora da doença (biomarcador).
Estudo de Tang et al.13 que incluiu 62 pacientes asmáticos e 64 controles, que foram acompanhados durante um período de dois anos, dividiu os pacientes com asma em dois subgrupos: aqueles em estado estável e pacientes que necessitaram de atendimento médico de urgência devido à exacerbação aguda. Pesquisadores do Hospital Changzheng em Xangai, na China, avaliaram os níveis da proteína YKL-40 nos diferentes grupos de pacientes e a correlação entre os níveis séricos YKL-40, os níveis séricos de IgE total, o percentual de eosinófilos no sangue periférico e os parâmetros de função respiratória. Eles demonstraram que durante agudização de asma, os níveis séricos de YKL-40 são mais elevados do que naqueles em estado estável, e maior do que os níveis séricos de indivíduos não asmáticos.
Gomez et al.14 concluíram que a YKL-40 medeia a inflamação das vias aéreas e o seu nível sérico está associado à gravidade da doença. Quatro grupos YKL-40 foram identificados (C1 – C4), sendo que, utilizando uma análise de agrupamentos de indivíduos com asma com base nos níveis de YKL-40 e características clínicas e fisiológicas da doença, identificaram quatro grupos distintos de indivíduos. Grupos YKL-40 – C3 e C4 – podem ser clínica e biologicamente relevantes para a identificação de pacientes com asma grave com doença não TH2. C3 foi associado ao início precoce e maior duração da doença, obstrução grave ao fluxo aéreo e maior número de exacerbações e episódios de asma quase fatal. C4 apresentou os maiores níveis de YKL-40 no soro, início na idade adulta, menor obstrução do fluxo aéreo, porém exacerbações mais frequentes.
Níveis circulantes elevados de chitinase-like protein YKL-40 têm sido implicados em casos de meningite, pneumonia, artrite reumatoide, osteoartrite, câncer de mama e pulmão e fibrose hepática. Recentemente demonstrou-se que YKL-40 está fortemente elevada no epitélio das vias aéreas e nos macrófagos alveolares de pacientes com asma, ocorrendo o mesmo com os níveis séricos. Os níveis circulantes no soro de YKL-40 se correlacionam com a gravidade da asma, a espessura da membrana basal subepitelial e a função pulmonar, sugerindo que os níveis de YKL-40 funcionem como um biomarcador para a asma.
A quitotriosidase (quitinase 1, CHIT1) é conhecida como reguladora e estimuladora nas respostas TH2 e seus níveis no escarro de pacientes com asma infantil são detectados em níveis notadamente elevados. Da mesma forma, a CHIT1 foi implicada na patogênese da asma, esses dados, no entanto, têm sido amplamente conflitantes. Hong et al.15 através de estudo em murinos knockout em CHIT1 em modelo para asma, estudaram os possíveis mecanismos e seu papel na patogênese da asma alérgica. Concluíram que a CHIT1 desempenha um papel protetor na patogênese da inflamação alérgica e nas respostas asmáticas das vias aéreas através da regulação da expressão de TGF-β e das células Treg Foxp3+.15
A estimulação do acúmulo de Treg pelo TGF-β1 é regulada pela capacidade da CHIT1 de aumentar a capacidade do TGF-ß1 de estimular a expressão do receptor TGF-ß1 nas células T.
Com base nas constatações deste estudo, os autores chegaram à conclusão de que a CHIT1 exerce um papel na redução da inflamação pulmonar ao modular as respostas das células TH2.15 Embora alguns estudos tenham sugerido que a AMCase e não a CHIT1 esteja comprometida na patogênese da asma em crianças de ascendência caucasiana,5 é importante destacar que, considerando que a maior parte da atividade quitinase em humanos seja atribuída à CHIT1, permanece uma incógnita o papel da AMCase na regulação de doenças respiratórias.5
Referências
01.Zhu Z, Zheng T, Homer RJ, Kim YK, Chen NY, Cohn L, Hamid Q, Elias JA. Acidic mammalian chitinase in asthmatic Th2 inflammation and IL-13 pathway activation. Science; 2004; 304:1678-82.
02.Shahabuddin M, Toyoshima T, Aikawa M, Kaslow DC. Transmission-blocking activity of a chitinase inhibitor and activation of malarial parasite chitinase by mosquito protease. Proc Acad Sci USA 1993; 90:4266-70.
03.Shibata Y, Foster LA, Bradfield JF, Myrvik QN. Oral administration of chitin down-regulates serum IgE levels and lung eosinophilia in the allergic mouse. J Immunol 2000; 164:1314-21.
04.Lee CG, Da Silva CA, Dela Cruz CS, Ahangari F, Ma B, Kang MJ, He CH, Takyar S, Elias JA. Role of chitin and chitinase/chitinase-like proteins in inflammation, tissue remodeling, and injury. Annu Rev Physiol 2011; 73:479–501.
05.Chang D, Sharma L, Dela Cruz CS. Chitotriosidase: a marker and modulator of lung disease. Eur Respir Rev 2020; 29:190143.
06.Seibold MA, Donnelly S, Solon M, Innes A, Woodruff PG, Boot RG, Burchard EG, Fahy JV. Chitotriosidase is the primary active chitinase in the human lung and is modulated by genotype and smoking habit. J Allergy Clin Immunol 2008; 122:944-950.e3.
07.Declercq J, Hammad H, Lambrecht BN, Smole U. Chitinases and chitinase-like proteins in asthma. Semin Immunol 2023; 67:101759.
08.Chupp GL, Lee CG, JarJour N, Shim YM, Holm CT, He S, Dziura JD, Reed J, Coyle AJ, Kiener P, Cullen M, Grandsaigne M, Dombret MC, Aubier M, Pretolani M, Elias JA. A chitinase´like protein in the lung and circulation of patients with severe asthma. N Engl J Med 2007;357:2016-2027.
09.James AJ, Reinius LE, Verhoek M, Gomes A, Kupczyk M, Hammar U, Ono J, Ohta S, Izuhara K, Bel E, Kere J, Söderhäll C, Dahlén B, Boot RG, Dahlén SE; BIOAIR (Longitudinal Assessment of Clinical Course and Biomarkers in Severe Chronic Airway Disease) Consortium. Increased YKL-40 and Chitotriosidase in Asthma and Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2016; 193:131-42.
10.Ober C, Tan Z, Sun Y, Possick JD, Pan L, Nicolae R, Radford S, Parry RR, Heinzmann A, Deichmann KA, Lester LA, Gern JE, Lemanske RF Jr, Nicolae DL, Elias JA, Chupp GL. Effect of variation in CHI3L1 on serum YKL-40 level, risk of asthma, and lung function. N Engl J Med 2008; 358:1682-91.
11.Shuhui L, Mok YK, Wong WSF: Role of mammalian chitinases in asthma. Int Arch Allergy Immunol 2009; 149: 369–377.
12.
Bargagli E, Olivieri C, Margollicci M, Bennett D, Luddi A, Perrone M, Maggiorelli C, Prasse A, Rottoli P. Serum chitotriosidase levels in patients with allergic and non-allergic asthma. Respiration 2010; 79:437–438.
13.Tang H, Fang Z, Sun Y, Li B, Shi Z, Chen J, Zhang T, and Xiu Q. YKL-40 in asthmatic patients, and its correlations with exacerbation, eosinophils and immunoglobulin E. Eur. Respir. J 2010; 35:757-760.
14.
Gomez JL, Yan X, Holm CT, Grant N, Liu Q, Cohn L, Nezgovorova V, Meyers DA, Bleecker ER, Crisafi GM, Jarjour NN, Rogers L, Reibman J, Chupp GL; SARP Investigators.
Characterisation of asthma subgroups associated with circulating YKL-40 levels. Eur Respir J 2017; 50:1700800 {https//doi.org/10.1183/13993003.00800-2017}.
15.Hong JY, Kim M, Sol IS, Kim KW, Lee CM, Elias JA, Sohn MH, Lee CG. Chitotriosidase inhibits allergic asthmatic airways via regulation of TGF-ß expression and Foxp3+ Treg cells. Allergy 2018; 73:1686-1699.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|