|
Asma
TIPOS DE ASMA
ASMA E EXERCÍCIO — Broncoconstrição Induzida pelo Exercício
Aretaeus da Cappadócia definiu pela primeira vez a asma desencadeada pelo esforço físico e esportes – "Se devido a corrida, exercícios de ginástica ou qualquer trabalho, a respiração se tornar difícil, chama-se asma."1 O exercício é um dos mais comuns precipitantes da asma, ocorrendo após esforços vigorosos, capazes de elevar a frequência cardíaca a 170–180 bpm e a ventilação acima de 200 l.min-1, com aumento no consumo de oxigênio (VO2) de 6–85%. A prevalência de sintomas ao esforço em pacientes com asma varia de 40 a 90%,1-4 enquanto na população em geral oscila entre 5–20%.4-8 Esse evento foi inicialmente denominado asma induzida por exercício (AIE),9 posteriormente broncospasmo induzido por exercício10 e finalmente em 1970 broncoconstrição induzida pelo exercício (BIE).11 A BIE pode ocorrer em qualquer idade, sendo mais frequente em adolescentes e adultos jovens que praticam esportes, especialmente corridas de média distância, embora possa ocorrer quando de ginástica ou mesmo dançando, desde que o exercício seja contínuo. A BIE pode ser desencadeada também pela subida de vários lances de escada. Crianças com rinite apresentam propensão seis a oito vezes maior de apresentar BIE do que aquelas sem rinite.
A asma é o principal fator comórbido associado à BIE e se pressupõe que a BIE ocorra em aproximadamente 90% dos pacientes com asma.4,12
O exercício por si só não é essencial e serve apenas como meio de aumentar a ventilação. Para que a crise se produza, torna-se necessário que a ventilação atinja 60% ou mais da ventilação máxima, e que o esforço se mantenha por seis a oito minutos.13 A BIE relaciona-se ao tipo de atividade física, à sua duração e às condições ambientais. Um exercício curto, de 30 segundos ou 1–2 minutos, repetidos a curtos espaços, tende a impedir o aparecimento da asma pós-exercício. Os exercícios com os braços normalmente causam menos broncospasmo do que os que utilizam as pernas, sendo a incidência de BIE menor nos esportes coletivos, como o futebol, onde o esforço é intermitente.
Corrida livre ou em esteira rolante são os esforços que mais provocam a reação brônquica, enquanto que a crise quase nunca se apresenta após o esforço desenvolvido na natação (ambiente úmido). Quando ocorre broncospasmo durante a natação, este pode estar relacionado à exposição ao cloro das piscinas (cloraminas), principalmente quando estas se encontram em ambientes fechados. Corridas em atmosferas secas e frias tendem a gerar crises, ao contrário de atmosferas úmidas e quentes encontradas em países tropicais.
Atletas de resistência têm o potencial de inalar mais substâncias nocivas para os pulmões, pois ficam expostos a essas condições por períodos de tempo mais longos.
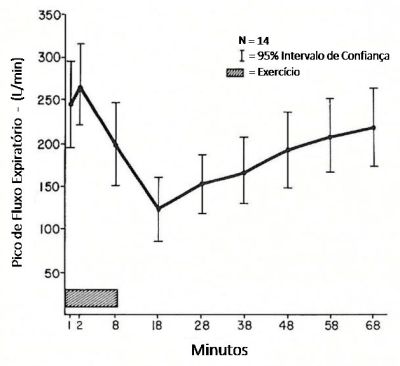 A obstrução é um fenômeno agudo, ocorre imediatamente após o término do exercício, atinge o pico máximo em cinco a 10 minutos e regride, espontaneamente, com restabelecimento total em 30 a 90 minutos e induzem um período refratário de 1 a 3 horas, onde o exercício contínuo não produz broncoconstrição (Figura 1). A obstrução é um fenômeno agudo, ocorre imediatamente após o término do exercício, atinge o pico máximo em cinco a 10 minutos e regride, espontaneamente, com restabelecimento total em 30 a 90 minutos e induzem um período refratário de 1 a 3 horas, onde o exercício contínuo não produz broncoconstrição (Figura 1).
A recuperação geralmente é mais lenta nos adolescentes do que em crianças. Durante o exercício, o paciente está relativamente protegido, pelo aumento do drive de catecolaminas que ocorre durante o esforço e também pela redução do tônus brônquico. Esta curta proteção cessa tão logo termina o esforço, quando se inicia a broncoconstrição.
Uma clássica característica da BIE, e ainda não completamente compreendida, é o período refratário a novos estímulos, que ocorre por algumas horas após o exercício. Se um asmático desenvolve BIE e se recupera espontaneamente dentro de uma hora, um novo exercício resulta em marcante redução da BIE em cerca de 50% dos pacientes. A BIE é causada, em parte, pelo leucotrieno D4 liberado nas vias aéreas. Estudos sugerem que o LTD4 liberado nas vias aéreas de pacientes com asma, em decorrência do exercício, estimula a lenta liberação de prostaglandinas broncodilatadoras, como a PGE2 que relaxa o músculo liso brônquico e vascular.14
A gravidade da asma depende do grau de hiper-responsividade brônquica como um todo e como consequência de fatores que possam alterá-la, como estimulação alérgica e infecções virais. O exercício por si só, ao contrário da asma desencadeada por alérgenos, não aumenta a responsividade brônquica.15
O diagnóstico depende fundamentalmente dos sintomas relatados pelo paciente ou atleta. Existe uma grande variedade de protocolos através de testes de broncoprovocação indiretos que incluem testes de hiperventilação eucápnica e induzidos por exercício, utilizando esteiras ou bicicletas ergométricas com programação de duração, intensidade do esforço, frequência cardíaca máxima, níveis de lactato, medidas da temperatura e umidade do ar inspirado etc. Entretanto, para minimizar testes falso-negativos e aumentar a probabilidade de se detectar a BIE, é fundamental que a intensidade do exercício seja adequada para elevar a ventilação e a frequência cardíaca para o nível desejado nos primeiros 2–3 minutos de atividade. Essa intensidade deve ser mantida por pelo menos 4 minutos em crianças e entre 5 e 6 minutos em adultos. Na prática, isso costuma ser mais fácil de alcançar correndo em uma esteira do que pedalando.16
Teste de Exercício
Um teste estandartizado para o diagnóstico da BIE, utilizado principalmente em atletas, emprega esteira ergométrica, com inclinação de 5,5%. A velocidade é rapidamente aumentada até alcançar, em estado estável, uma frequência cardíaca de ~85% da frequência máxima prevista – acima deste valor ocorre maior liberação de catecolaminas que pode estimular a broncodilatação, resultando em diagnóstico falso negativo ou fadiga em certos indivíduos, que não conseguem completar o exercício prescrito – mantendo-se o esforço por 4–6 minutos. A frequência cardíaca máxima é calculada pela fórmula: 220 – idade do paciente. A frequência cardíaca é medida através de dispositivos eletrônicos como o Sport-Tester PE 3000 (Polar Electro Oy, Kempele, Finlândia). O teste é efetuado em ambiente a ~20ºC com umidade relativa do ar ~40%. Antes da corrida, uma espirometria é efetuada com pelo menos três medidas da Capacidade Vital Forçada (CVF), retendo-se a de maior valor como parâmetro para posterior comparação. A CVF é repetida após o esforço aos 3, 6, 10, 15 e 20 minutos. Entre os parâmetros que avaliam a obstrução através da CVF utiliza-se principalmente o Volume Expiratório Forçado no primeiro segundo (VEF1), considerado o parâmetro mais confiável na determinação da obstrução, pela simplicidade de sua obtenção e pela reprodutibilidade.17
Outro
protocolo18 consta de um teste estandartizado utilizado tanto para crianças como para adultos, dos 6 aos 50 anos, que emprega esteira ergométrica, com inclinação de 2,5%.
O teste é efetuado em ambiente a 20–30ºC com umidade relativa do ar ~40%. Os indivíduos começam caminhando e depois progridem para corrida, com esteira ajustada para velocidade de 2,5 mph e inclinação de 2,5%.
A velocidade e a inclinação são aumentadas ao longo de 2 minutos para que a frequência cardíaca atinja 80-90% do máximo previsto (220 bpm menos idade em anos) e então seja mantida por 6 minutos para uma duração total de 8 minutos do exame.
Essa intensidade precisa ser mantida por ≥4 minutos em crianças e 5 ou 6 minutos em adultos, com o objetivo de se atingir taxa de ventilação >17,5 vezes o valor do VEF1. O VEF1 é avaliado no
pré e pós-exercício aos 5, 10, 15 e 30 minutos. O teste será considerado positivo quando houver queda de ≥10% no VEF1.
Hiperpneia Voluntária Eucápnica
O teste de Hiperventilação Voluntária Eucápnica (HVE) foi desenvolvido inicialmente pelos militares para avaliação de jovens soldados da ativa quando de dispneia inexplicável. O teste HVE foi desenvolvido como um substituto para o teste de exercício para testar a BIE.19 O teste indireto de HVE é um teste análogo ao efetuado pelo exercício prolongado em termos de magnitude, sendo mais adequado para detectar BIE em atletas com função respiratória normal.20,21 O teste exige que o indivíduo respire ar seco a uma taxa de ventilação superior à máxima normalmente alcançada durante o exercício pela maioria das pessoas, com o objetivo de minimizar a ocorrência de resultados falso-negativos. Por proporcionar um estímulo intenso, a HVE pode induzir quedas significativas no VEF1, tornando o teste especialmente indicado para diagnosticar BIE em indivíduos com função pulmonar normal que praticam exercícios regularmente e em alta intensidade, como atletas de elite.
Este protocolo não é recomendado para identificar BIE em asmáticos já conhecidos que são sintomáticos ou não controlados ou cuja função pulmonar não é normal.
Em atletas asmáticos, a HVE é recomendada pela American Thoracic Society (ATS) e European Respiratory Society (ERS) para avaliar BIE, pois simula condições respiratórias extremas enfrentadas durante esportes de alta intensidade.22
O teste consiste em respirar ar seco de um cilindro contendo cerca de 5% de CO2, 21% de O2 e 74% de N2, mantendo uma ventilação de 21 a 30 vezes o VEF1, equivalente a 60% a 80% da ventilação voluntária máxima (VVM), durante 6 minutos. Enquanto atletas de elite geralmente alcançam facilmente 25 vezes o VEF1, a maioria dos asmáticos consegue manter 21 vezes o VEF1. O teste é considerado diagnóstico para asma em 81% dos casos.16 A temperatura e o nível de ventilação podem variar para simular condições do esporte. Embora o indivíduo possa inalar diretamente de uma válvula de demanda, essas válvulas fornecem resistência inspiratória significativa a altas taxas de fluxo. Assim, o ar liberado do cilindro é coletado em uma bolsa de Douglas e inalado através de válvula unidirecional de baixa resistência como ilustra a Figura 2.
Obtém-se uma espirometria basal pré-teste e ao final aos 5, 10 e 15 minutos após a interrupção. Se ocorrer queda ≥10% no VEF1 o teste é considerado positivo.23,24 Este protocolo é relevante para o teste de atletas com um valor de VEF1 maior que 75% do previsto para sexo, idade e altura. O teste de HVE demonstrou valores preditivos positivos de 89% e negativos de 91% para detectar asma em 44 atletas paraolímpicos25 e provocou broncoconstrição com reprodutibilidade em homens fisicamente ativos com asma diagnosticada por médico.26 Entretanto, o HVE foi comparado a exercícios e outros estímulos e agora está bem estabelecido para avaliar atletas de elite.23, 27-30
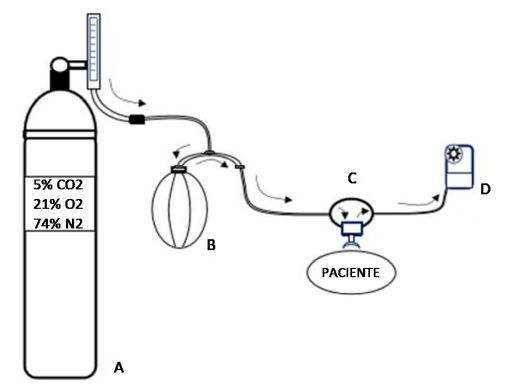
Figura 2 — Sistema para o teste de provocação para o diagnóstico da BIE pelo teste de provocação pela hiperpneia voluntária eucápnica (HVE). A – Cilindro com mistura de gases; B – Bolsa de Douglas; C – Válvula unidirecional; D – Ventilômetro.
|
Na prática utilizam-se os chamados “testes de campo” que simulam atividades físicas em ambientes externos. O advento de espirômetros portáteis que simplificaram os testes, e a sua crescente utilização expandiu em muito as suas aplicações. A sensibilidade pode ser menor em comparação a testes padronizados em laboratório, visto que a intensidade do esforço e as condições ambientais podem variar.
A avaliação é efetuada através de corrida livre de 6 a 8 minutos. O exercício deve ser curto, mais intenso e que provoque alta ventilação (> 60% no máximo). Como no teste de esteira a CVF é efetuada antes da corrida, sendo repetida após o esforço aos 1, 5, 10, 15 e 30 minutos para avaliação do VEF1.
Vários índices têm sido propostos para quantificar os efeitos do esforço sobre a asma, sendo o mais utilizado aquele que se baseia no percentual de queda do VEF1 basal, pré-provocação pelo esforço.
Valores na queda do VEF1 maior que 10–15% têm sido utilizados 'arbitrariamente' para diagnosticar a BIE,31-34 porém sem justificativa estatística.35 Deal et al.36 e Rupp et al.37 sugeriram 15–20% de queda do VEF1, como um apropriado ponto de corte. Outros preconizam 15% de queda na prova de campo e 10% para os testes em laboratório.36,38
O teste de provocação por HVE é um método bem estabelecido e sensível para determinar o grau de broncoconstrição em Serviços de Fisiopatologia Respiratória de provas de função pulmonar e Clínicas Especializadas. Embora a maioria dos laboratórios poderia facilmente adaptar a sua aparelhagem de ergometria para um circuito semelhante, estes procedimentos às vezes não são viáveis. A necessidade para se obter um diagnóstico objetivo de asma irá determinar a melhor opção/estratégia de teste. Assim, para os atletas de elite, a HVE é o teste mais sensível para se identificar a BIE, sendo considerado o "padrão gold" e deve ser o teste de escolha.
Entretanto, os testes de provocação osmóticos (p. ex. solução salina hiperosmolar e manitol) através de aerossol podem ser aplicados inicialmente e, se forem negativos, o atleta será encaminhado ao teste de HVE. Os atletas que necessitam do Certificado para utilização de medicamentos (TUE) para a asma, o teste de manitol e solução salina hipertônica são reconhecidos pelo COI e WADA como adequados para identificar asma. O teste de provocação pelo manitol parece oferecer especificidade e sensibilidade semelhantes às do HVE39,40 e é talvez o teste de broncoprovocação de mais fácil execução, pois não requer nenhum equipamento além de um espirômetro.41 Metacolina e histamina também são aceitos pelo COI e WADA para identificar a hiper-responsividade brônquica (HRB).42
Manitol
Tem aumentado a utilização do manitol nos testes de broncoprovocação. O manitol induz à broncoconstrição através da alteração da osmolaridade do epitélio do trato respiratório superior. A variação da osmolaridade resulta na ativação e desgranulação dos mastócitos, bem como dos eosinófilos, mimetizando a inflamação ativa das vias respiratórias.43 Esta substância é aplicada através de um inalador de pó seco, utilizando-se doses progressivas que são duplicadas a cada inalação variando de 5 a 160 mg.
Como um teste de broncoprovocação indireto, o manitol não causa contração somente de forma direta do músculo liso brônquico, como o fazem a inalação da histamina e metacolina. O manitol atua indiretamente nas células inflamatórias, principalmente nos mastócitos, induzindo à liberação de mediadores como prostaglandina D2, leucotrieno E4 e histamina. Em indivíduos com hiper-responsividade à exposição a estes mediadores estimularão receptores específicos determinando a contração da musculatura lisa brônquica levando ao broncospasmo.
O protocolo mais utilizado é o de Anderson et al.44 Este protocolo consiste na inalação inicial de uma cápsula "vazia" que funciona como um placebo – medida basal; seguem-se inalações de 5, 10, 20, 40, 80, 160, 160 e 160 mg de manitol, alcançando-se uma dose cumulativa máxima total de 635 mg. As doses de 80 e 160 mg são administradas em múltiplos de cápsulas de 40 mg (2 x 40 e 4 x 40 mg).
Duas medidas do VEF1 são efetuadas cerca de 60 segundos após cada dose, retendo-se o valor mais alto do VEF1. Se o indivíduo apresenta uma queda do VEF1 > 10% em resposta a uma dose, esta é então repetida.
O teste de broncoprovocação é considerado positivo e interrompido quando ocorre uma queda de 15% no VEF1 ou uma redução de 10% no VEF1 entre duas doses consecutivas de manitol. É considerado negativo quando a dose cumulativa total de 635 mg é alcançada e o VEF1 não caiu ≥ 15% em relação ao valor basal. O VEF1 basal utilizado para calcular o percentual de queda do VEF1 é aquele medido inicialmente com a cápsula placebo (0 mg). O teste é bem tolerado, podendo causar tosse e/ou garganta seca, sendo um eventual broncospasmo revertido com inalação de 200 mcg de salbutamol.
O manitol PD15 pode ser usado para classificar a gravidade da hiper-responsividade indireta como leve >155 mg, moderada entre 35 e 155 mg ou grave ≤35 mg.45-47
O tempo médio para um teste de manitol positivo é < 18 min e para um teste negativo < 27 min. O teste de broncoprovocação é comercializado atualmente em 23 países utilizando pó seco, sob o nome Aridol® ou Osmohale®, tendo sido aprovado por autoridades da Europa, Ásia, Austrália e EUA.16
Os testes de provocação com manitol não são muito bem tolerados pelas crianças e devem ser evitados, utilizando-se outros testes de provocação.
Muitos laboratórios abandonaram o teste de exercício para o diagnóstico do BIE, dando preferência à utilização de HVE ou outros substitutos para identificar BIE (Tabela 1). Os estímulos substitutos (hiperpneia voluntária eucápnica com ar seco e manitol) são de fácil execução.
Tabela 1 — Testes de Provocação que Podem Ser Usados como Substitutos para Exercício para Identificar BIE
● |
Esses estímulos podem ser facilmente repetidos para monitorar a resposta ao tratamento. |
● |
Esses estímulos são mais potentes que os exercícios, então resultados falsos negativos são menos prováveis. |
● |
Alguns testes (p. ex., manitol) são portáteis e fornecem um padrão operacional comum e podem ser realizados no local de atendimento. |
● |
Menos dispendioso em custos do que os testes de campo. |
Fisiopatologia
O ar inspirado é aquecido a 37ºC e umidificado com vapor d'água com pressão parcial de 47,07 mm H2O. A área de superfície da mucosa nasal gira em torno de 160 cm2 suprindo o ar inspirado de calor e vapor d'água durante a inspiração. À medida que a ventilação aumenta durante o esforço, ocorre o aumento da resistência inspiratória, passando a respiração a ser oral quando a ventilação eleva-se acima de 30 l/min, cabendo às vias aéreas intratorácicas a atribuição de aquecer e umidificar o ar inspirado.
O mecanismo pelo qual a perda de água e calor através da hiperventilação determina a BIE em indivíduos suscetíveis está relacionado à acelerada evaporação de água, determinando perda de calor da mucosa, com a finalidade de aquecer o ar frio inspirado ao nível da árvore traqueobrônquica, quando de ventilação minuto elevada. Quanto maior a quantidade de água e calor transferidos da mucosa brônquica maior será a resposta obstrutiva.48-51 O ar a 37ºC, totalmente saturado com vapor, contém 47 mg de H2O por litro de ar. No entanto, em um ambiente com temperatura de 22ºC, com umidade relativa do ar de 50%, cada litro de ar contém 22 mg de H2O. A – 10ºC, com 50% de umidade relativa cada litro de ar contém apenas 1 mg de H2O. Desta forma, atletas com alta ventilação minuto (> 280 l.min-1) perdem considerável quantidade de água durante o exercício, principalmente em ambientes secos e frios.
Acredita-se que a respiração rápida cause evaporação de água e aumento transitório da osmolaridade no líquido extracelular na superfície das grandes vias aéreas centrais, no chamado fluido periciliar, resultando em estimulação nervosa parassimpática reflexa, promovendo broncoconstrição e vasoconstrição reflexa de vênulas brônquicas para conservar calor. Admite-se que em resposta ao estresse osmótico e mecânico induzido pela intensa respiração o epitélio brônquico libere citocinas (p.ex. IL-6, IL-8), quimiocinas e eicosanoides como os leucotrienos que amplificam a inflamação e promovem broncoconstrição.
O epitélio atrai e ativa mastócitos, que liberam
mediadores químicos, como a histamina, os leucotrienos e a prostaglandina D2, os eosinófilos e outras células imunológicas, amplificando a resposta inflamatória.52,53
A broncoconstrição induzida pela hiperpneia em porquinhos-da-índia é um dos modelos animais mais utilizados no estudo da asma. Usando este modelo animal, Ray et al.54 puderam evidenciar a participação dos neuropeptídeos na patogênese da asma, decorrente da liberação de taquicininas pelos nervos sensoriais das vias aéreas. O pré-tratamento destes animais com capsaicina atenuava a broncoconstrição. O peptídeo relacionado ao Calcitonin Gene-related Peptide (CGRP) encontrado em células neuroendócrinas brônquicas atenua a broncoconstrição induzida pela hiperpneia nestes animais55 e parece modular as respostas mediadas pelo LTD4. Gerland et al.56 demonstraram em porquinhos-da-índia que os antagonistas de LTD4 ou o inibidor da 5-lipoxigenase eram capazes de reduzir em 50–90% a broncoconstrição induzida pela hiperpneia.
A 'asma induzida pelo exercício' deve ser distinguida de outras condições que causam sintomas respiratórios durante o exercício, como a obstrução fixa de vias aéreas centrais, prolapso laríngeo, certas patologias musculares e a disfunção das cordas vocais induzida pelo esforço.57 Outra condição é o estridor laríngeo inspiratório, esforço induzido ou disfunção das cordas vocais, patologia mais comum entre atletas femininas altamente treinadas, durante a adolescência. Este estridor, durante o exercício máximo, com o típico traçado de achatamento ao nível do pico da inspiração máximo na curva fluxo-volume, contrasta com a dispneia da BIE que sempre ocorre após o exercício e é expiratória devido à obstrução das vias respiratórias baixas.58 A dispneia durante o exercício também pode estar associada às condições subjacentes, como doença pulmonar obstrutiva crônica ou condições pulmonares restritivas (p. ex. obesidade), cardiopatias ou outras condições como a anafilaxia induzida pelo exercício, associada a prurido, urticária generalizada, angioedema, com repercussão hemodinâmica.59
A BIE não impede a prática normal de esportes, pois pode ser prevenida através da utilização de medicamentos, regulamentados pelos Comitês Olímpicos. Para maiores informações, consultar o site do World Anti-Doping Agency (WADA) – The Global Drug Reference Online (Global DRO) que fornece informações sobre quaisquer medicamentos.
Em termos de medicação para alergia ou asma, as drogas proibidas são as estimulantes (p. ex. descongestionantes orais como a pseudoefedrina). É proibida a utilização de corticoides sistêmicos, sendo que os corticoides inalatórios e por via nasal são permitidos.
Quanto aos b2-agonistas só há autorização para o emprego por inalação, pois, o seu uso por via sistêmica apresenta efeito anabolizante comprovado. Em animais, foi demonstrado que o ß2-agonista clenbuterol, por via oral e em altas doses, pode causar aumento da massa muscular.17
O Comitê Olímpico Internacional (COI) em 2010 classificou os b2-agonistas como agentes anabolizantes e estimulantes. Os b2-agonistas não são esteroides anabolizantes, mas têm efeitos anabólicos. Experimentos em animais com clenbuterol oral mostraram aumento do volume muscular em várias espécies,60,61 porém estudos em humanos não confirmaram aumento semelhante da massa muscular em homens saudáveis.62
Os b2-agonistas por inalação estão liberados, o salbutamol na dose de 1600 mcg/24 h e o formoterol na dose de 54 mcg por dia. A dose do salmeterol máxima é de 200 mcg/24 h. O uso das três substâncias requer apenas declaração de uso. A utilização de qualquer outro b2-agonista requer um documento cuja sigla em inglês é TUE (Therapeutic Use Exemption). A presença de salbutamol na urina acima de 1000 ng/ml e do formoterol maior que 40 ng/ml presume-se como NÃO sendo com intenções terapêuticas e pode ser considerado como um achado analítico adverso ou uma violação às regras anti-doping.42 O vilanterol por inalação até a dose máxima recomendada pelo fabricante de 25 mcg durante 24 horas não é proibido. Para doses superiores a 25 mcg/24 h, deve ser solicitada uma declaração de uso.42 Todos os corticoides por inalação são permitidos no esporte. Na Tabela 2 são apresentadas as percentagens de atletas em algumas olimpíadas até 2008 em uso de b2-agonistas e corticoides por inalação.63
Tabela 2 — Percentagem de Atletas Utilizando Beta-Agonistas e Corticoides por Inalação
Jogos Olímpicos |
ß2-agonistas + CI |
● Atlanta 1996 |
46,1% |
● Atenas 2004 |
69,9% |
● Turim 2006 |
77,2% |
● Pequim 2008 |
87,2% |
.
Tabela 3 — Outros Tratamentos para Asma Permitidos
Tratamentos para Asma sem Restrições |
● Antagonista de Receptor de Leucotrieno |
● Anticolinérgicos |
● Agentes Anti-IgE |
● Anti-IL-5 |
● Cromonas |
A presença de asmáticos nos esportes pode ser bem avaliada pelo desempenho da equipe dos EUA nos XXIII Jogos Olímpicos de Los Angeles em 1984. Da equipe de 597 atletas, 67 (11,2%) eram asmáticos (42% F e 58% M) participantes das mais variadas formas de esporte, sendo que estes obtiveram cerca de 41 medalhas, sendo 15 de ouro, 20 de prata e 6 de bronze.64 Nesta olimpíada, o Dr. Robert Voy do Comitê Olímpico dos Estados Unidos (USOC), utilizando atletas selecionados com asma, efetuou testes de "provocação" com exercício, empregando o teste em esteira, obtendo reduções do VEF1 que oscilavam entre 16–35%.65 Dos 699 atletas que participaram dos Jogos Olímpicos em Atlanta no ano de 1996 e que responderam ao Questionário de Avaliação Médica do USOC, 107 (15,3%) relatavam um diagnóstico prévio de asma e 97 (13%) informavam a prescrição de medicamentos para a asma no passado.66 Cerca de 10% dos atletas foram rotulados como portadores de asma ativa, pois utilizavam de forma contínua ou intermitente, medicação para a doença durante a participação naqueles jogos olímpicos. A prevalência de asma ativa oscilava de 45% no ciclismo, 26% na natação, até 0% no halterofilismo. Nos Jogos Olímpicos de Vancouver em 2010 o percentual de atletas com asma correspondeu a 7,1% do total, sendo que 11,6% das medalhas individuais foram conquistadas por atletas com asma.63
A intensidade e frequência da BIE variam nos diferentes esportes (Tabela 4).
Tabela 4 — Esportes Associados à BIE
Maior Frequência de BIE (Atividades com Alta Ventilação Minuto) |
Menor Frequência de BIE |
| ● Futebol |
● Corridas de longa distância |
● Ginástica rítmica |
| ● Hóquei no gelo |
● Ciclismo |
● Caminhada |
| ● Basquete |
● Patinação no gelo |
● Tênis |
| ● Polo aquático |
● Mountain biking |
● Golfe |
| ● Remo |
● Maratona de esqui |
● Levantamento de peso |
| ● Triatlo |
● Rúgbi |
● Caratê |
| ● Cross-country |
● Pentatlo moderno |
● Esgrima |
| |
|
● Softball |
Estudos relataram prevalência de BIE entre atletas de elite ou de nível olímpico de 30 a 70%,4,67 mas os relatos variam dependendo do ambiente em que o esporte é praticado, do tipo de esporte e da intensidade máxima alcançada.12 A BIE predomina em vários desportos olímpicos e afeta quase um em cada quatro atletas de elite dos desportos de inverno, mais dominante em atletas do sexo feminino, sendo o esporte com maior incidência o esqui cross-country.68
 O esporte com maior prevalência para a asma é o esqui cross country (Figura 4). Trata-se de um esporte de inverno em que os atletas realizam a maratona percorrendo grandes distâncias em clima excessivamente adverso. É uma das modalidades do esqui nórdico, prova de resistência, de longa duração, com elevada demanda aeróbica e alta ventilação minuto com inalação de ar frio e seco durante o treinamento e a competição. Este faz parte dos Jogos Olímpicos de Inverno. Na disputa masculina, existem provas individuais de 10, 15, 30 e 50 km, e entre as mulheres 5, 10, 15 e 30 km. O esporte com maior prevalência para a asma é o esqui cross country (Figura 4). Trata-se de um esporte de inverno em que os atletas realizam a maratona percorrendo grandes distâncias em clima excessivamente adverso. É uma das modalidades do esqui nórdico, prova de resistência, de longa duração, com elevada demanda aeróbica e alta ventilação minuto com inalação de ar frio e seco durante o treinamento e a competição. Este faz parte dos Jogos Olímpicos de Inverno. Na disputa masculina, existem provas individuais de 10, 15, 30 e 50 km, e entre as mulheres 5, 10, 15 e 30 km.
Outros esportes, patinação artística, hóquei no gelo e patinação de velocidade além do exercício, têm a agravante de expor os atletas à inalação de substâncias potencialmente nocivas ao organismo (especialmente os pulmões) como o óxido de nitrogênio e o monóxido de carbono liberados pelos Zambonis (máquinas que aplainam as pistas e rinques de patinação) das arenas para patinação artística, hóquei no gelo, patinação de velocidade ou curling. Ocorre ainda a exposição pela liberação de gases dos mecanismos de refrigeração dos sistemas de gelo, também fontes de toxicidade, como amônia, fluorocarbonos e etilenoglicol. Já os nadadores, são expostos aos compostos orgânicos de cloro – cloramina e tricloramina.
Quanto à estratégia de tratamento: Lazarinis et al.69 concluíram após estudo que a combinação de um CI e um ß2-agonista de longa ação (LABA) com rápido início de ação entre 1 e 3 minutos70— CI-formoterol — usado sob demanda é superior ao uso de um SABA inalado isolado na redução da BIE. Entretanto, segundo a GINA, o tratamento regular com corticoide inalatório reduz significativamente a BIE.71 O uso de doses regulares de ß2-agonistas, SABAs ou LABAs acima de dose única diária antes do exercício previne a BIE, todavia, pode determinar a redução na duração de sua ação. Esta resposta reduzida ao medicamento configura a tolerância medicamentosa.
A atual estratégia farmacológica para pacientes com BIE implica utilizar o CI-formoterol no pré-exercício. Esta associação é tão eficaz quanto o CI diário mais um SABA pré-exercício (salbutamol) na redução da BIE69 e não resulta em tolerância ou potencial perda de proteção contra BIE.
 Tratamento da Asma :: Situações Específicas - Tratamento da Broncoconstrição Induzida pelo Exercício Tratamento da Asma :: Situações Específicas - Tratamento da Broncoconstrição Induzida pelo Exercício
Referências
01.Adams F. – The extant works of Aretaeus, the Cappodician. London: The Sydenham Society; 1856:316–319.
02.McFadden ER Jr, Gilbert I.A. Exercise-induced asthma. N Engl J Med 1994; 330:1362-7.
03.Poppius H, Muittari A, Kreus KE, Korhonen O, Viljanen A. Exercise asthma and disodium cromoglycate. Br Med J 1970; 7;337-9.
04.Weiler JM, Bonini S, Coifman R, Craig T, Delgado L, Capão-Filipe M, Passali D, Randolph C, Storms W; Ad Hoc Committee of Sports Medicine Committee of American Academy of Allergy, Asthma & Immunology. American Academy of Allergy, Asthma & Immunology Work Group report: exercise-induced asthma. J Allergy Clin Immunol 2007;119:1349-58.
05.Caillaud D, Horo K, Baiz N, Banerjee S, Charpin D, Lavaud F, de Blay F, Raherison C, Annesi-Maesano I. Exercise-induced bronchospasm related to different phenotypes of rhinitis without asthma in primary schoolchildren: the French Six Cities Study. Clin Exp Allergy 2014; 44:858-66.
06.Kuti BP, Kuti DK, Omole KO, Mohammed LO, Ologun BG, Oso BI. Prevalence and factors associated with exercise-induced bronchospasm among rural school children in Ilesa, Nigeria. Niger Postgrad Med J 2017; 24:107-113.
07.Ng'ang'a LW, Odhiambo JA, Mungai MW, Gicheha CM, Nderitu P, Maingi B, Macklem PT, Becklake MR. Prevalence of exercise induced bronchospasm in Kenyan school children: an urban-rural comparison. Thorax 1998; 53:919-26.
08.Rundell KW, Im J, Mayers LB, Wilber RL, Szmedra L, Schmitz HR. Self-reported symptoms and exercise-induced asthma in the elite athlete. Med Sci Sports Exerc 2001; 33:208-13.
09.McNeill RS, Nairn JR, Millar JS, Ingram CG. Exercise-induced asthma. Q J Med 1966; 35:55-67.
10.Sly RM, Heimlich EM, Busser RJ, Strick L. Exercise-induced bronchospasm: effect of adrenergic or cholinergic blockade. J Allergy 1967; 40:93-9.
11.Fisher HK, Holton P, Buxton RS, Nadel JA. Resistance to breathing during exercise-induced asthma attacks. Am Rev Respir Dis 1970; 101:885-96.
12.Weiler JM, Anderson SD, Randolph C, Bonini S, Craig TJ, Pearlman DS, Rundell KW, Silvers WS, Storms WW, Bernstein DI, Blessing-Moore J, Cox L, Khan DA, Lang DM, Nicklas RA, Oppenheimer J, Portnoy JM, Schuller DE, Spector SL, Tilles SA, Wallace D, Henderson W, Schwartz L, Kaufman D, Nsouli T, Shieken L, Rosario N; American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. Pathogenesis, prevalence, diagnosis, and management of exercise-induced bronchoconstriction: a practice parameter. Ann Allergy Asthma Immunol. 2010 Dec;105(6 Suppl):S1-47.
13.Sadoul P. Maladies Chroniques des Bronches 100 Questions du Practicien. Nancy. Édité par Pil., 1982.
14.Manning PJ, Watson RM, O'Byrne PM. Exercise-induced refractoriness in asthmatic subjects involves leukotriene and prostaglandin interdependent mechanisms. Am Rev Respir Dis 1993; 148:950-4.
15.Zawadski DK, Lenner KA, McFadden ERJr. Effect of exercise on nonspecific airway reactivity in asthmatics. J Appl Physiol 1988; 64:812-6.
16.Anderson SD. Bronchial challange tests: usefulness, availability and limitations. Breathe 2011; 8:53-60.
17.Carlsen KH, Anderson SD, Bjermer L, Bonini S, Brusasco V, Canonica W, Cummiskey J, Delgado L, Del Giacco SR, Drobnic F, Haahtela T, Larsson K, Palange P, Popov T, van Cauwenberge P; European Respiratory Society; European Academy of Allergy and Clinical Immunology; GA(2)LEN. Treatment of exercise-induced asthma, respiratory and allergic disorders in sports and the relationship to doping: Part II of the report from the Joint Task Force of European Respiratory Society (ERS) and European Academy of Allergy and Clinical Immunology (EAACI) in cooperation with GA(2)LEN. Allergy 2008; 63:492-505.
18.Anderson SD, Pearlman DS, Rundell KW, Perry CP, Boushey H, Sorkness CA, Nichols S, Weiler JM. Reproducibility of the airway response to an exercise protocol standardized for intensity, duration, and inspired air conditions, in subjects with symptoms suggestive of asthma. Respir Res 2010; 11:120.
19.Phillips YY, Jaeger JJ, Laube BL, Rosenthal RR. Eucapnic voluntary hyperventilation of compressed gas mixture. A simple system for bronchial challenge by respiratory heat loss. Am Rev Respir Dis 1985; 131:31-35.
20.Anderson SD, Fitch K, Perry CP, Sue-Chu M, Crapo R, McKenzie D, Magnussen H. Responses to bronchial challenge submitted for approval to use inhaled ß 2 -agonists before an event at the 2002 winter olympics. J Allergy Clin Immunol 2003; 111:45-50.
21.Dickinson J, McConnell A, Whyte G. Diagnosis of exercise-induced bronchoconstriction: eucapnic voluntary hyperpnoea challenges identify previously undiagnosed elite athletes with exercise-induced bronchoconstriction. Br J Sports Med. 2011; 45:1126-31.
22.Fitch KD, Sue-Chu M, Anderson SD, Boulet LP, Hancox RJ, McKenzie DC, Backer V, Rundell KW, Alonso JM, Kippelen P, Cummiskey JM, Garnier A, Ljungqvist A. Asthma and the elite athlete: summary of the International Olympic Committee's consensus conference, Lausanne, Switzerland, January 22-24, 2008. J Allergy Clin Immunol 2008; 122:254-60, 260.e1-7.
23.Anderson SD, Argyros GJ, Magnussen H, Holzer K. Provocation by eucapnic voluntary hyperpnoea to identify exercise induced bronchoconstriction. Br J. Sports Med 2001; 35:344-347.
24.Argyros GJ, Roach JM, Hurwitz KM, et al. Eucapnic voluntary hyperventilation as a bronchoprovocation technique. Development of a standardized dosing schedule in asthmatics. Chest 1996; 109:1520-1524.
25.Osthoff M, Michel F, Strupler M, Miedinger D, Taegtmeyer AB, Leuppi JD, Perret C. Bronchial hyperresponsiveness testing in athletes of the Swiss Paralympic team. BMC Sports Sci Med Rehabil 2013; 5:7.
26.Williams NC, Johnson MA, Hunter KA, Sharpe GR. Reproducibility of the bronchoconstrictive response to eucapnic voluntary hyperpnoea. Respir Med 2015; 109:1262-1267.
27.Dickinson JW, Whyte GP, McConnell AK, Harries MG. Impact of changes in the IOC-MC asthma criteria: a British perspective. Thorax 2005; 60:629-32.
28.Rundell KW, Anderson SD, Spiering BA, Judelson DA. Field exercise vs laboratory eucapnic voluntary hyperventilation to identify airway hyperresponsiveness in elite cold weather athletes. Chest 2004; 125:909-15.
29.Holzer K, Anderson SD, Douglass J. Exercise in elite summer athletes: Challenges for diagnosis. J Allergy Clin Immunol 2002; 110:374-80.
30.Mannix ET, Manfredi F, Farber MO. A comparison of two challenge tests for identifying exercise-induced bronchospasm in figure skaters. Chest 1999; 115(3):649-53.
31.Anderson SD, Connolly NM, Godfrey S. Comparison of bronchoconstriction induced by cycling and running. Thorax 1971; 26:396-401.
32.Eggleston PA, Rosenthal RR, Anderson SA, Anderton CW, Bierman. Guidelines for the methodology of exercise challenge testing of asthmatics. J Allergy Clin Immunol 1979; 64:642-5.
33.Sterk RH, Fabbri LM, Quanjer PH, Cockcroft DW, O'Byrne PM, Anderson SD. Airway responsiveness. Standardized challenge testing with pharmacological, physical and sensitizing stimuli in adults. Eur Respir J 1993; 16:53-83.
34.Tan RA, Spector SL. Exercise-induced asthma. Sports Medicine 1998; 25:1-6.
35.Godfrey S. – Clinical and physiological features. In: E.R. McFadden. Exercise-Induced Asthma. New York: Marcel Davis; 1999: 11-45.
36.Deal EC, McFadden Jr ER, Ingram RH, Breslin FJ, Jaeger JJ. Airway responsiveness to cold air and hyperpnea in normal subjects and in those wit hay fever and asthma. Am Rev Respir Dis 1980; 121:621-8.
37.Rupp NT, Guill MF, Brudno DS. Unrecognized exercise-induced bronchospasm in adolescent athletes. Am J D i s Child 1992; 146:941-4.
38.Anderson SD, Holzer K. Exercise-induced asthma: is it the right diagnosis in elite athletes? J Allergy Clin Immunol 2000; 106:419-28.
39.Porsbjerg C, Sverrild A, Backer V. The usefulness of the mannitol challenge test for asthma. Expert Rev Respir Med 2013; 7:655-663.
40.Holzer K, Anderson SD, Chan H-K, Douglass J. Mannitol as a challenge test to identify exercise-induced bronchoconstriction in elite athletes. Am J Respir Crit Care Med 2003; 167:534-537.
41.Hostrup M, Hansen ESH, Rasmussen SM, Jessen S, Backer V. Asthma and exercise-induced bronchoconstriction in athletes: Diagnosis, treatment, and anti-doping challenges. Scand J Med Sci Sports 2023; 00:1–11.
42.TUE Physician Guidelines – Asthma - Version 9.0 - Dec 2021 -WADA - World Anti-Doping Program. Disponível em: https://www.wada-ama.org/sites/default/files/resources/files/tue_physician_guidelines_asthma_final_november_2021.pdf Arquivo capturado em: 22 de setembro de 2022.
43.Hughes JMB, Interpreting pulmonary function tests. Breathe 2009; 6:103-110.
44.Anderson SD, Brannan J, Spring J, Spalding N, Rodwell LT, Chan K, Gonda I, Walsh A, Clark AR. A new method for bronchial-provocation testing in asthmatic subjects using a dry powder of mannitol. Am J Respir Crit Care Med 1997; 156:758-765.
45.Anderson SD, Brannan JD. Methods for “indirect” challenge tests including exercise, eucapnic voluntary hyperpnea, and hypertonic aerosols. Clin Rev Allergy Immunol 2003; 24:27–54.
46. Anderson SD. “Indirect” challenges from science to clinical practice. Eur Clin Respir J 2016; 3:31096.
47.Brannan JD, Anderson SD, Perry CP, Freed-Martens R, Lassig AR, Charlton B; Aridol Study Group. The safety and efficacy of inhaled dry powder mannitol as a bronchial provocation test for airway hyperresponsiveness: a phase 3 comparison study with hypertonic (4.5%) saline. Respir Res 2005; 6:144.
48.McFadden ER Jr. Exercise-induced airway obstruction. Clin Chest Med 1995; 16:671-82.
49.Deal EV Jr, McFadden ER Jr, Ingram RH Jr, et al. The role of respiratory heat exchange in the production of exercise-induced asthma. J Appl Physiol 1979; 46:467-75.
50.Straus RH, McFadden ER Jr, Ingram RH Jr, et al. Influence of heat and humidity on the airway obstruction induced by exercise's. Clin Invest 1978; 61:433-40.
51.Straus RH, McFadden ER Jr, Ingram RH Jr, et al. Enhancement of exercise-induced asthma by coldair breathing. N Engl J Med 1977; 297:743-7.
52.Hallstrand TS. New insights into pathogenesis of exercise-induced bronchoconstriction. Curr Opin Allergy Clin Immunol 2012; 12:42-8.
53.Kippelen P, Anderson SD, Hallstrand TS. Mechanisms and Biomarkers of Exercise-Induced Bronchoconstriction. Immunol Allergy Clin North Am 2018; 38:165-182.
54.Ray DW, Hernandez C, Leff AR, Drazen JM, Solway J. Tachykinins mediate bronchoconstriction elicited by isocapnic hyperpnea in guinea pigs. J Appl Physiol 1989; 63:1108-12.
55.Takatiide N et al. Roles of calcitonin gene-related peptide (CGRP) in hyperpnea-induced constriction in guinea pigs. AMJ Respir Crit Car Med 1996; 154:1551-6.
56.Garland A, Jordan JE, Ray DW, Spaethe SM, Alger L, Solway J. Role of eicosanoids in hyperpnea-induced airway responses in guinea pigs. J Appl Physiol 1993; 75:2792-804.
57.McFadden ER, Zawadski DK. Vocal cord dysfunction masquerading as exercise-induced asthma: a physiologic cause for “choking” during athletic activities. Am J Respir Crit Care Med 1996; 153:942-7.
58.Couto M, Moreira A, Delgado L. Diagnosis and treatment of asthma in athletes. Breathe 2012; 8:286-296.
59.Weiler JM, Brannan JD, Randolph CC, Hallstrand TS, Parsons J, Silvers W, Storms W, Zeiger J, Bernstein DI, Blessing-Moore J, Greenhawt M, Khan D, Lang D, Nicklas RA, Oppenheimer J, Portnoy JM, Schuller DE, Tilles SA, Wallace D. Exercise-induced bronchoconstriction update-2016. J Allergy Clin Immunol 2016; 138:1292-1295.e36.
60.MacLennan PA, Edwards RHT, Effects of clenbuterol and propranolol on muscle mass. Biochem. J. 1989; 264:573-579.
61.Ricks CA, Dalrymple RH, Baker PK, Ingle DL. Use of a beta-agonist to alter fat and muscle deposition in steers. J. Anim. Sci. 1984; 59:1247-1255.
62.Caruso JF, Signorile JF, Perry AC, Leblanc B, Williams R, Clark M, Bamman MM. The effects pf albuterol and isokinetic execise on quadiceps muscle group. Medicine and Science in Sports and Exercise 1995; 27:1471-1476.
63.Fitch K. The World Anti-Doping Code: can you have asthma and still be an elite athlete? Breathe (Sheff) 2016; 12:148-58.
64.Pierson WE, Voy RO. Exercise-induced bronchospasm in the XXIII summer Olympic games. N Engl Reg Allergy Proc 1988; 9:209-13.
65.Voy RO. The U.S. Olympic Committee experience with exercise-induced bronchospasm. Med Sci Sports Exerc 1986; 18:328-30.
66.Weiler JM, Llayton T, Hunt M. Asthma in United States Olympic athletes who participated in the 1996 summer games. J Allergy Clin Immunol 1998; 102:722-6.
67.Parsons JP, Kaeding C, Phillips G, Jarjoura D, Wadley G, Mastronarde JG. Prevalence of exercise-induced bronchospasm in a cohort of varsity college athletes. Med Sci Sports Exerc 2007; 39:1487-92.
68.Wilber RL, Rundell KW, Szmedra L, Jenkinson DM, Im J, Drake SD. Incidence of exercise-induced bronchospasm in Olympic winter sport athletes. Med Sci Sports Exerc 2000; 32:732-7.
69.Lazarinis N, Jørgensen L, Ekström T, Bjermer L, Dahlén B, Pullerits T, Hedlin G, Carlsen KH, Larsson K. Combination of budesonide/formoterol on demand improves asthma control by reducing exercise-induced bronchoconstriction. Thorax 2014; 69:130-6.
70.Maesen FPV, Smeets JJ, Costongs MAI, van Noord JA, Zweers PG. The onset of action of inhaled formoterol by dry powder (abstract). Eur Respir J 1992; (5) Suppl 15.
71.Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2024.
72.
Sly R M. Exercise and the asthmatic child, Pediatrics Digest. 1972; 14:42.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|
|