|
Asma
TIPOS DE ASMA
ASMA ALÉRGICA — Alérgenos como Causa de Asma Sazonal e Perene
Cerca de 90% dos asmáticos entre 2 e 16 anos são alérgicos, 70% com menos de 30 anos também os são e cerca de 50% dos asmáticos maiores de 30 anos são concomitantemente alérgicos.1 O termo "alergia" foi introduzido em 1906 pelo pediatra vienense von Pirquet para designar a responsividade alterada do organismo. Ele observou que a introdução de uma substância externa em um tecido poderia alterar a sua responsividade quando de subsequente contato com a mesma substância. Modernamente este termo tem sido utilizado para designar uma forma anormal (hiper-responsividade) do organismo para responder aos estímulos antigênicos (antígenos), que são inativos em indivíduos normais.
Os alérgenos são em sua grande maioria proteínas solúveis em água ou glicoproteínas, apresentam diâmetro entre 2 e 60 µm, têm baixo peso molecular (5–50 kDa) e frequentemente apresentam propriedades aerodinâmicas (aeroalérgenos). Exercem em seu estado natural as funções de enzimas (p. ex. proteólise), podendo aumentar a permeabilidade das mucosas onde rapidamente penetram, desencadeando sintomas em pacientes alérgicos, estimulando a produção de anticorpos IgE. As respostas imunes aos alérgenos inalados incluem também anticorpos IgG, anticorpos IgA e células T. |
|
A atopia, com ou sem sintomas clínicos, é o fator de risco mais importante no desencadeamento da asma. O termo atopia vem do grego atopos que significa estranho e foi introduzido por A.F. Coca e R. Cooke2 em 1923, para descrever doenças alérgicas. A atopia é uma predisposição genética de certos indivíduos para a síntese inapropriada de IgE específica para componentes proteicos de aeroalérgenos ambientais inalados. Estudos recentes sugerem que a atopia esteja ligada a determinadas regiões de cromossomos, particularmente 11q e 5q.3-6 O risco de desenvolver asma é 10–20 vezes maior em atópicos do que em não atópicos. A atopia é uma síndrome familial que além da asma inclui a febre do feno (rinite atópica) e o eczema (dermatite atópica). Algumas doenças alérgicas, como a dermatite de contato e a pneumonite por hipersensibilidade, desenvolvem-se através de mecanismos IgE-independentes e são consideradas doenças alérgicas não atópicas.
Não existe uma definição geral aceita para atopia. Atopia pode ser definida como a predisposição genética para o desenvolvimento de reações de hipersensibilidade imediata contra antígenos ambientais comuns.
|
|
A atopia pode ser determinada, através de testes cutâneos (punctura, escarificação e intradérmico), pela IgE específica (RAST) para alérgenos comuns e pela dosagem da IgE sérica total, embora 40% dos asmáticos alérgicos se apresentem com valores IgE normais.7 A elevação da IgE não é um atributo somente da atopia, sendo encontrada em outras patologias como nas doenças parasitárias,8 no mieloma,9 nas doenças inflamatórias crônicas intestinais,10 na infecção pelo vírus do HIV,11 ou em doenças raras como a síndrome de Job.12 Além disso, fumantes13,14 e indivíduos expostos ao benzeno15 e à exaustão de motores a diesel apresentam maior propensão para a elevação da IgE sérica total.
A atopia é muito comum. Sua prevalência em adultos jovens com testes cutâneos positivos para a poeira doméstica ou pólens varia entre 40 e 50%.16,17 Como resultado da alta prevalência, 1/5 dos casamentos pode ocorrer entre dois atópicos, e parcela considerável da população terá dois ou mais genes que predispõem a atopia. A propensão individual para atopia e asma é geneticamente determinada, porém as grandes variações regionais na atopia e asma são decorrentes de fatores ambientais.
Indivíduos com uma doença atópica geralmente têm outras doenças atópicas e evolução para doenças alérgicas, incluindo asma ou rinite, o que é conhecido como marcha atópica.18
Na Tabela 1 estão os oito principais fatores associados a um maior risco para doenças alérgicas mediadas via IgE. Riscos adicionais são o tabagismo e exposição a alérgenos durante a gravidez.
Tabela 1 — Fatores de Risco Para Doenças Atópicas
Fatores de Risco para Doenças Atópicas |
1 - História familiar de alergia |
2 - Sexo masculino |
3 - Baixo peso ao nascer |
4 - História de tabagismo materno |
5 - Família pequena |
6 - Boas condições de higiene |
7 - Alto status socioeconômico dos pais |
8 - Baixa incidência de infecções durante a primeira infância |
A alergia como causa de asma deve ser cogitada quando:
➢ Existir história familiar de doenças alérgicas
➢ Houver sazonalidade nas crises de asma ou exacerbações relacionadas a alergenos conhecidos (relação de causa e efeito)
➢ Existir concomitância com rinite alérgica ou outra doença alérgica
➢ Houver eosinofilia no sangue periférico – 300 a 1.000 mm3 ou presença de eosinófilos no escarro
➢ O
paciente apresentar menos de 40 anos, embora pacientes com asma tardia possam apresentar concomitância alérgica
➢ Vários aeroalérgenos, dentre eles os pólens, podem desencadear a asma. Devido ao seu pequeno tamanho, abundante produção e distribuição onipresente, os pólens representam uma causa importante de doença alérgica sazonal, incluindo também a rinite alérgica.
 A característica primordial da polinose reside no caráter estacional dos sintomas. Na realidade, os sintomas só aparecem na época da floração das plantas alergógenas e daí o caráter sazonal das polinoses. Em grande parte do Brasil, a época da floração da maioria das plantas se faz no período das chuvas, motivo pelo qual os pólens de algumas plantas anemófilas encontradas em profusão não atingem grandes concentrações na atmosfera. A época de melhor insolação e quase sem chuvas vai de maio a agosto, ocasião em que floresce o capim gordura (Melinis minutiflora), capaz de atingir razoáveis concentrações de pólens na atmosfera de maneira contínua e uniforme. A partir de outubro até janeiro são encontrados pólens de árvores, atribuídos ao Ligustrum japonicum. Os pólens de eucalipto podem ser encontrados em épocas diversas, em pequena quantidade. Pólens de gramíneas também são encontrados entre outubro e março, particularmente em fins de janeiro, fevereiro e março. Na região sul do Brasil, os pólens das gramíneas são os principais alérgenos de origem vegetal que participam de quadro de atopia (Figura 1). Na Tabela 2 são apresentadas as plantas brasileiras com maior potencial alergênico. A característica primordial da polinose reside no caráter estacional dos sintomas. Na realidade, os sintomas só aparecem na época da floração das plantas alergógenas e daí o caráter sazonal das polinoses. Em grande parte do Brasil, a época da floração da maioria das plantas se faz no período das chuvas, motivo pelo qual os pólens de algumas plantas anemófilas encontradas em profusão não atingem grandes concentrações na atmosfera. A época de melhor insolação e quase sem chuvas vai de maio a agosto, ocasião em que floresce o capim gordura (Melinis minutiflora), capaz de atingir razoáveis concentrações de pólens na atmosfera de maneira contínua e uniforme. A partir de outubro até janeiro são encontrados pólens de árvores, atribuídos ao Ligustrum japonicum. Os pólens de eucalipto podem ser encontrados em épocas diversas, em pequena quantidade. Pólens de gramíneas também são encontrados entre outubro e março, particularmente em fins de janeiro, fevereiro e março. Na região sul do Brasil, os pólens das gramíneas são os principais alérgenos de origem vegetal que participam de quadro de atopia (Figura 1). Na Tabela 2 são apresentadas as plantas brasileiras com maior potencial alergênico.
Tabela 2 — Classificação das Plantas Brasileiras com Potencial Alergênico
 Nos meses da primavera são mais intensos os pólens de árvores, os das gramíneas ocorrem no verão e os de outros arbustos no outono e verão. Nas regiões setentrionais temperadas os alérgenos de árvores como a bétula, o Bet v1 (Betula verrucosa) são os mais frequentes assim como os pólens de gramíneas como o Ph1 p 1 e Ph1 p 5 e de outros herbáceos como Amb a 1, 2, 3, 5 e 6 (Ambrosia artemisiifolia) e Amb t 5 (Ambrosia trifida).
As áreas costeiras tendem a ter menor número de pólen. Nos meses da primavera são mais intensos os pólens de árvores, os das gramíneas ocorrem no verão e os de outros arbustos no outono e verão. Nas regiões setentrionais temperadas os alérgenos de árvores como a bétula, o Bet v1 (Betula verrucosa) são os mais frequentes assim como os pólens de gramíneas como o Ph1 p 1 e Ph1 p 5 e de outros herbáceos como Amb a 1, 2, 3, 5 e 6 (Ambrosia artemisiifolia) e Amb t 5 (Ambrosia trifida).
As áreas costeiras tendem a ter menor número de pólen.
Na sociedade moderna, ocorre uma grande concentração habitacional nas metrópoles, com predomínio do estilo de vida sedentário e de confinamento, gastando-se maior parte do tempo (90%) no ambiente interior das moradias, do trabalho ou no lazer, e 5% adicionais em transporte.19 Este fato contribuiu para o aumento da prevalência da asma (atópica) alérgica, devido ao contato mais prolongado com os chamados alérgenos domésticos, desencadeando o que hoje chamamos de asma perene.
 A importância da poeira doméstica (Figura 2) como fonte de alérgenos é descrita desde 1920 porém, nenhum de seus alérgenos foi estudado em detalhes antes de 1965. A poeira doméstica é formada por vários compostos orgânicos e inorgânicos, incluindo fibras, esporos de fungos, pólens, insetos, descamação de pele animal, fezes de insetos, ácaros e fezes de ácaros. Voorhorst e Spieksma20 relataram estreita relação entre a alergia à poeira doméstica e a concentração de ácaros na poeira, e que quando o nível de alérgenos aumenta eleva-se também a concentração de ácaros, sugerindo que o alérgeno é secretado ou excretado. A importância da poeira doméstica (Figura 2) como fonte de alérgenos é descrita desde 1920 porém, nenhum de seus alérgenos foi estudado em detalhes antes de 1965. A poeira doméstica é formada por vários compostos orgânicos e inorgânicos, incluindo fibras, esporos de fungos, pólens, insetos, descamação de pele animal, fezes de insetos, ácaros e fezes de ácaros. Voorhorst e Spieksma20 relataram estreita relação entre a alergia à poeira doméstica e a concentração de ácaros na poeira, e que quando o nível de alérgenos aumenta eleva-se também a concentração de ácaros, sugerindo que o alérgeno é secretado ou excretado.
O maior problema na investigação do ambiente interno ocorre pelo fato de que as partículas que carreiam os alérgenos não são identificáveis através de microscopia ótica, não ocorrendo no ambiente interno o equivalente a contagem ambiental de pólens. A avaliação da exposição a alérgenos no interior das casas depende de imunoensaios sensíveis os quais podem também apresentar importante papel na estandardização dos extratos de alérgenos. Utilizam-se os mAbs de alta afinidade para determinados alérgenos que permitem medir nanogramos destas proteínas.
A única forma pela qual um alérgeno pode ser transportado pelo ar é acoplado a partículas, sendo que as propriedades aerodinâmicas destas partículas é que vão definir como os alérgenos serão inalados. Desta forma a poeira que contém alérgenos dos ácaros e das baratas se precipitam mais rapidamente após a agitação do ar decorrente do uso de aspiradores de pó ou após os procedimentos para se "fazer a cama". Estes alérgenos são encontrados principalmente em superfícies e em menor quantidade em suspensão no ar, o que não ocorre com os alérgenos dos cães e gatos, que flutuam por períodos muito mais longos após a movimentação do ar ambiente. A deposição das partículas inaladas no epitélio depende da via (nasal ou oral), velocidade da corrente aérea e do tamanho da partícula. A deposição nasal se aproxima de 100% para todas as partículas > 2 µm de diâmetro. Pela boca, com respiração tranquila, a deposição pulmonar pode ser maior que 30% para partículas entre 2 e 5 µm e ~10% para partículas de 10 a 30 µm de diâmetro.
Com o objetivo de manter uma lista única de alérgenos, sem ambiguidades, foi criada uma Nomenclatura de Alérgenos, sob a égide da International Union of Immunological Societies (IUIS) e da Organização Mundial de Saúde (OMS), tornando-se uma lista oficial, mundialmente aceita, disponível na internet na URL www.allergen.org.
A exposição pura e simples não é suficiente para sensibilizar. Muitas pessoas expostas em seus lares não desenvolvem anticorpos IgE, isto é, não são atópicos. Por outro lado, estudos longitudinais efetuados por Sporik et al21 demonstraram que a exposição de crianças com tenra idade a altas concentrações de alérgenos da poeira doméstica era fator significativo para o desenvolvimento posterior da asma, explicando-se o alto percentual de crianças com asma em idade escolar na Inglaterra. Nesta população de escolares, cerca de 80% demonstram testes positivos para alérgenos da poeira doméstica, enquanto que em controles este valor não ultrapassa 30%. Vários trabalhos sugerem que a primeira exposição de recém-natos a aeroalérgenos pode ser determinante para sintomas respiratórios tardios e sensibilização.22-24
As proteínas dos ácaros encontrados na poeira doméstica têm sido apontadas como a causa de aumento da prevalência da asma. A fauna de ácaros do pó domiciliar inclui cerca de > 130 espécies e variam de uma região para a outra, na mesma cidade ou mesmo dentro do próprio domicílio.
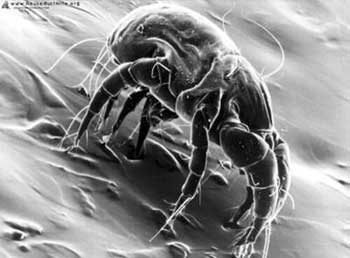 Os ácaros são membros do filo Arthropoda, classe Arachnida, ordem Acari, subordem Acaridae. A ordem Acaridae divide-se em três famílias, uma delas ligada à escabiose e as outras duas à asma. Os ácaros mais estudados na asma são o Dermatophagoides pteronyssinus, o D. farinae (Figura 3), o D. microceras e o Euroglyphus maynei pertencentes à família Pyroglyphidae. Os ácaros são membros do filo Arthropoda, classe Arachnida, ordem Acari, subordem Acaridae. A ordem Acaridae divide-se em três famílias, uma delas ligada à escabiose e as outras duas à asma. Os ácaros mais estudados na asma são o Dermatophagoides pteronyssinus, o D. farinae (Figura 3), o D. microceras e o Euroglyphus maynei pertencentes à família Pyroglyphidae.
O Dermatophagoides pteronyssinus é mundialmente predominante na poeira doméstica, principalmente em regiões de clima úmido (Norte da Europa, Brasil e Noroeste do Pacífico). Medem aproximadamente 420 mícrons e como são fotofóbicos e suscetíveis a dissecação, residem em "ninhos" nos tapetes, camas, sofás, almofadas, estofados, colchões, travesseiros... que retêm água durante as flutuações transitórias da umidade e onde sua fonte de nutrição é encontrada. Os determinantes primários de seu crescimento e sobrevivência relacionam-se a alimentação, a temperatura média de 24ºC e a umidade relativa do ar de 60%. O Dermatophagoides farinae é mais encontrado em regiões de clima seco e em áreas em que ocorre um inverno prolongado.
Na América do Sul, o D. pteronyssinus é prevalente em residências, enquanto o D. farinae não. Todos os ácaros da poeira doméstica possuem sistemas bem desenvolvidos e sofisticados de respiração, digestão e equilíbrio hídrico, permitindo-lhes viver e sobreviver nos vários habitats das casas.
 O primeiro alérgeno de ácaro identificado o alérgeno I – foi a cisteína-protease do Dermatophagoides pteronyssinus ou Der p 1 em 1980, seguido por Der p 2 e Dermatophagoides farinae homólogo 1 e 2. Os alérgenos sensibilizantes do ácaro da poeira doméstica estão divididos em grupos (Der p 1-11, 14, 20,21; Der f 1-3, 6, 7, 10, 11, 13-18, 22; e Der m 1), identificados na base do peso molecular e sequência homóloga.25 Foram identificados como os principais, as cisteína-proteases (alérgenos grupo 1: D. pteronyssinus 1, D. farinae 1 , D. microceras 1); as serino-proteases (alérgenos grupo 9); e as amilases (alérgenos grupo 4). Estas enzimas alergênicas provêm das células do trato gastrintestinal do ácaro e são encontrados em alto teor em suas fezes (Figura 4), com partículas de 10 a 40 µm de diâmetro, semelhantes no tamanho ao pólen ou esporos fúngicos.25 Os alérgenos do grupo 2 (D. pteronyssinus 2, D. farinae 2) derivam principalmente do corpo dos ácaros e não das fezes. Os alérgenos predominantes na poeira doméstica pertencem aos grupos 1 e 9, encontrando-se, também, os alérgenos do grupo 2, porém, em escala bem menor. Estas partículas permanecem transitoriamente em suspensão no ar, após "turbulências" como quando da utilização de aspiradores de pó, ou quando do ato de "fazer a cama" etc. não mais sendo detectados em suspensão 30 a 40 minutos após cessação da turbulência. Em indivíduos predispostos, concentrações menores de 2 µg/g do alérgeno são suficientes para a sensibilização, enquanto que os não alérgicos requerem mais de 60 µg/g.25 Alguns destes alérgenos são enzimas proteolíticas, havendo evidências de que o Der p 1 e Der p 9 interfiram na permeabilidade mucosa. Esta ação enzimática é capaz de alterar a arquitetura celular, proporcionar a liberação de citocinas pró-inflamatórias e aumentar a produção de IgE.26 Esta relação entre atividade biológica e a capacidade de produzir alergia ainda não foi esclarecida. Outros grupos de alérgenos incluem enzimas como: grupo 3 — tripsinas; grupo 5 — função desconhecida; grupo 6 — quimiotripsinas; grupo 7 — função desconhecida; grupo 8 — glutation-transferases; grupos 10 e 11 — tropomiosina e paramiosina. Até o momeno foram identificados mais de 30 alérgenos associados aos ácaros da poeira doméstica muitos dos quais apresentam uma série de atividades biológicas funcionais (Tabela 3). O primeiro alérgeno de ácaro identificado o alérgeno I – foi a cisteína-protease do Dermatophagoides pteronyssinus ou Der p 1 em 1980, seguido por Der p 2 e Dermatophagoides farinae homólogo 1 e 2. Os alérgenos sensibilizantes do ácaro da poeira doméstica estão divididos em grupos (Der p 1-11, 14, 20,21; Der f 1-3, 6, 7, 10, 11, 13-18, 22; e Der m 1), identificados na base do peso molecular e sequência homóloga.25 Foram identificados como os principais, as cisteína-proteases (alérgenos grupo 1: D. pteronyssinus 1, D. farinae 1 , D. microceras 1); as serino-proteases (alérgenos grupo 9); e as amilases (alérgenos grupo 4). Estas enzimas alergênicas provêm das células do trato gastrintestinal do ácaro e são encontrados em alto teor em suas fezes (Figura 4), com partículas de 10 a 40 µm de diâmetro, semelhantes no tamanho ao pólen ou esporos fúngicos.25 Os alérgenos do grupo 2 (D. pteronyssinus 2, D. farinae 2) derivam principalmente do corpo dos ácaros e não das fezes. Os alérgenos predominantes na poeira doméstica pertencem aos grupos 1 e 9, encontrando-se, também, os alérgenos do grupo 2, porém, em escala bem menor. Estas partículas permanecem transitoriamente em suspensão no ar, após "turbulências" como quando da utilização de aspiradores de pó, ou quando do ato de "fazer a cama" etc. não mais sendo detectados em suspensão 30 a 40 minutos após cessação da turbulência. Em indivíduos predispostos, concentrações menores de 2 µg/g do alérgeno são suficientes para a sensibilização, enquanto que os não alérgicos requerem mais de 60 µg/g.25 Alguns destes alérgenos são enzimas proteolíticas, havendo evidências de que o Der p 1 e Der p 9 interfiram na permeabilidade mucosa. Esta ação enzimática é capaz de alterar a arquitetura celular, proporcionar a liberação de citocinas pró-inflamatórias e aumentar a produção de IgE.26 Esta relação entre atividade biológica e a capacidade de produzir alergia ainda não foi esclarecida. Outros grupos de alérgenos incluem enzimas como: grupo 3 — tripsinas; grupo 5 — função desconhecida; grupo 6 — quimiotripsinas; grupo 7 — função desconhecida; grupo 8 — glutation-transferases; grupos 10 e 11 — tropomiosina e paramiosina. Até o momeno foram identificados mais de 30 alérgenos associados aos ácaros da poeira doméstica muitos dos quais apresentam uma série de atividades biológicas funcionais (Tabela 3).
Em regiões tropicais e subtropicais (p.ex. Brasil e Flórida) os alérgenos produzidos por outras espécies de ácaros (classe Arachnida, ordem Acarina, família Glycyphagidæ), a Blomia tropicalis e a Blomia kulagini, são uma importante causa de sensibilização IgE em pacientes com asma.27,28 Vários alérgenos foram identificados, sendo o Blo t 5 o mais importante, apresentando sequência homóloga ao Der p 5 em 43%.29
As partículas fecais dos ácaros da poeira doméstica além de carrearem alto teor de enzimas alergênicas também atuam como transportadoras de outros elementos que compreendem DNA dos ácaros, DNA de bactérias,30 poluentes ambientais, microrganismos (bactérias, vírus, fungos, etc.), quitina e compostos microbianos (endotoxina) que podem atuar como
padrões moleculares associados a patógenos (PAMPs) ou padrões moleculares associados a danos (DAMPS).31,32
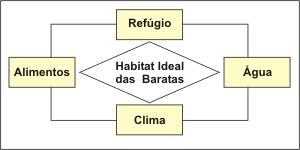 Outros alérgenos encontrados nas casas provêm das baratas (classe Hexapoda, ordem Cursoria, família Blattidae, gênero Blatella ) que as infestam, e que podem também desencadear asma perene. As baratas são de origem tropical, e proliferam com muita facilidade em ambientes quentes (um casal pode produzir uma prole maior que 30.000 baratas em alguns meses). Suas maiores fontes de alimentação são alimentos expostos e o lixo. Ao contrário dos ácaros, não dependem da umidade do ambiente, apresentando grande versatilidade na busca de água em seu habitat (Figura 5). São três as espécies principais: a germânica (Blattella germanica), a americana (Periplaneta americana) e a oriental (Blatella orientalis). Foram identificados cinco alérgenos da B. germanica (Bla g 1, Bla g 2, Bla g 4, Bla g 5 e Bla g 6) e dois da P. americana (Per a 1, Per a 3).33-36 O mais importante, o Bla g 2, uma enzima digestiva – protease, que provém do intestino da barata, é eliminado pelas fezes e é encontrado principalmente em cozinhas, onde a barata encontra seu suprimento alimentar. Entre crianças atópicas com asma a prevalência de asma diretamente relacionada aos alérgenos da barata é maior que 69%.37 Um dos fatores determinantes relaciona-se ao longo tempo que as crianças pequenas passam no chão ou próximo dele, onde os alérgenos da barata encontram-se concentrados na poeira. Os asmáticos sensíveis aos alérgenos das baratas apresentam asma mais grave que a população geral, níveis elevados de IgE, cronicidade e maior dependência aos corticoides.38 Outros alérgenos encontrados nas casas provêm das baratas (classe Hexapoda, ordem Cursoria, família Blattidae, gênero Blatella ) que as infestam, e que podem também desencadear asma perene. As baratas são de origem tropical, e proliferam com muita facilidade em ambientes quentes (um casal pode produzir uma prole maior que 30.000 baratas em alguns meses). Suas maiores fontes de alimentação são alimentos expostos e o lixo. Ao contrário dos ácaros, não dependem da umidade do ambiente, apresentando grande versatilidade na busca de água em seu habitat (Figura 5). São três as espécies principais: a germânica (Blattella germanica), a americana (Periplaneta americana) e a oriental (Blatella orientalis). Foram identificados cinco alérgenos da B. germanica (Bla g 1, Bla g 2, Bla g 4, Bla g 5 e Bla g 6) e dois da P. americana (Per a 1, Per a 3).33-36 O mais importante, o Bla g 2, uma enzima digestiva – protease, que provém do intestino da barata, é eliminado pelas fezes e é encontrado principalmente em cozinhas, onde a barata encontra seu suprimento alimentar. Entre crianças atópicas com asma a prevalência de asma diretamente relacionada aos alérgenos da barata é maior que 69%.37 Um dos fatores determinantes relaciona-se ao longo tempo que as crianças pequenas passam no chão ou próximo dele, onde os alérgenos da barata encontram-se concentrados na poeira. Os asmáticos sensíveis aos alérgenos das baratas apresentam asma mais grave que a população geral, níveis elevados de IgE, cronicidade e maior dependência aos corticoides.38
Enquanto o ácaro da poeira é o mais importante alérgeno para sensibilização e asma nos climas tropical e subtropical, os alérgenos dos animais criados no interior das casas, como gatos e cães, são os mais importantes no clima seco e frio temperado. Mais de 60% dos pacientes asmáticos demonstram hipersensibilidade aos alérgenos do gato e/ou cães, e mais de um terço destes convivem com estes animais em seus lares.39,40
Nos gatos os alérgenos Fel d 1 (Felis domesticus) provêm
dos folículos pilosos intradérmicos (principalmente na área facial), de suas glândulas salivares41,42 e sebáceas e se espalham por toda a pelagem durante os banhos regulares de língua. Uma concentração elevada destes alérgenos é encontrada nas lágrimas, na urina de machos e nas secreções anais.43 Em machos, a produção glandular do Fel d 1 parece estar sob controle hormonal e diminui após a castração.44 O Third International Workshop de Cuenca45 concluiu que o significado clínico desta redução na produção de alérgenos necessita de maior investigação, pois muitos asmáticos com alergia comprovada ao gato, continuam sintomáticos mesmo quando têm seus gatos castrados.
Não se sabe o que Fel d 1 faz pelos felinos. Alguns gatos têm pouco e alguns têm muito, portanto, grandes quantidades não parecem ser necessárias e a raça do gato não parece fazer muita diferença; até os gatos Sphynx sem pelos produzem Fel d 1.46
A descamação de sua pele elimina partículas de 2 a 5 µm de diâmetro que contêm o alérgeno Fel d 1, que permanece longo período em suspensão, principalmente em ambientes malventilados,44 mantendo potência alergênica por mais de 20 semanas, mesmo após a remoção do animal.45 Em ambientes coabitados com gatos, os níveis de Fel d 1 alcançam 10 µg/g de poeira.47 Os alérgenos dos animais de companhia, em especial os do gato, apresentam maior mobilidade do que os alérgenos dos ácaros, sendo encontrados em quantidades detectáveis em casas e escolas onde estes animais nunca estiveram. Este fato se deve a grande aderência das partículas que portam os alérgenos e que são transportadas pelas pessoas que tocam nos gatos ou visitam ambientes com gatos.
Os cães (Canis familiaris), por ficarem mais tempo fora de casa, ao contrário dos gatos, causam menos asma, sendo que o seu alérgeno mais comum, o Can f 1, é encontrado em sua saliva, pelos e descamações cutâneas, não ocorrendo na urina ou nas fezes. Não existe relação entre alergia e o tamanho da pelagem do animal. Reação cruzada pode ocorrer entre alérgenos do cão e gato.
Em outros animais menores utilizados em laboratórios, como porquinhos-da-índia, ratos, camundongos, coelhos etc. a fonte principal de alérgenos é a urina, ocorrendo também na saliva e pelos, sendo portanto a gaiola mais importante que o próprio animal, na disseminação do alérgeno no ambiente. Como os roedores apresentam proteinúria permanente, as proteínas alergênicas dispersas na urina disseminam-se no ar ambiente à medida que a urina se evapora. Os alérgenos mais importantes identificados neste grupo de animais incluem o Mus m I e o Mus m II dos camundongos, o Rat n I dos ratos e o Cav p I e Cav p II dos porquinhos-da-índia.48
Outros aeroalérgenos que podem precipitar ou exacerbar a asma são os esporos de fungos (mofo ou bolor) reconhecidos como causadores de sensibilização atópica. Sua presença pode variar em função da região geográfica e condições climáticas (temperatura/umidade). Os fungos tendem a ser alérgenos sazonais em zonas temperadas, onde alguns fungos esporulam no calor, em dias secos de verão, enquanto que outros preferem a estação das chuvas. No interior das casas são encontrados principalmente em ambientes quentes, úmidos e pouco ventilados como porões, banheiros, cozinhas e em locais onde exista material orgânico como dispensas, armazéns e lixeiras. Os fungos mais comuns são: Penicillum, Aspergillus, Alternaria, Cladosporium e Candida.
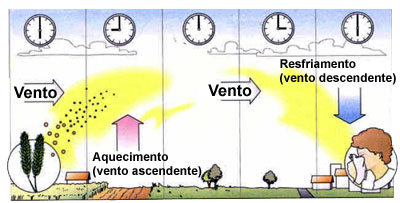
 Relacionada aos esporos de fungos existe a chamada "Asma da Tempestade" (Thunderstorm Asthma). Definimos tempestade como um temporal produzido por nuvens do tipo cúmulo-nimbus (Figura 6), sempre acompanhadas por trovoadas e raios, com rajadas de ventos, chuvas fortes e algumas vezes granizo, ocorrendo com maior frequência no verão e na primavera. Este tipo de asma ocorre em decorrência da turbulência dos ventos, que aumenta a liberação de esporos fúngicos do solo, mantendo-os em suspensão no ar, tornando-os facilmente inaláveis. Várias publicações documentaram a relação entre o aumento dos esporos de fungos no ar, com esta manifestação meteorológica e asma.49-55 Dales et al.55 investigaram os atendimentos em um serviço de emergência na região de Ottawa no Canadá, no período de 1993 a 1997, quando analisaram 151 dias em que ocorreram tempestades. Puderam constatar que as concentrações de fungos no ar quase que dobraram nestes dias (1.512 para 2.749/mm3), enquanto que os atendimentos de emergência cresceram de 8,6 para 10 (p < 0,05). Relacionada aos esporos de fungos existe a chamada "Asma da Tempestade" (Thunderstorm Asthma). Definimos tempestade como um temporal produzido por nuvens do tipo cúmulo-nimbus (Figura 6), sempre acompanhadas por trovoadas e raios, com rajadas de ventos, chuvas fortes e algumas vezes granizo, ocorrendo com maior frequência no verão e na primavera. Este tipo de asma ocorre em decorrência da turbulência dos ventos, que aumenta a liberação de esporos fúngicos do solo, mantendo-os em suspensão no ar, tornando-os facilmente inaláveis. Várias publicações documentaram a relação entre o aumento dos esporos de fungos no ar, com esta manifestação meteorológica e asma.49-55 Dales et al.55 investigaram os atendimentos em um serviço de emergência na região de Ottawa no Canadá, no período de 1993 a 1997, quando analisaram 151 dias em que ocorreram tempestades. Puderam constatar que as concentrações de fungos no ar quase que dobraram nestes dias (1.512 para 2.749/mm3), enquanto que os atendimentos de emergência cresceram de 8,6 para 10 (p < 0,05).
Em 21 de novembro de 2016 a cidade de Melbourne (VIC, Australia) enfrentava uma primavera muito quente e apresentou a temperatura mais elevada do ano – 35ºC, sendo que na mesma ocasião a contagem de pólen de azevém no ar era extremamente alta de 100 grãos por m3. Neste dia entre 17:00 h e 18:30 h a temperatura sofreu uma queda súbita de 35°C para 20ºC seguida por fortes chuvas precedidas por rajadas de ventos, raios e trovoadas. No período de 30 h que se seguiu ao início da tempestade o número de atendimentos por problemas respiratórios em emergências foi de 672% acima da média e o de internações relacionadas à asma de 992% acima da média. Ocorreram dez óbitos por asma, cerca de 28% dos 2.242 pacientes que compareceram às emergências com asma diagnosticada. Entretanto, quase todos os pacientes neste episódio de “asma epidêmica de tempestade” apresentavam história de rinite alérgica com alergia ao pólen do azevém. Na epidemia de Melbourne entre 20% e 40% das pessoas afetadas nunca apresentaram asma antes e, portanto, não estariam em tratamento.56
Referências
01.Kaliner MA, Lemanske R. Rhinitis and asthma. JAMA 1992; 268:2807.
02.Coca AF, Cooke RA. On the classification of the phenomen of hypersensitiveness. J Immunol 1923; 8:163.
03.Cookson WOCM, Sharp PA, Faux JA, Hopkin JM. Linkage between immunoglobulin E responses underlying asthma and rhinitis and chromosome 11q. Lancet 1989; 1:1292.
04.Colee JM, Ten Kate LP, de Vries HG, et al. Allele sharing chromosomes 11q13 and in sibs with asthma and atopy. Lancet 1993; 342:936.
05.Marsh DG, Neely JD, Breazeale DR, et al. Linkage analysis of IL-4 and other chromosome 5q31.1 markers and total serum immunuglobulin E concentrations. Science 1994; 264:1152.
06.Meyers DA, Postma DS, Panhuysen CIEM, et al. Evidence for a locus regulating total serum IgE levels mapping to chromosome 5. Genomics 1994; 23:464.
07.Kaliner MA. Allergic Asthma. In :Barry E Brenner. Emergency Asthma. NewYork: Marcel Dekker;1999:81-89.
08.Sutton, BJ, Gould HJ. The human IgE network. Nature 1993; 366:421.
09.Amlot PL, Green LA. Atopy and immunoglobuline E concentrations in Hodgkin's and other lymphomas. BMJ 1978; 11:327.
10.Levo Y, Shalit M, Wollner S, Fich A. Serum IgE levels in patients with inflammatory bowel disease. Ann Allergy 1986; 56:85.
11.Grieco MH. Immunoglobulins and hypersensitivity in human immunodeficiency virus (HIV) infection. J Allergy Clin Immunol 1989; 84:11.
12.Moneret-Vautrin DA, Kanny G, Thinus G. Hyperglobulinemia E syndrome with recurrent infections (Job'syndrome). Rev Med Interne 1999; 20:133.
13.Barbee RA, Halonen M, Kaltenborn W, Lebowitz M, Burrows B. A longitudinal study of serum IgE in a community cohort: correlations with age, sex, smoking, and atopic status. J Allergy Clin Immunol 1987; 79:919.
14.Gerrard JW, Heiner DC, Ko Cg, Mink J, Meyers A, Dosman JA. Immunoglobulin levels in smokers and non-smokers. Ann Allergy 1980; 44:261.
15.Takatuji S, Suzuki S, Muranaka M, Miyamoto T. Influence of environmental factors on IgE production. Ciba Found Symp 1989; 147:188.
16.Cline MG, Burrow, BB. Distribution of allergy in a population sample residing in Tucson, Arizona. Thorax 1989; 44:425.
17.Peat, JK, Britton WJ, Salome CM, Woolcock AJ. Bronchial hyperresponsiveness in two populations of Australian school children III. Effect of exposure to environmental allergens. Clin Allergy 1987; 17:271.
18.Han H, Roan F, Ziegler SF. The atopic march: current insights into skin barrier dysfunction and epithelial cell-derived cytokines. Immunol Rev 2017; 278:116-130.
19.Pope AM, Patterson R, Burge H. Indoor allergens. Assessing and controlling adverse health effects. Washington, DC: National Academy Press, 1993.
20.Voorhorst R, Spieksma FTh M, Varekamp N. House dust mite atopy and the house dust mite. Dermatophagoides pteronyssinus. Leiden, Stafleu's Scientific Publishing Co., 1969 .
21.Sporik R, Holgate S, Platts-Mills TAE, Cogswell J. Exposure to house-dust mite allergen ( der p I) and the development of asthma in childhood. A prospective study. N Engl Med 1990; 323:502.
22.Smith JM, Springett VH. Atopic disease and month of birth. Clin Allergy 1981; 36:263.
23.Pearson DJ, et al. Respiratory allergy and the month of birth. Clin Allergy 1977; 7:29.
24.Suoniemi I, Bjorksten F, Haahtela T. Dependence of immediate hypersensitivity in the adolescent period on factors encountered in infancy. Allergy 1981; 36:263.
25.Brunton SA, Saphir RL. Dust mites and asthma. Hospital Practice 1999; 34:67.
26 .Hoover GE, Platts-Mills TAE. What the pulmonology needs to know about allergy. Clin Chest Med 1995; 16:603.
27.Fernandez-Caldas E, et al. Mite fauna, Der p 1, Der f 1 and Blomia tropicalis allergen levels in a tropical environment. Clin Exp Allergy 1993; 23:292.
28.Tsai JJ, et al. Sensitization to Blomia tropicalis among asthmatic patients in Taiwan. Intl Archives Allergy Immunol 1998; 115:144.
29.Arruda Lk, et al. Sensitization to Blomia tropicalis in patients with asthma and identification of allergen Blo t 5. Am J Resp Crit Care Med 1997; 155:342.
30.Douwes J, Zuidhof A, Doekes G, van der Zee SC, Wouters I, Boezen MH, et al. (1-->3)-beta-D-glucan and endotoxin in house dust and peak flow variability in children. Am J Respir Crit Care Med 2000; 162:1348–54.
31.Rizzo MC, Naspitz CK, Fernandez-Caldas E, Lockey RF, Mimica I, Sole D. Endotoxin exposure and symptoms in asthmatic children. Pediatr Allergy Immunol 1997; 8:121–6.
32.Keshavarz B, Erickson LD, Platts-Mills TAE, Wilson JM. Lessons in Innate and Allergic Immunity From Dust Mite Feces and Tick Bites. Front Allergy 2021; 2:692643. doi:10.3389/falgy.2021.692643.
33.Arruda LK, et al. Molecular cloning of German cockroach (Blattella germanica) allergens. Intl Arch Allergy Immunol 1995; 107:295.
34.Chapman MD, et al. Defined epitopes: in vivo and in vitro studies using recombinant allergens. Intl Arch Allergy Immunol 1997; 113:102.
35.Helm RM, et al. Isolation of the 36-kD German ( Blattella germanica ) cockroach allergen using fast protein liquid chromatography. Intl Arch Allergy Immunol 1994; 103:59.
36.Schou C, et al. Identification and purification of an important cross-reactive allergen from American ( Periplaneta americana ) and German ( Blattella germanica ) cockroach. J Allergy Clin Immunol 1990; 86:935.
37.Kang B, Chang JL. Allergenic impact of inhaled arthropod material. Clin Rev Allergy 1985; 3:363.
38.Kang BC, Johnson J, Veres-Thorner C. Atopic profile of inner-city asthma with a comparative analysis on the cockroach-sensitive and ragweed-sensitive subgroups. J Allergy Clin Imunol 1993; 92:802.
39.Custovic A, Simpson A, Chapman MD, Woodcock A. Allergen avoidance in treatment of asthma and atopic disorders. Thorax 1998; 53:63.
40.Egmar L, Emenius G, Axelsson G, Pershagen G, Wickman G. Direct and indirect exposure to cat (Fel d 1) and dog (Can f 1) allergens in homes. J Allergy Clin Immunol 1993; 91:324.
41.Anderson MC, Baer H. Allergenically active components of cat allergen extracts. J Immunol 1981; 127:972.
42.Leitermann K, Ohman JL. Cat allergen 1: Biochemical, antigenic, and allergenic properties. J Allergy Clin Immunol 1984; 74:147.
43.Dornelas de Andrade A, Birnbaum J, Magalon C, et al. Fed d 1 levels in cat anal glands. Clin Exp Allergy 1996;26:178.
44.Zielonka TM, Charpin D, Berbis P, Luciani P, Casanova D, Vervoloet D. Effects of castration and testosterone on Fel d I production by sebaceous glands of male cats: I - Immunological assessment. Clin Exp Allergy 1994; 24:1169.
45.Platts-Mills TA, Vervoloet D, Thomas WR, Aalberse RC, Chapman MD. Indoor allergens and asthma: report of the Third International Workshop, Cuenca, Spain. J Allergy Clin Immunol 1997 ; 100:S2.
46.Dence A. The race to deliver the hypoallergenic cat. Disponível na internet via URL: https://doi.org/10.1038/d41586-020-02779-3 (Arquivo capturado em 20 de dezembro de 2020).
47.Hoover GE, Platts-Mills TAE. What the pulmonology needs to know about allergy. Clin Chest Med 1995; 16:603.
48.Schou C. Defining allergens of mammalian origen. Clin Exp Allergy 1993; 23:7.
49.Packe GE, Ayres JG. Asthma outbreak during a thunderstorm. Lancet 1985; 2:199.
50.Higham J, Venables K, Kopek E, et al. Asthma and thunderstorms: description of an epidemic in general practice in Britain using data from a doctors' deputising service in the UK. J Epidemiol Commun Health 1997; 51:233.
51.Venables KM, Allitt U, Collier CG, Emberlin J, Greig JB, Hardaker PJ, Highham JH, Laing-Morton T, Maynard RL, Murray V, Strachan D, Tee RD. Thunderstorm-related asthma--the epidemic of 24/25 June 1994. Clin Exp Allergy 1997l; 27:725-36.
52.Celenza A, Fothergill J, Kupek E, Shaw RJ. Thunderstorm associated asthma: a detailed analysis of environmental factors. BMJ 1996; 312(7031):604-7.
53.Newson R, Strachan D, Archibald E, Emberlin J, Hardaker P, Collier C. Effect of thunderstorms and airborne grass pollen on the incidence of acute asthma in England, 1990-94. Thorax 1997; 52:680-5.
54.Marks GB, Colquhoun JR, Girgis ST, Koski MH, Treloar AB, Hansen P, Downs SH, Car NG. Thunderstorm outflows preceding epidemics of asthma during spring and summer. Thorax 2001; 56:468-71.
55.
Dales RE, Cakmak S, Judek S, Dann T, Coates F, Brook JR, Burnett RT. The role of fungal spores in thunderstorm asthma. Chest 2003; 123:745-50.
56.Venkatesan, P. Epidemic thunderstorm asthma. Lancet Respir Med 2022; Published Online February 25. https://doi.org/10.1016/ S2213-2600(22)00083-2. Acesso em 3 de março de 2022.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|