|
Asma
MEDIADORES LIPÍDICOS – Leucotrienos na Asma
Progressos consideráveis têm ocorrido na definição dos elementos celulares e mediadores envolvidos no processo inflamatório da asma. Várias células que participam deste processo são capazes de produzir os leucotrienos (LTs) bem como os seus receptores (Cys–LT1). Por outro lado, os LTs apresentam importante papel no remodelamento das vias aéreas na asma persistente.
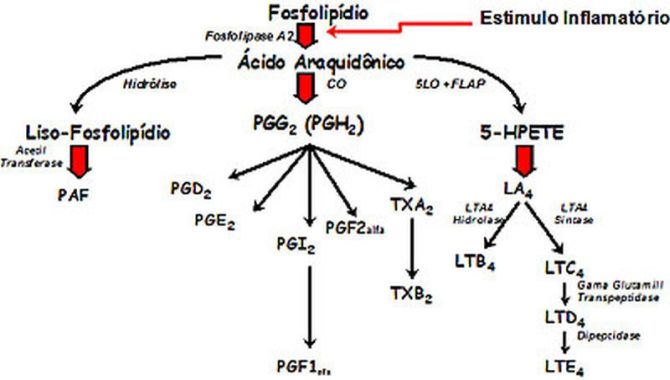
Figura 1 – Representação esquemática dos produtos do ácido aracdônico: formação do fator de ativação plaquetária (PAF), via da ciclooxigenase (CO) e via da 5-Lipoxigenase (5 LO).
O ácido araquidônico é um dos très ácidos graxos essenciais,1 que está incorporado esterificado na posição -2 da membrana celular fosfolipídica dos mastócitos e de outras células inflamatórias (eosinófilos, macrófagos...). Estudos sob micoscopia eletrônica de células inflamatórias ativadas em cultura sugerem que o ácido araquidônico derive de membranas perinucleares.2 A oxidação enzimática deste ácido graxo produz (Figura 1) uma variedade de metabólitos que apresentam importantes funções bioquímicas e fisiológicas. Entre estes metabólitos estão as prostaglandinas (PG), os leucotrienos, o tromboxane (Tx) e a prostaciclina, metabólitos estes conhecidos coletivamente como eicosanoides. O termo eicosanoide provém de eicosa (20 átomos de carbono), -ene (indica dupla ligação presente nos compostos) e -oide (indica similaridade estrutural de um com o outro). O termo prostanoide foi introduzido na literatura para incluir os metabólitos do ácdo araquidônico derivados da via da ciclo-oxigenase e inclui prostaglandinas, tromboxane e prostaciclina.
Por outra via oxidativa do ácido araquidônico derivam os leucotrienos cujo nome tem origem nas células onde foram primeiro identificados os leucócitos e pela disposição de três duplas ligações conjugadas (tri-eno), com geometria trans (Figura 2).
A principal fonte de ácido araquidônico são as membranas fosfolipídicas, primariamente a fosfatidilcolina, fosfatidiletanolamina e o fosfatidilinositol. O ácido araquidônico é liberado para a célula via hidrólise de fosfolipídios quando ocorre um aumento da concentração intracelular de cálcio que desencadeia uma série de eventos que determina a ativação da fosfolipase A2 (PLA2),3,4 fosfolipase C e/ou lipase digliceride. O ácido araquidônico livre pode ser enzimaticamente oxigenado por três grandes vias, ciclo-oxigenase, lipoxigenase e citocromo P-450 monooxigenase (não mencionado neste capítulo).
As prostaglandinas e o tromboxane são gerados a partir do ácido araquidônico através da via da ciclooxigenase (prostaglandina endoperóxido sintetase) (CO). A CO está localizada no retículo endoplasmático e membranas nucleares, e catalisa a oxigenação do ácido araquidônico para prostaglandina endoperoxidase, prostaglandina G2 (PGG2), posteriormente reduzida a PGH2 pela atividade peroxidase. A PGH2 torna-se substrato para enzimas terminais, originando outros prostanoides, cinco deles implicados na asma – PGD2, PGE2, PGF2α, PGI2 e o TXA2 derivado da PGH2 via tromboxane sintetase.
A PGD2 quando administrada por aerossol tem forte ação broncoconstritora e é aproximadamente 30 vezes mais potente que a histamina nas vias aéreas de humanos e 3,5 vezes mais potente que a PGF2α. A PGF2α estimula também a resposta vasoconstritora da circulação brônquica e intensifica a secreção de muco. O efeito broncoconstritor dos eicosanoides é parcialmente mediado por mecanismos reflexos colinérgicos. A avaliação da atividade do TXA2 na função das vias aéreas in vivo tem sido muito difícil devido a sua meia-vida muito curta de ~30 seg. A broncoconstrição causada pelo TXA2 em asmáticos resulta também, em parte, por liberação de acetilcolina (ACh) pela inervação colinérgica. Além da ação sobre o tônus brônquico e vascular, e o aumento da permeabilidade vascular, os prostanoides funcionam como mediadores envolvidos na modulação da atividade neuronal, apresentam efeitos pró-inflamatórios e podem alterar a produção e a liberação de outros mediadores inflamatórios como a PGD2 que potencializa in vitro a liberação de histamina dependente da IgE pelos basófilos e aumenta transitoriamente a responsividade brônquica a histamina e metacolina. A PGE2 e a PGI2 apresentam efeitos relaxantes na musculatura das vias aéreas e efeitos dilatadores na circulação brônquica e potencializam o aumento da permeabilidade vascular produzida pela histamina, bradicinina, LTB4 e LTC4. A PGE2 também regula a síntese e liberação de citocinas quimiotácticas pelos macrófagos e tem participação na patogênese da asma induzida por aspirina (AIA), quando ocorre redução na sua síntese ou um desvio do substrato da via da CO para a via da 5-Lipoxigenase (5-LO).
Por outra via, a ativação e a hidrólise do ácido araquidônico forma o lisofosfolipídio. O lisofosfolipídio pode ser acetilado formando o fator de ativação plaquetária (1-alquila-2-acetil-sn-glicero-3-fosfocolina) (PAF). O PAF tem potente ação broncoconstritora, e é um dos mais potentes fatores quimiotáxicos in vitro e in vivo para os eosinófilos. Os efeitos biológicos do PAF incluem ativação plaquetária, estimulação neutrofílica, contração da musculatura lisa, aumento da permeabilidade vascular com formação de edema e estimula a secreção de muco enquanto reduz significativamente o movimento ciliar, diminuindo a sua capacidade de transporte.5,6 Quando inalado o PAF produz broncospasmo e aumenta a hiper-responsividade brônquica. Nos mononucleares o PAF regula a produção de citocinas e nos macrófagos alveolares aumenta a produção de Fator de Necrose Tumoral alfa (TNF-a).7,8
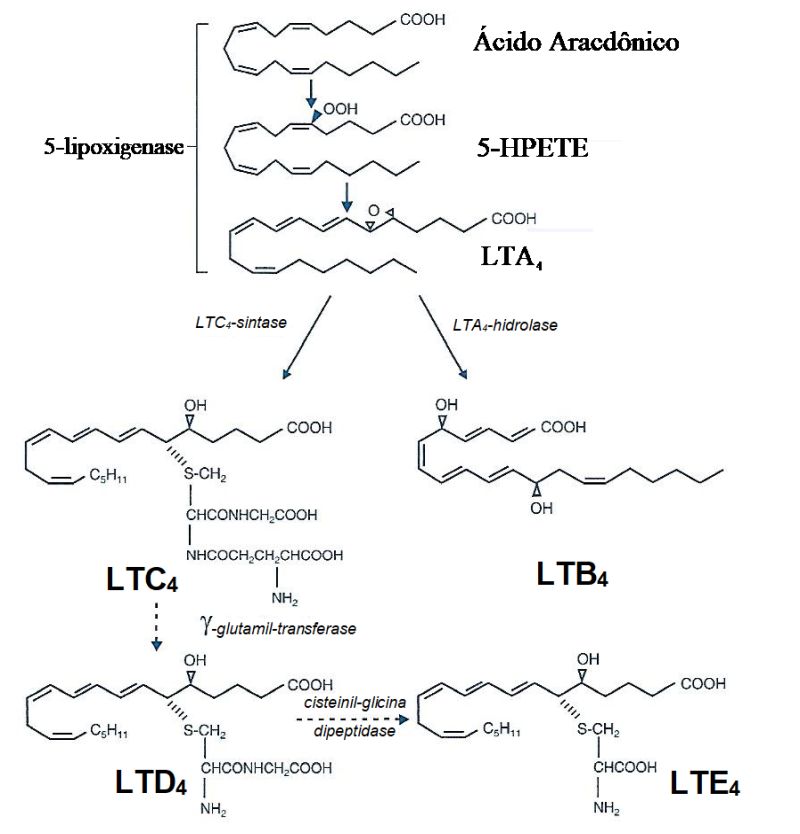
A terceira via é a chamada via da 5-lipoxigenase (5-LO) (Figura 3). A 5-LO é uma enzima contendo ferro, consistindo de 673 aminoácidos, com peso molecular de aproximadamente 78 kDa, que por translocação migra do citosol para a membrana nuclear da célula para iniciar a biossíntese de leucotrienos. A 5-LO está limitada às células de linhagem mieloide (neutrófilos, eosinófilos, basófilos, monócitos, macrófagos e mastócitos). Como resultado da presença ativa da 5-LO, através de sua interação com a proteína ativadora da 5-lipoxigenase (também conhecida com ALOX5-AP ou FLAP), ocorre oxigenação do ácido araquidônico na posição do carbono 5, formando o ácido 5-hidroperoxieicosatetraenoico (HPETE), que é precursor do ácido 5,6-óxido-7,9-trans-11,14-cis-eicosatetraenóico conhecido como leucotrieno A4 (LTA4). O LTA4 é instável, com meia-vida curta e rapidamente sob ação da enzima LTA4 hidrolase forma o LTB4. Por outra via, resultam os leucotrienos sulfidopeptídicos (LTC4, LTD4 e LTE4). O LTA4 é convertido em LTC4 sob ação da enzima específica glutationil-S-transferase, que catalisa a conjugação do glutation ao LTA4 junto ao carbono 6, formando o LTC4 (ácido5[S]-hidroxi-6[R]-glutationil-7,9-trans-11,14-cis-eicosatetraenoico). O LTC4, através de um transporte transmembrana específico,9,10 deixa o microambiente intracelular (mastócitos, eosinófilos ou macrófagos) e no espaço extracelular serve como substrato para a glutamil transpeptidase, que fragmenta o ácido glutâmico pela metade por clivagem em sua cadeia peptídica, para formar o LTD4 (ácido 5[S]-hidroxi-6[R]-cisteinil-glicil-7,9 trans-11,14-cis-eicosatetraenoico). O LTD4 é processado pela remoção da metade glicina da cadeia peptídica para formar o LTE4 (ácido 5[S]-hidroxi-6[R]-cisteinil-7,9-trans-11,14-cis-eicosatetraenoico). O LTC4 e seus derivados LTD4 e LTE4 constituem o que antes era conhecido como SRS-A (slow-reacting substance of anaphylaxis)11 e são na atualidade coletivamente conhecidos por cisteinil-leucotrienos (cys-LTs), por apresentarem em suas fórmulas o aminoácido cisteína. O LTB4 e os cys-LTs atuam em receptores diferentes e têm funções biológicas diferentes. O LTB4 atua especificamente nos receptores LTB encontrados na superfície de células como os neutrófilos. A ativação do receptor LTB causa uma elevação do Ca2+ intracelular e a queda na adenosina 3’5’ monofosfato cíclico (AMPc), conduzindo a uma resposta quimiotáxica. Os cys-LTs atuam nos receptores cys-LT das células alvo como por exemplo o músculo liso brônquico, determinando contração. No homem, o principal receptor é o tipo cys-LT1, que é fortemente ativado pelo LTC4 e LTD4 e menos intensamente pelo LTE4. Outros receptores cys-LT2 podem existir nos pulmões, principalmente em seus vasos. Sua importância na asma ainda não foi determinada.
Os leucotrienos difundem-se rapidamente pela circulação, e no fígado são beta-oxidados em metabólitos inativos carbono-18-, -16 e -14, sendo excretados pela bile. Uma proporção fixa (cerca de 5%) dos cys-LTs, sintetizados nos pulmões e em outras partes, é encontrada inalterada na urina como LTE4. O LTE4 urinário é utilizado, na prática, como marcador da síntese de leucotrienos, servindo também para monitorar a eficácia das drogas inibidoras de síntese.
Os leucotrienos LTC4 e LTD4 atuam como potentes broncoconstritores agindo em receptores na musculatura lisa das vias aéreas, sendo de 1.000 a 10.000 vezes mais potentes que a histamina in vivo e in vitro.12 O LTE4 é 10 vezes menos potente que o LTC4 e LTD4, porém é 10–100 vezes mais potente que a histamina, sendo a contração muscular intensamente prolongada.
Os leucotrienos são uns dos mais potentes secretagogos de muco nos bronquíolos humanos, sendo 100 vezes mais potentes do que agonistas colinérgicos (metacolina) e outros secretagogos (prostanoides). Em humanos, a lentificação do transporte mucociliar que se segue à inalação de alérgenos é bloqueada por antagonistas de receptores de cys-LTS (cys-LTRA).
O LTC4 e LTD4 atuam no endotélio de vênulas pós-capilares permitindo extravasamento de macromoléculas gerando edema e via receptores cys-LT2 determinam constrição das veias pulmonares. Os cys-LTs podem upregulate a expressão de adesão de moléculas (p.ex. P-selectinas) no endotélio vascular, favorecendo a marginação dos leucócitos. Estimulam a PLA2 com a subsequente ativação de prostaglandinas e tromboxane.
Na inflamação crônica os cys-LTs têm uma potente ação quimiotáxica para atrair eosinófilos para o local da inflamação. Este efeito pode ser mediado: por ação quimiotáxica direta nos eosinófilos via receptores cys-LT; upregulation das moléculas de adesão no endotélio vascular pulmonar; interação com citocinas que interferem na eosinopoiese ou interferindo na apoptose (morte celular programada).
No remodelamento brônquico os cys-LTs participam na estimulação da síntese e degradação de colágeno por fibroblastos, na proliferação de células epiteliais brônquica, e em ação coordenada junto a fatores de crescimento favorecem a proliferação de células musculares lisas.13
Alguns estudos sugerem ações anti-inflamatórias para o montelucaste, único modulador de leucotrienos comercializado no Brasil. Acredita-se que o seu mecanismo de ação esteja relacionado à inibição da transcrição de citocinas pró-inflamatórias através do fator nuclear-kB (NF-kB),14 supressão do receptor solúvel da Interleucina-2 (IL)-2, redução dos níveis do fator de necrose tumoral alfa (TNF-a)15 e inibição da protease eosinofílica, determinando redução da infiltração eosinofílica das vias aéreas.16
O LTB4 é um potente agente quimiotáxico para polimorfonucleares, que estão implicados na asma neutrofílica, asma fatal e quase-fatal, tendo efeito imunomodulador na proliferação de linfócitos, induzindo a transformação em supressores ou citotóxicos. Interferem ainda na síntese de citocinas pelas células T. Em altas doses promovem degranulação e geração de superóxido. LTB4 promove adesão de polimorfonucleares e eosinófilos ao endotélio vascular e sua migração transendotelial.17,18 Quando inalado o LTB4 não causa broncoconstrição ou alteração na responsividade brônquica em pacientes com asma ou normais.
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
Referências
01.Harper HA. Manual de Química Fisiológica. São Paulo. Ateneu Editora São Paulo S.A., 3ª ed. 1973.
02.Woods JW, Evans JF, Ethier D, Scott, S, Vickers PJ, Hearn L, Heibein JA, Charleson S, Singer I.5-Lipoxygenase and 5-Lipoxygenase activating protein are localized in the nuclear envelope of actived human leukocytes. J Exp Med 1993;178:1935-46.
03.Weiss J, Wright G. Mobilization and function of extra cellular phospholipase A2 in inflammation. Adv Exp Biol 1990; 275:103-13.
04.Dennis EA, Rhee SG, Billah MM, Hannum YA. Role of phospholipase in generating lipid second messengers in signal transduction. FASEB J 1991; 5:2068-77.
05.Hisamatsu K, Ganbo T, Nakazawa T, Murakami Y. Platelet activating factor induced respiratory mucosal damage. Lipids 1991; 26:1287-91.
06.Nieminen MM, Moilanen EK, Nyholm J-E, Koskinen MO, Karvonen JI, Metsä-Ketelä TJ, Vapaatalo H. Platelet-activating factor impairs mucociliary transport and increases plasma leukotriene B4 in man. Eur Respir J 1991; 4:551-60.
07.Rola-Pleszczynski M, Stankova J. Modulation of cytokine gene expression by LTB4 and PAF: transcriptional and post-transcriptional regulation. In: Bailey J, ed. Prostaglandins, leukotrienes, lipoxins, and PAF. New York: Plenum Press, 1991; 329-334.
08.Dubois C, Bissonnette E, Rola-Pleszczynski M. Platelet-activating factor (PAF) enhances tumor necrosis factor production by alveolar macrophages. Prevention by PAF receptor antagonists and lipoxygenase inhibitors. J Immunol 1989; 143:964-70.
09.Lam BK, Owen WF JR, Austen KF, Soberman RJ. The identification of a distinct export step following the biosynthesis of leukotriene C4 by human eosinophils. J Biol Chem 1989; 264:12885-9.
10.Loe DW, Almquist KC, Deeley RG, Cole SPC. Multidrug resistance protein (MRP)-mediated transport of leukotriene C4 and chemotherapeutic agents in membrane vesicles: demonstration of gluthation of gluthathione-dependent vincristine transport. J Biol Chem 1996;271:9675-82.
11.Feldberg W, Kellaway CH. Liberation of histamine and formation of lyscithin-like substances by cobra venom. J Physiol 1938; 94:187-226.
12.Drazen JM, Austen KF, Lewis RA, Clark DA, Goto G, Marfat A, Corey EJ.
Comparative airway and vascular activities of leukotrienes C-1 and D in vivo and in vitro. Proc Natl Acad Sci USA 1980; 77:4354-8.
13.Sampson AP, Holgate ST. Leukotriene Modifiers in Asthma Treatment. London. Martin Dunitz Ltd, 1999.
14.Maeba S, Ichiyama T, Ueno Y et al. Effect of montelucast on nuclear factor kB activation and proinflammatory molecules. Ann Allergy Asthma Immunol 2005; 94:670-674.
15.Can M, Yuksel B, Demirtas S, ey al. The effect of montelukast on soluble interleukin-2 receptor and tumor necrosis factor alpha in pediatric astham. Allergy Asthma Proc 2006; 27:383-386.
16.Langlois A, Ferland C, Tremblay GM, et al. Montelukast regulates eosinophil protease activity through a leukotriene-independent mechanism. J Allergy Clin Immunol 2006; 118:113-119.
17.Goetzl EJ, Pickett WC. The human PMN leukocyte chemotactic activity of complex hydroxy-eicosatetraenoic acids (HETEs). J Immunol 1980; 125:1789-91.
18.Samuelsson B. Leukotrienes: mediators of immediate hypersensitivity reactions and inflammation. Science 1983; 220:568-75.
19.Zafirlukast. Product Monograph. 1997.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|