|
Asma
ADESÃO DE MOLÉCULAS
A asma é uma doença inflamatória crônica heterogênea caracterizada por hiper-responsividade das vias aéreas, cuja causa ainda não está completamente conhecida. Vários tipos de células participam em seu processo inflamatório, como mastócitos, macrófagos / monócitos, eosinófilos, linfócitos T auxiliares Tipo 2 (TH2), células dendríticas, basófilos, neutrófilos e plaquetas. Todas as células do organismo apresentam proteínas transmembrana caracterizadas como receptores de adesão e de acordo com sua função, atuam na facilitação quanto à adesão da célula a outras células ou à matriz celular. As moléculas de adesão desempenham papéis críticos na manutenção da integridade estrutural de todos os componentes da parede das vias aéreas.
Em patologias como a asma, os leucócitos devem aderir ao endotélio vascular que reveste a microcirculação brônquica, com a migração transendotelial posterior para a luz das vias aéreas, para a perpetuação da reação inflamatória. As moléculas de adesão celular estão envolvidas em praticamente todas as etapas desse processo.1,2
As moléculas de adesão celular (CAMs) são glicoproteínas expressas na superfície das células que medeiam o contato e a comunicação célula a célula.
|
Essas proteínas são receptores transmembranares compostos por três domínios: intracelular, transmembrana e extracelular. As CAMs medeiam o contato entre duas células através dos receptores de adesão celular que permitem que as células reconheçam e liguem moléculas em outras células ou na matriz extracelular. Os receptores podem formar adesões homofílicas ou homotípicas – entre o mesmo tipo de moléculas (Caderina – caderina) ou heterofílicas ou heterotípicas – entre diferentes tipos de moléculas (Selectinas – mucinas). O processo de adesão é essencial e ocorre em vários eventos biológicos como: morfogênese, crescimento e diferenciação celular, organização tecidual, regulação da apoptose, inflamação, resposta do hospedeiro às infecções e injúria, cicatrização e resposta imunocelular.
As CAMs funcionam ainda como moléculas sinalizadoras e têm participação essencial na regulação da inflamação e resposta imune, como ocorre na asma. As CAMs são responsáveis pela adesão intercelular, adesão celular ao epitélio e ao endotélio, recrutamento e migração seletiva de células inflamatórias dos vasos sanguíneos até o local da inflamação. As citocinas e outros mediadores inflamatórios influenciam o número e a função das CAMs. A seletividade depende do mediador e do tipo de célula envolvida.3-5
As moléculas de adesão estão divididas em cinco superfamílias, dependendo de características moleculares comuns: integrinas, selectinas, mucinas, superfamília das imunoglobulinas e caderinas.5-8 (Tabela 1)
Tabela 1 – Principais CAMs envolvidas na migração transendotelial dos leucócitos.Fonte com modificações: Referências 1,6

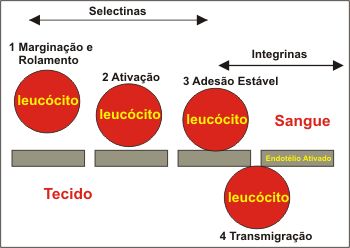 No sítio da inflamação ocorre um extravasamento de leucócitos. Neste processo ocorre inicialmente a vasodilatação de vênulas pós-capilares e mudanças no fluxo sanguíneo com desaceleração, resultando na marginação dos leucócitos ao longo do endotélio vascular, processo este mediado por selectinas e seus ligantes opostos, ricos em carboidratos.9,10 A afinidade de ligação das selectinas é relativamente baixa, mas é suficiente para servir de freio biológico, fazendo com que o leucócito desacelere rapidamente ao rolar nas células endoteliais. Enquanto rolam, os leucócitos podem ser ativados por quimiotáticos, aumentando assim muito a afinidade de seus receptores de adesão de integrina ß2 para ligantes no endotélio ativado. Quando ocorre a ativação do leucócito sobrevém a parada do rolamento com firme adesão às células endoteliais, evento este resultante da ligação de integrinas ß1e ß2 expressas nos leucócitos com vários membros da superfamília das imunoglobulinas expressas no endotélio (ICAM-1, ICAM-2 e VCAM-1). Após a firme fixação ocorre o achatamento da célula, reduzindo a exposição às forças decorrentes do fluxo sanguíneo vascular, aumentando-se desta forma a área de contato com a superfície endotelial vascular. Um sinal quimiotático presente fora da vênula induz os leucócitos a se introduzirem entre as células endoteliais da vênula, quando finalmente o leucócito migra entre as células endoteliais da região apical para a superfície basolateral (diapedese) em direção ao extravascular para o centro inflamatório (Figura 1).6,8,11-13 No sítio da inflamação ocorre um extravasamento de leucócitos. Neste processo ocorre inicialmente a vasodilatação de vênulas pós-capilares e mudanças no fluxo sanguíneo com desaceleração, resultando na marginação dos leucócitos ao longo do endotélio vascular, processo este mediado por selectinas e seus ligantes opostos, ricos em carboidratos.9,10 A afinidade de ligação das selectinas é relativamente baixa, mas é suficiente para servir de freio biológico, fazendo com que o leucócito desacelere rapidamente ao rolar nas células endoteliais. Enquanto rolam, os leucócitos podem ser ativados por quimiotáticos, aumentando assim muito a afinidade de seus receptores de adesão de integrina ß2 para ligantes no endotélio ativado. Quando ocorre a ativação do leucócito sobrevém a parada do rolamento com firme adesão às células endoteliais, evento este resultante da ligação de integrinas ß1e ß2 expressas nos leucócitos com vários membros da superfamília das imunoglobulinas expressas no endotélio (ICAM-1, ICAM-2 e VCAM-1). Após a firme fixação ocorre o achatamento da célula, reduzindo a exposição às forças decorrentes do fluxo sanguíneo vascular, aumentando-se desta forma a área de contato com a superfície endotelial vascular. Um sinal quimiotático presente fora da vênula induz os leucócitos a se introduzirem entre as células endoteliais da vênula, quando finalmente o leucócito migra entre as células endoteliais da região apical para a superfície basolateral (diapedese) em direção ao extravascular para o centro inflamatório (Figura 1).6,8,11-13
As sucessivas etapas descritas até a migração transendotelial – captura e rolamento, adesão e diapedese – à exceção da marginação oriunda de modificações nas condições hemodinâmicas da circulação sanguínea,14,15 todas se originam por interações celulares e são mediadas pela expressão de CAMs localizadas na superfície dos leucócitos e células endoteliais, assim como de seus ligantes.6,8,12,13
A família das selectinas é composta por uma família de glicoproteínas de cátions divalentes dependentes encontrados apenas em células vasculares, que medeiam interações iniciais de adesão entre leucócitos intravasculares e o endotélio vascular, em áreas de inflamação.16 São proteínas que ao contrário da maioria das moléculas de adesão, que se ligam a outras proteínas, as selectinas interagem com ligantes de carboidratos em leucócitos e células endoteliais. Os três membros da família das selectinas operam nos sistemas vascular e hematológico. A família de selectinas é formada por três proteínas de acordo com as células onde foram identificadas pela primeira vez: E-selectina (Epitelial), P-selectina Plaqueta) e L-selectina (Leucócito). A afinidade das selectinas com seus ligantes é relativamente baixa.7 Isto proporciona um contato dos leucócitos à parede vascular (captura), facilitando o rolamento dessas células ao longo do endotélio, impulsionadas pelo fluxo sanguíneo.7,15 A E-selectina é sintetizada e expressa exclusivamente, por breve período (horas), no endotélio vascular após estimulação pelas citocinas e lipossacarídeos (LPS). Ela não é estocada. Cerca de 4 h após a exposição às citocinas ocorre o pico da expressão, que perdura por 12 h. A E-selectina e a P-selectina, encontradas na superfície endotelial, funcionam como sítios de ligação para a L-selectina. A P-selectina é sintetizada constitutivamente pelas plaquetas e por células endoteliais e armazenada nos corpos de Weibel-Palade.17 Após a exposição das células endoteliais aos mediadores inflamatórios (histamina, trombina, C5a) a P-selectina é rapidamente mobilizada para a superfície celular, onde é transitoriamente expressa (30 minutos). A P-selectina tem sua transcrição upregulated por várias citocinas, incluindo-se a IL-4 que apresenta importante participação nos processos inflamatórios alérgicos. A L-selectina está constitutivamente presente na superfície microvilosa da maioria dos leucócitos e tem como função a firme fixação inicial dos leucócitos ao endotélio vascular. Desempenha um papel importante em muitos mecanismos de defesa do hospedeiro. Nesta etapa, o íntimo contato com as células endoteliais possibilita aos leucócitos encontrar fatores de ativação específicos que induzem a sua firme união e posterior diapedese.18
As integrinas são glicoproteínas transmembrana, compostas por dois heterodímeros não covalentes designados como subunidades a e ß, cada uma com grande domínio extracelular e pequena, porém importante, extensão citoplasmática. Participam na organização tissular e como receptores para outras moléculas de adesão. A adesão mediada pela integrina é um processo que requer energia, que também depende de cátions divalentes extracelulares. Essas moléculas são onipresentes, com pelo menos um heterodímero presente em todas as células nucleadas in vivo.19 São pelo menos 18 subunidades a e oito ß que já foram clonadas e sequenciadas em humanos, gerando 24 heterodímeros.20 Os leucócitos expressam pelo menos 13 diferentes integrinas as quais medeiam a ligação com as células endoteliais. As ß2 integrinas promovem o recrutamento de leucócitos para os locais de inflamação, promovendo a adesão dos leucócitos circulantes ao endotélio vascular, a migração transendotelial,21,22 a formação de sinapses imunológicas nos leucócitos23 e a sinalização inflamatória nas células envolvidas.24 As ß2 integrinas (subfamílias ß1 e ß2 ) ao contrário das selectinas, interagem de forma intensa com os seus ligantes nas células endoteliais, dando origem ao processo de adesão, regulam o recrutamento de leucócitos e participam na sinalização imunológica. As integrinas da subfamília ß7 têm sido descritas como as principais moléculas que participam da adesão dos leucócitos ao endotélio durante a migração transendotelial. As mais importantes para adesão endotelial são as integrinas ß1, ß2 (CD18) e ß7.25 A subfamília ß2 é expressa em todos os leucócitos e consiste em uma subunidade ß2 ligada a uma das quatro subunidades a: CD11a (aL), CD11b (aM), CD11c (aX) ou CD11d (aD). Os linfócitos produzem primariamente CD11a/CD18 (LFA-1 ou lymphocyte function associated antigen-1), enquanto que os eosinófilos, neutrófilos e monócitos produzem, todos, as quatro ß2 integrinas. A expressão de uma ou mais integrinas ocorre na superfície de qualquer célula do organismo, exceto em eritrócitos maduros.26 As integrinas participam da adesão célula-célula, da ligação e das interações das células com componentes da matriz extracelular, como a fibronectina.
Uma característica importante das integrinas é que elas existem nos estados ativo e inativo.
A superfamília das imunoglobulinas (IgSF) consiste em uma multiplicidade de proteínas da superfície celular de cadeia única, que contêm um ou mais domínios IG ou semelhantes à Ig (unidades de homologia Ig).6,8,13 Têm função por ligação homotípica e heterotípica. Participam nos processos de reconhecimento, ligação ou adesão de células. Todos possuem uma região extracelular conhecida como domínios ou dobras de imunoglobulina.27 Cerca de 40% dos 150 ou mais polipeptídeos que têm sido caracterizados na superfície dos leucócitos pertencem a esta superfamília. Estão incluídos nesta superfamília de Ig: anticorpos, receptores de células T, proteínas MHC e coreceptores CD4+, CD8+ e CD28, receptores FC nos linfócitos e várias moléculas de adesão celular. Os membros desta família incluem uma variedade de moléculas de adesão celular neuronais como a NCAM (neural cell adhesion molecule), a NgCAM (neuron glial cell adhesion molecule)28 e moléculas expressas no endotélio vascular, importantes na adesão leucócito-endotelial como a VCAM-1 (vascular cell adhesion 1), a PECAM-1 (platelet-endothelial cell adhesion molecule 1), as ICAM-1,-2,-3 (intercellular adhesion molecule 1,2,3) e a MAdCAM-1 (mucosal addressin cell adhesion molecule – 1).29-32
Conforme antes mencionado ICAM-1, ICAM-2, ICAM-3, VCAM-3 e MadCAM-1 são ligantes para CAMs pertencentes a famílias das selectinas e integrinas. Por outro lado a PECAM-1 funciona como seu próprio ligante, pois realiza interações de caráter homotípico com moléculas do mesmo tipo expressas em outras células.15
A ICAM-1 é um simples polipeptídeo transmembrana dos domínios tipo 5-Ig-C2. Os sítios de ligação para o CD11a estão nos domínios 1 e 2 e para o CD11b no domínio 3. A ICAM-1 é constitutivamente expressa no epitélio, nos fibroblastos e a baixos níveis nas células endoteliais, tendo a sua transcrição também regulada por várias citocinas e pela LPS. A VCAM-1 também é expressa pelas células endoteliais e algumas células dendríticas e consiste de sete domínios Ig cujos domínios 1-3 e 4-6 são homólogos. A VCAM-1 tem a sua expressão basal muito baixa nas células endoteliais, porém pode ser aumentada sob ação de citocinas como a IL-4. Sua fixação maior ocorre através do ligante VLA-4 nos domínios 1 e 4. A PECAM-1 apresenta 6 domínios Ig e é expressa constitutivamente pelas células endoteliais, leucócitos e plaquetas. As mesmas citocinas que estimulam a upregulation da ICAM-1 nas células endoteliais determinam a redistribuição da PECAM-1 para a periferia da célula sem afetar a quantidade total expressa por cada célula; este processo pode facilitar a migração dos leucócitos entre as células endoteliais adjacentes. A MAdCAM-1 contém três domínios Ig, dois do tipo C2 e um tipo A1. A MAdCAM-1 também apresenta um domínio mucina-like que serve como ligante para L-selectina. Ainda é pouco conhecido sobre a regulação da expressão da MAdCAM-1.
A família das caderinas é constituída de proteínas que medeiam a adesão célula-célula dependente de Ca2+ nas junções celulares.
Elas formam estruturas semelhantes ao zíper nas junções aderentes, regiões de membrana onde uma célula faz contato com outras células.33 E por último a quinta classe de glicoproteínas, a das mucinas, que servem como ligantes de glicoproteína para as selectinas.34
Na ausência de inflamação raramente os leucócitos interagem com o endotélio vascular. O recrutamento de leucócitos para o local da inflamação envolve uma sequência de eventos bem coordenada e dinâmica, na qual várias CAMs e citocinas quimiotáxicas (quimocinas, anafilatoxinas, mediadores lipídicos) participam ativamente.35 A adesão dos leucócitos circulantes ao endotélio vascular é fundamental para uma efetiva defesa contra infecção e injúria. Os leucócitos devem aderir ao endotélio, penetrar na parede do vaso, transpô-la e migrar para o sítio da inflamação.
No caso específico da inflamação crônica alérgica, como a da asma, ainda questiona-se como os eosinófilos (porém não os neutrófilos) são seletivamente recrutados. |
|
Como a asma é caracterizada pelo excessivo acúmulo de eosinófilos e de linfócitos T nas vias aéreas, particularmente na submucosa, torna-se muito importante compreender as interações iniciais destas células com o endotélio da microvasculatura brônquica assim como o seu recrutamento pela circulação. Dados sugerem o envolvimento de interações entre E-selectinas36,37 e seus ligantes ICAM-1 e LFA-1 (leucocyte function associated antigen) (aLß2) e entre VCAM-1 e VLA-4 (very late antigen) (a4ß1) no recrutamento de eosinófilos na resposta alérgica das vias aéreas. Outros estudos demonstram que para os eosinófilos e linfócitos T, as integrinas a4ß1, a4ß7 e o CD44 são capazes de mediarem respectivamente o rolamento nas VCAM-1, MAdCAM-1 e em superfícies cobertas por derivados do ácido hialurônico.
Um grupo de moléculas expressas no endotélio vascular liga-se às ß2 integrinas (família CD18) da superfície dos leucócitos facilitando a firme adesão intercelular ao endotélio microvascular,38-40 seguida por transmigração. Incluem-se neste grupo da superfamília das imunoglobulinas, moléculas de adesão intercelular ICAM-1 e 2, VCAM-1 e as relacionadas às plaquetas – PeCAM-1. As ß2 integrinas interagem com as moléculas ICAM-1 das células endoteliais, enquanto que as ß1 integrinas interagem com as moléculas VCAM-1. A via CD18-ICAM-1 é utilizada por todos os leucócitos, enquanto que a via VLA-4/VCAM-1 é utilizada somente por eosinófilos e mononucleares.41 O acúmulo seletivo nas respostas inflamatórias alérgicas, de eosinófilos e em menor expressão pelos linfócitos e monócitos, é gerado pela via VLA-4/VCAM-1, induzida pela liberação de IL-4 e IL-13 dos linfócitos TH2. O início ou aumento da expressão ICAM-1 nas células endoteliais decorre da ação de mediadores pró-inflamatórios tais como a IL-1, IFN-g e TNF-a.
Após completada a adesão dos leucócitos ao endotélio, eles migram pela superfície da luz para alojarem-se na junção intercelular onde “forçam passagem” entre as células endoteliais para ingressarem no espaço extravascular. As PeCAM-1 situam-se nas junções basolaterais das células endoteliais, incluindo zonas de junção intercelular, e atuam facilitando a transmigração de neutrófilos através da barreira endotelial.42,43 Nesta migração transendotelial participam ainda várias integrinas (a5ß1, a4ß1, aVß3, aLß2, e aMß2) e membros da IgSF como a ICAM-1, a VCAM-1 e já citada PECAM-1.
A subsequente migração subendotelial através do tecido extravascular é dependente de gradientes de quimiocinas, citocinas quimiotáticas e interações de adesão com a matriz extracelular. Baixas concentrações de IL-844,45 produzidas pelo endotélio vascular e secretada nas regiões subendoteliais aumentam a adesão leucocitária e induzem a sua migração. Outras substâncias quimiotáxicas como IL-2, IL-5, RANTES (regulated upon activation in normal T-cells, expressed and secreted), PAF, eotaxina-1 e 2 (específicas para eosinófilos)46,47 também favorecem a migração transendotelial para o espaço extravascular. A adesão via LFA-1 e Mac-1 facilita a migração transendotelial de neutrófilos,48-51 sendo que estudos mais recentes demonstraram mecanismos semelhantes para os eosinófilos.50,51 A migração transendotelial do eosinófilo pode ser aumentada pela exposição dos eosinófilos a IL-552 ao GM-CSF52,54 ou a expressão upregulate do CD11b.
Ao final, já no foco inflamatório, os leucócitos ampliam suas funções citotóxicas, liberando oxidantes, proteases e outros produtos como fatores de crescimento e citocinas. Os eosinófilos ao contrário dos neutrófilos podem sobreviver nos tecidos por períodos longos, às vezes semanas, dependendo das citocinas do microambiente.55 Acredita-se que os eosinófilos possam autorregular sua própria sobrevivência através de uma via autócrina.56,57
A adesão de moléculas tem uma participação muito importante no processo inflamatório da asma não só no que se relaciona aos leucócitos e às células endoteliais, mas também por intermédio de mastócitos que expressam ß1 integrinas; macrófagos que produzem ICAM-1, VLA-4, PSGL-1, L-selectinas e CD11b; células dendríticas que produzem VLA-4 e PSGL-1 e células epiteliais que expressam a ICAM-1.58
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
Referências
01.Lordan JL, HellewellPG. – Cytokines, Chemokines, and Adhesion Proteins. In: Holgate ST, Church MK and Lichtenstein LM. Allergy. London: Mosby; 2001:283-302.
02.Johansson MW, Annis DS, Mosher DF. a(M)ß(2) integrin-mediated adhesion and motility of IL-5-stimulated eosinophils on periostin. Am J Respir Cell Mol Biol 2013; 48:503-510.
03.Carlos TM, Harlan JM. Leukocyte-endothelial adhesion molecules. Blood 1994; 84:2068-101.
04.Springer TA. Traffic signals on endothelium for lymphocyte recirculation and leukocyte emigration. Annu Rev Physiol 1995; 57:827-72.
05.Dunon D, Piali L, Imhof BA. To stick or not to stick: the new leukocyte homing paradigm. Curr Opin Cell Biol 1996; 8 :714-23.
06.VALOIS, CRA. Estudo da expressão de moléculas de adesão celular durante a migração transendotelial dos leucócitos no pulmão de camundongos tratados com nanopartículas magméticas recobertas com DMSA. Tese (Mestrado em Ciências da Saúde) – Faculdade de Ciências de Saúde da Universidade de Brasília – DF. p 103. 2006.
07.Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P.– Molecular biology of the cell.
4th edn. New York: 2002: 2002.
08.Simon SI, Green CE. Molecular mechanics and dynamics of leukocyte recruitment during inflammation. Annu Rev Biomed Eng 2005; 7:157-185. .
09.Spertini O, Luscinskas FW, Gimbrone MA, Tedder TF. Monocyte attachment to activated human vascular endothelium in vitro is mediated by leukocyte adhesion molecule-1 (L-selectin) under nonstatic conditions. J Exp Med 1992; 175:1789-92.
10.Knol EF, Tackey F, Tedder TF, et al . Comparison of human eosinophil and neutrophil adhesion to endothelium cells under nonstatic conditions. Role of L-selectin. J Immunol 1994; 153:2161-7.
11.Frenette PS, Wagner DD. Adhesion molecules — Blood vessels and blood cells. N Engl J Med 1996; 335:43-45.
12.Luscinskas FW, Ma S, Nusrat A, Parkos CA, Shaw SK. Leukocyte transendothelial migration: a junctional affair. Semin Immunol 2002; 14:105-13.
13.Burns AR, Smith CW, Walker DC. Unique structural features that influence neutrophil emigration into the lung. Physiol Rev 2003; 83:309-36.
14.Doerschuk CM. Leukocyte trafficking in alveoli and airway passages. Respir Res 2000; 1:136-40.
15.Wagner JG, Roth RA. Neutrophil migration mechanisms, with an emphasis on the pulmonary vasculature. Pharmacol Rev 2000; 52:349-74.
16.McEver RP, Moore KL, Cummings RD. Leukocyte trafficking mediated by selectin-carbohydrate interactions. J Biol Chem 1995; 270:11025.
17.Valentijn KM, Sadler JE, Valentijn JA, Voorberg J, Eikenboom J. Functional architecture of Weibel-Palade bodies. Blood 2011; 117:5033-5043.
18.Barkhausen T, Krettek C, van Griensven M. L-selectin: adhesion, signalling and its importance in pathologic posttraumatic endotoxemia and non-septic inflammation. Exp Toxicol Pathol 2005; 57:39-52.
19.Pilewski JM, Albelda SM. – Cell Adhesion Molecules. – In. Barnes PJ, Grunstein MM, Leff AR, Woolcock AJ. Asthma. Philadelphia: Lppincott-Raven; 1997:523-534.
20.Takada Y, Ye X, Simon S. The integrins. Genome Biol 2007; 8: 215.
21.von Andrian UH, Chambers JD, McEvoy LM, Bargatze RF, Arfors KE, Butcher EC. Two-step model of leukocyte-endothelial cell interaction in inflammation: distinct roles for LECAM-1 and the leukocyte beta 2 integrins in vivo. Proc Natl Acad Sci U S A 1991; ;88 :7538-42.
22.Lämmermann T, Bader BL, Monkley SJ, Worbs T, Wedlich-Söldner R, Hirsch K, Keller M, Förster R, Critchley DR, Fässler R, Sixt M. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature 2008; 1;453:51-5.
23. Monks CR, Freiberg BA, Kupfer H, Sciaky N, Kupfer A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature 1998; 395:82-86.
24.Szukiewicz D, Kochanowski J, Mittal TK, Pyzlak M, Szewczyk G, Cendrowski K. Chorioamnionitis (ChA) modifies CX3CL1 (fractalkine) production by human amniotic epithelial cells (HAEC) under normoxic and hypoxic conditions. J Inflamm 2014; 13;11-12.
25.Tan SM. The leucocyte ß2 (CD18) integrins: the structure, functional regulation and signalling properties. Biosci Rep 2012; 32:241-269.
26.Diamond MS, Springer TA. The dynamic regulation of integrin adhesiveness. Current Biology 1994; 4:506-17.
27.William AF, Barclay AN. The immunoglobulin supergene famili-domains for cell surface recognition. Annu Rev Immunol 1988; 6:381-405.
28.Baldwin TJ, Fazeli MS, Doherty P, Walsh FS. Elucidation of molecular actions of NCAM and structurally related cell adhesion molecules. J Cell Biochem 1996; 61:502-513.
29.Streeter PR, Lakey-Berg E, Rouse BTN, Bargatze RF, Butcher EC. A tissue-specific endothelial cell molecule involved in lymphocyte homing. Nature 1988; 331:41-46.
30.Simmons DL. The role of ICAM expression in immunity and disease. Cancer Surv 1995; 24:141-55.
31.Wang JH, Pepinsky RB, Stehle T, et al . The crystal structure of an N-terminal two-domain fragment o f vascular cell adhesion molecule (VCAM-1): a cyclic peptide based on the dolain 1 C=D loop can inhibit VCAM-1-alpha 4 integrin interaction. Proc Nat Acad Sci USA 1995; 92:5714-5718.
32.DeLisser HM, Baldwin HS, Albelda SM. Platelet endothelial cell adhesion molecule 1 (PECAM-1/CD31): a multifunctional vascular cell adhesion molecule. Trends Cardiovasc Med 199; 7:203-210.
33.Frenette PS, Wagner DD. Adhesion molecules. N Engl J Med 1996; 334:1526-1529.
34.Kansas GS. Selectins and their ligands: current concepts and controversies. Blood 1996; 88:3259-287.
35.Manning AM, Anderson DC, Bristol JA.(eds). Annual Reports in Medicinal Chemistry. San Diego, Academic Press, 1994.
36.Symon FA, Walsh GM, Watson SR, Wardlaw AJ. Eosinophil adhesion to nasal polyp endothelium is P-selectin-dependent. J Exp Med 1994; 180:371-6.
37.Wein M, Sterbinky SA, Bickel CA, Scheimer RP, Bochner BS. Comparison of human eosinophil and neutrophil ligands for P-selectin: ligands for P-selectin differ from those for E-selectin. Am J Respir Cell Mol Biol 1995; 12:315-9.
38.Dustin ML, Rothlein R, Bhan AK, Dinarello CA, Springer TA. Induction by IL 1 and interferon-gamma: tissue distribution, biochemistry, and function of a natural adherence molecule (ICAM-1). J Immunol 1986; 137:245-54.
39.Lamas AM, Mulroney CM, Scheimer RP. Studies on adhesive interaction between purified human eosinophils and cultured vascular endothelial cells. J Immunol 1988; 140:1500-5.
40.Wegner CD, Gundel RH, Reilly P, Haynes N, Letts G, Rothlein R. Intercellular adhesion molecule-1 (ICAM-1) in the pathogenesis of asthma. Science 1990; 247:456-9.
41.Rothemberg ME. Eosinophilia. N Engl J Med 1998; 338:1592-600.
42.Albelda SM, Muller WA, Buck CA, Newman PJ. Molecular and cellular properties of PeCAM-1 (endoCAM/CD31): a novel vascular cell-cell adhesion molecule. J Cell Biol 1991; 114:1059-68.
43.Albelda SM, Oliver P, Romer L, Buck CA. EndoCAM: a novel endothelial cell-cell adhesion molecule. J Cell Biol 1990; 110:1227-37.
44.Huber AR, Kunkel SL, Todd RFI, et al. Regulation of transendothelial migration by endogenous interleukin-8. Science 1991; 254:99-102.
45.Huber HL, Koessler KK. The pathology of bronchial asthma. Arch Intern Med 1992; 30:689.
46.José PJ, Griffiths-Johnson DA, Collins PD et al. Eotaxin: a potent co-eosinophil chemoattractant cytokine detected in a guinea pig model of allergic airways inflammation. J Exp Med 1994; 179:881-7.
47.Forssman U, Uguccioni M, Loetscher P, et al. Eotaxin-2, a novel CC chemokine that is selective for the chemokine receptor CCR3, and acts like eotaxin on human eosinophil and basophil leukocytes. J Exp Med 1997; 185:2171-76.
48.Smith Cw, Marlin SD, Rothlein R, Toman C, Anderson DC. Cooperative interactions of LFA-1 and Mac-1 with intercellular adhesion molecule-1 in facilitating adherence and transendothelial migration of human neutrophils in vitro . J Clin Invest 1989; 83:2008-17.
49.Diamond MS, Staunton DE, de Fougerolles AR, et al . ICAM-1 (CD54): a counter-receptor for Mac-1 (CDllb/CD18). J Cell Biol 1990; 111:3129-39.
50.Diamond MS, Staunton DE, Marlin SD, Springer TA. Binding of the integrin Mac-1 (CD11b/CD18) to the third immunoglobulin-like domain of ICAM-1 (CD54) and its regulation by glycosylation. Cell 1991; 65:961-71.
51.Furie MB, Tancinco MVA, Smith CW. Monoclonal antibodies to leukocyte integrins CD11a/CD18 and CD11b/CD18 or intercellular adhesion molecule-1 inhibit chemoattractant-stimulated neutrophil trabsebdothelial migration in vitro . Blood 1991; 78:2089-97.
52.Ebisawa M, Liu MC, Yamada T, et al . Eosinophil transendothelial migration induced by citokines. II. Potentiation of eosinophil tranendothelial migration by eosinophil-active cytokines. J Immunol 1994; 152:4590-6.
53.Erger RA, Casale TB. IL-8 is a potent mediator of eosinophil chemotaxis through endothelium and epithelium. AM J Physiol 1995; 268:L117-22.
54.Tomioka K, MacGlashan DWJ, Lichtenstein LM, Bochner BS, Schleimer RP. GM-CSF regulates human eosinophil responses to F-Met peptide and platelet activating factor. J Immunol 1993; 151:4989-97.
55.Rothemberg ME, Owen WFJr, Silberstein DS, Soberman RJ, Austen KF, Stevens RL.: Eosinophils cocultured with endothelial cells have increased survival and functional properties. Science 1987; 237:645-7.
56.Kita H. The eosinophil: a cytokine-producing cell? J Allergy Clin Immunol 1996; 97:889-92.
57.Kay AB, Ying S, Durham SR. Phenotype of cells positive for interleukin-4 and interleukin-5mRNA in allergic tissue reactions. Int Arch Allergy Immunol 1995; 107:208-10.
58.Hellewell PG. Adhesion molecule strategies. Pulm Pharmacol Ther 1999; 12:137-41.
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|