|
Asma
Tratamento da Asma
TERMOPLASTIA BRÔNQUICA
A disponibilidade de células de músculo liso das vias aéreas de pacientes com asma, obtidas por biópsia, permitiu demonstrar que, pelo menos em cultura, estas células apresentam uma taxa de multiplicação duas vezes maior do que as células musculares lisas provenientes de pulmões de indivíduos sem a doença.1
O aumento na massa muscular das vias aéreas é atribuído ao fenótipo celular proliferativo, com aumento do número de miócitos, um achado patológico bem documentado em pacientes com asma crônica severa. Como consequência ocorre a hiperplasia e a hipertrofia, as quais contribuem para o exagerado estreitamento da luz brônquica.2-5
A Termoplastia Brônquica (TB) é um procedimento direcionado para pacientes com asma grave, onde ocorre o remodelamento das vias aéreas e as anormalidades da musculatura lisa. É uma proposta de tratamento preconizada na Etapa 5 dos Guidelines GINA,6,7 para a doença de difícil tratamento, quando são utilizadas doses média ou alta de corticoides inalatórios (CI) associadas a um segundo medicamento controle – o corticoide oral (CO), como manutenção, além de broncodilatadores ß2-agonistas de longa ação (LABA). A TB pode ser uma opção adequada ao fenótipo de doença T2-baixa ou para aqueles pacientes que não respondem adequadamente aos biológicos.
A TB é uma técnica que se propõe a reduzir a rigidez das vias aéreas, interferindo na sua resistência e reduzindo a massa muscular lisa. Entretanto, os mecanismos subjacentes de como a TB atua são na maior parte desconhecidos. No entando, é aceita a sua influência indireta
alterando as propriedades do epitélio das vias aéreas,8,9 das glândulas mucosas,10 dos nervos11-13 ou sobre o caráter da inflamação das vias aéreas.14 A redução da inflamação após TB pôde ser evidenciada recentemente através da regeneração de células epiteliais e pelo aumento da expressão e ativação de receptores de glicocorticoides (GR) e pelo aumento da expressão de proteínas de choque térmico (HSP) no epitélio.15
O equipamento empregado é o sistema Alair® para termoplastia brônquica, constituído de um gerador de energia de radiofrequência e um cateter que é introduzido no canal de trabalho do broncofibroscópio (Figura 1).
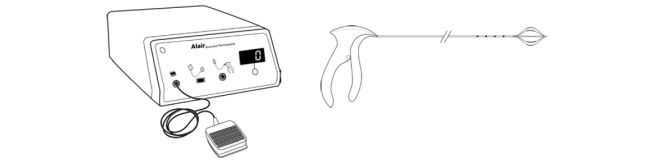
Figura 1 — Sistema Alair para termoplastia brônquica: cateter e controlador de radiofrequência. Imagem cortesia de Boston Scientific Corporation.
O cateter é um dispositivo longo, flexível e de uso único, com uma matriz de eletrodos expansíveis na extremidade distal, que pode ser expandido e retraído por controle manual. Durante o procedimento, a matriz de eletrodos é então expandida para fazer contato com a parede das vias aéreas, e um pedal é pressionado para fornecer energia elétrica de
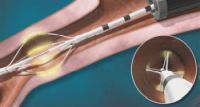 radiofrequência e manter a temperatura de tratamento em 65ºC por 10 segundos (Figura 2). Como a energia elétrica é transferida do eletrodo para o tecido, a resistência faz com que a energia elétrica seja convertida em energia térmica. Isto determina a redução da massa (atrofia ou destruição) da musculatura lisa e terminações nervosas brônquicas, atenuando a resistência das vias aéreas.16,17Após cada “ativação” do cateter por 10 segundos, interrupção, quando os eletrodos se afastam ligeiramente da parede das vias aéreas e o endoscopista move o fibroscópio e o cateter cerca de 5 mm no sentido proximal, e a sequência é repetida até que todo o comprimento de cada via aérea tenha sido tratado. radiofrequência e manter a temperatura de tratamento em 65ºC por 10 segundos (Figura 2). Como a energia elétrica é transferida do eletrodo para o tecido, a resistência faz com que a energia elétrica seja convertida em energia térmica. Isto determina a redução da massa (atrofia ou destruição) da musculatura lisa e terminações nervosas brônquicas, atenuando a resistência das vias aéreas.16,17Após cada “ativação” do cateter por 10 segundos, interrupção, quando os eletrodos se afastam ligeiramente da parede das vias aéreas e o endoscopista move o fibroscópio e o cateter cerca de 5 mm no sentido proximal, e a sequência é repetida até que todo o comprimento de cada via aérea tenha sido tratado.
Os pacientes devem ser instruídos em relação aos aspectos práticos do procedimento para reduzir a ansiedade e facilitar a cooperação. O tratamento é efetuado em três sessões de broncoscopia, cada uma com duração inferior a 1 hora em intervalos de aproximadamente 1 mês, uma para cada lobo inferior e uma para os dois lobos superiores. O lobo médio não é abordado devido às preocupações quanto à possibilidade de causar estenose do brônquio relativamente longo do lobo médio, levando à síndrome do lobo médio.
A TB é um procedimento realizado sob anestesia geral ou sedação consciente.18 A broncoscopia na asma é conhecida por piorar os sintomas e potencialmente induzir complicações, ainda mais na asma grave.19 Os eventos mais comuns foram típicos de irritação das vias aéreas, incluindo agravamento dos sintomas de asma (sibilos, tosse, desconforto e dor torácica) e infecções do trato respiratório superior. Este procedimento aumenta o risco de exacerbação da asma que, na maioria da vezes, responde à terapêutica, mas que pode requerer hospitalização em 3%.19 No paciente suscetível, a alta estimulação térmica pode levar à reação inflamatória com alteração microvascular induzida pelo calor ou pela liberação de mediadores inflamatórios.20 O abscesso pulmonar também foi descrito como uma complicação direta.21
O estudo Asthma Intervention Research (AIR2),19 multicêntrico randomizado, duplo-cego em comparação com o grupo controle simulado, avaliou 288 pacientes tratados com altas doses de CI e LABA, com duração de tratamento de 12 semanas, seguido de período de estudo de 46 semanas, com avaliações em 3, 6, 9 e 12 meses. O VEF1 médio pré-broncodilatador versus controle era de 72,65 ± 10,41 contra 76,12 ± 9,28. O objetivo era avaliar a eficácia e segurança da TB versus o procedimento simulado em indivíduos com asma grave que permanecem sintomáticos apesar do tratamento com altas doses de CI e LABAs.
Os resultados mostraram que a TB reduziu a taxa de exacerbações da asma em 32% no período pós-tratamento (definido como semanas 6–52 pós-procedimento) e melhorou a qualidade de vida específica da asma.
No ensaio clínico AIR2 os efeitos adversos respiratórios foram relatados por 85% dos pacientes após termoplastia brônquica e 76% após o procedimento simulado, piorando principalmente os sintomas de asma e infecções do trato respiratório superior. A internação por sintomas respiratórios após termoplastia brônquica foi necessária em 8,4% (16 pacientes e 19 internações).19
O acompanhamento por cinco anos do AIR2 mostrou que a termoplastia brônquica produziu redução sustentada de 44% nas exacerbações da asma e redução de 78% nos atendimentos de emergência.22 A dose média de CI foi reduzida em 17% em 5 anos. Mais de um quarto (27%) dos pacientes foi capaz de diminuir a dose de manutenção do CI em pelo menos 50% e 7% dos pacientes não precisavam mais de medicamentos para manutenção da asma.22
Outro estudo contínuo foi o PAS2, um ensaio clínico post-market após aprovação pelo FDA que avaliou a termoplastia brônquica na asma persistente grave em 279 indivíduos.
Os primeiros 190 examinados foram comparados com os 190 indivíduos tratados com TB no estudo AIR2 por três anos de acompanhamento. O grupo PAS2 era mais velho (idade média 45,9 contra 40,7 anos) com uma população mais obesa (índice de massa corporal médio 32,5 contra 29,3 kg · m-2) tendo recebido doses mais altas de CI (dose média 2301 contra 1961 mcg · dia-1). Mais pacientes com PAS2 experimentaram exacerbações graves (74% contra 52%) e hospitalizações (15,3% contra 4,2%) nos 12 meses anteriores à TB. No ano 3 após a termoplastia brônquica, a porcentagem de pacientes com PAS2 com exacerbações graves, visitas à emergência e hospitalizações diminuiram significativamente em 45%, 55% e 40%, respectivamente, reproduzindo os resultados do AIR2. O estudo PAS2 demonstra melhorias semelhantes no controle da asma após TB em comparação com o estudo AIR2, apesar de envolver indivíduos que podem ter um controle mais fraco da asma.23
A proporção de pacientes que necessitaram de CO diário diminuiu de 18,9% no início do estudo para 10,2% em três anos. A PAS2 mostrou que 39,9% dos pacientes apresentaram uma ou mais exacerbações no terceiro ano após a TB, que é uma diminuição relativa de 44,6% nas exacerbações em comparação com o ano anterior ao procedimento. As consultas e internações de urgências diminuíram 55% e 40%, respectivamente, após a TB em relação ao ano anterior.23
Em 2022 Chupp et al. descreveram os resultados ao longo de cinco anos para a coorte completa de 284 indivíduos PAS2. Análises de subgrupos com base nas características clínicas e de biomarcadores basais revelaram uma melhora clínica estatisticamente significativa entre todos os subgrupos. No ano cinco pós-tratamento, a proporção de indivíduos com exacerbações graves, visitas ao pronto-socorro e hospitalizações foi de 42,7%, 7,9% e 4,8%, respectivamente, em comparação com 77,8%, 29,4% e 16,1% aos 12 meses anteriores ao tratamento.24
A recomendação do consenso das diretrizes da Global Initiative for Asthma é que a termoplastia brônquica seja agora uma opção possível para adultos com asma não controlada, apesar da terapia máxima e revisão por um especialista em asma.6
Quanto à seleção do paciente, podem ser os mesmos critérios de elegibilidade do AIR2:
1 – Asma que requer manutenção regular com CI (≥ 1000 mcg de budesonida ou equivalente) e ß2-agonista de longa ação (LABA ≥ 100 mcg/dia salmeterol ou equivalente). Outros medicamentos em uso, incluindo modificadores de leucotrieno, omalizumabe (se usado por pelo menos 1 ano antes) e corticoides orais (CO) 10 mg/dia ou menos.
2 – VEF1 pré-broncodilatador ≥ 60%
3 – Hiper-responsividade brônquica (metacolina PC20 < 8 mg/ml)
4 – Sintomas de asma por dois ou mais dias durante período de 4 semanas
5 – Ser não fumantes há pelo menos 1 ano com menos que 10 maços/ano de histórico
6 – Paciente considerado adequado para broncoscopia
Os critérios de exclusão são: asma com risco de vida, doença sinusal crônica, doenças respiratórias como o enfisema, uso de imunossupressores, agentes bloqueadores adrenérgicos ou anticoagulantes e história no ano anterior de três ou mais internações por asma, três ou mais infecções do trato respiratório inferior e quatro ou mais pulsos de corticoide oral para tratar a asma.
Apesar de todos os critérios adotados os efeitos adversos sempre limitaram o emprego da TB na asma grave, sobretudo após as diretrizes de 2014 quando se recomendou restringir seu uso a ensaios clínicos, face à incertaza sobre a segurança em longo prazo.25 A segurança e eficácia a longo prazo foram demonstradas até os cinco anos,22 mas as complicações de curto prazo, todavia, continuam sendo uma preocupação importante.
Hall et al.26 propuseram uma forma de reduzir as complicações diminuindo o número de procedimentos. A técnica inovadora proposta é baseada em imagens de ressonância magnética hiperpolarizada 129Xe (MRI 129Xe). Este método de imagem direcionou o tratamento com TB somente para os segmentos de pulmão que demonstravam falhas na ventilação com a MRI 129Xe. O estudo piloto testou a viabilidade desta técnica e observou que uma única sessão de TB guiada por MRI 129Xe determinou resultados análogos à pontuação de sintomas e qualidade de vida que o tratamento padrão tradicional com três sessões não guiado por imagem alcançava. Esses resultados sugerem que os tratamentos de TB guiados por imagens de ressonância magnética 129Xe podem resultar em efeitos terapêuticos semelhantes com menos procedimentos.
Ainda não está definido qual fenótipo de asma mais se beneficiaria com esse tratamento, mas se os mecanismos de seu efeito benéfico forem atribuíveis a uma redução na massa do músculo liso das vias aéreas, os pacientes em processo de remodelação contínuo podem se beneficiar mais.27
Apesar das diretrizes que recomendam a sua utilização por seu benefício clínico e potencial econômico, com redução de custos a longo prazo, algumas seguradoras ainda consideram a TB um procedimento experimental e, por isso, não cobrem os custos. Isto decorre não só devido ao alto custo inerente ao procedimento, mas aos expressivos resultados alcançados no controle da asma grave após
a aprovação de vários anticorpos monoclonais direcionados a citocinas mediadoras pró-inflamatórias e seus receptores.28
Finalmente, a Boston Scientific, fabricante do dispositivo empregado na termoplastia brônquica, interrompeu recentemente a produção dos cateteres essenciais para o procedimento, gerando incerteza sobre a viabilidade futura dessa técnica.29
A termoplastia brônquica não foi estudada em indivíduos com menos de 18 anos.30
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
Referências
01.Johnson PRA, Roth M, Tamm M et al. Airway smooth muscle cell proliferation is increased in asthma. Am J Respir Crit Care Med 2001; 164:474-7.
02.Ebina M, Takahashi T, Chiba T, Motomiya M. Cellular hypertrophy and hyperplasia of airway smooth muscle underlying bronchial asthma. Am Rev Respir Dis 1993; 148:720-6.
03.James AL, Pare PD, Hogg JC. The mechanics of airway narrowing in asthma. Am Rev Respir Dis 1989; 139:242-6.
04.Lambert RK, Wiggs BR, Kuwano K, Hogg JC, Pare PD. Functional significance of increased airway smooth muscle in asthma and COPD. Appl Physiol J 1993; 74:2771-81.
05.Dunnill MS. The pathology of asthma with special reference to changes in the broncial mucosa. J Clin Path 1960; 13:27-33.
06.Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention uptdated 2021. Disponível em: https://ginasthma.org/wp-content/uploads/2021/05/GINA-Main-Report-2021-V2-WMS.pdf . Acesso em: 28 de maio de 2021.
07.Global Initiative for Asthma. Difficult-To-Treat & Severe Asthma in adolescent and adult patients. Diagnosis and Management. Disponível em : https://ginasthma.org/wp-content/uploads/2019/04/GINA-Severe-asthma-Pocket-Guide-v2.0-wms-1.pdf . Acesso em: 10 de outubro de 2019.
08.Chernyavsky IL, Russell RJ, Saunders RM, Morris GE, Berair R, Singapuri A, Chachi L, Mansur AH, Howarth PH, Dennison P, Chaudhuri R, Bicknell S, Rose FRAJ, Siddiqui S, Brook BS, Brightling CE. In vitro, in silico and in vivo study challenges the impact of bronchial thermoplasty on acute airway smooth muscle mass loss. Eur Respir J 2018; 51(5):1701680.
09.Sun Q, Fang L, Roth M, Tang X, Papakonstantinou E, Zhai W, Louis R, Heinen V, Schleich FN, Lu S, Savic S, Tamm M, Stolz D. Bronchial thermoplasty decreases airway remodelling by blocking epithelium-derived heat shock protein-60 secretion and protein arginine methyltransferase-1 in fibroblasts. Eur Respir J 2019; 54(6):1900300. doi: 10.1183/13993003.00300-2019. Erratum in: Eur Respir J 2021; 58(1): PMID: 31467116.
10.Haj Salem I, Gras D, Joubert P, Boulet LP, Lampron N, Martel S, Godbout K, Chanez P, Laviolette M, Chakir J. Persistent Reduction of Mucin Production after Bronchial Thermoplasty in Severe Asthma. Am J Respir Crit Care Med 2019; 199:536-538.
11.Pretolani M, Bergqvist A, Thabut G, Dombret MC, Knapp D, Hamidi F, Alavoine L, Taillé C, Chanez P, Erjefält JS, Aubier M. Effectiveness of bronchial thermoplasty in patients with severe refractory asthma: Clinical and histopathologic correlations. J Allergy Clin Immunol 2017; 139:1176-1185.
12.Ichikawa T, Panariti A, Audusseau S, Mogas AK, Olivenstein R, Chakir J, Laviolette M, Allakhverdi Z, Al Heialy S, Martin JG, Hamid Q. Effect of bronchial thermoplasty on structural changes and inflammatory mediators in the airways of subjects with severe asthma. Respir Med 2019; 150:165-172.
13.Facciolongo N, Di Stefano A, Pietrini V, Galeone C, Bellanova F, Menzella F, Scichilone N, Piro R, Bajocchi GL, Balbi B, Agostini L, Salsi PP, Formisano D, Lusuardi M. Nerve ablation after bronchial thermoplasty and sustained improvement in severe asthma. BMC Pulm Med 2018; 18:29.
14.Denner DR, Doeing DC, Hogarth DK, Dugan K, Naureckas ET, White SR. Airway inflammation after bronchial thermoplasty for severe asthma. Annals Am Thor Soc 2015; 12:1302–1309.
15.Papakonstantinou E, Koletsa T, Zhou L, et al. Bronchial thermoplasty in asthma: an exploratory histopathological evaluation in distinct asthma endotypes/phenotypes. Respir Res 2021; 22:186. https://doi.org/10.1186/s12931-021-01774-0
16.Mayse M, Laviolette M, Rubin A, Lampron N, Simoff M, Duhamel D, Musani A, Yung R, Mehta A. Clinical pearls for bronchial thermoplasty. J Bronchol Interventional Pulmonol 2007; 14:115–123.
17.Bicknell S, Chaudhuri R, Thomson NC. How to: Bronchial thermoplasty in asthma. Breathe 2014; 10:48-59.
18.Laxmanan B, Hogarth DK. Bronchial thermoplasty in asthma: current perspectives. J Asthma Allergy 2015; 8:39-49.
19.Castro M, Rubin AS, Laviolette M, Fiterman J, De Andrade Lima M, Shah PL, Fiss E, Olivenstein R, Thomson NC, Niven RM, Pavord ID, Simoff M, Duhamel DR, McEvoy C, Barbers R, Ten Hacken NH, Wechsler ME, Holmes M, Phillips MJ, Erzurum S, Lunn W, Israel E, Jarjour N, Kraft M, Shargill NS, Quiring J, Berry SM, Cox G;
AIR2 Trial Study Group. Effectiveness and safety of bronchial thermoplasty in the treatment of severe asthma: a multicenter, randomized, double-blind, sham-controlled clinical trial. Am J Respir Crit Care Med 2010; 181:116-124.
20.Facciolongo N, Menzella F, Lusuardi M, Piro R, Galeone C, Castagnetti C, Cavazza A, Carbonelli C, Zucchi L, Salsi PP.
Recurrent lung atelectasis from fibrin plugs as a very early complication of bronchial thermoplasty: a case report. Multidiscip Respir Med 2015. 10 (1):9.
21.Balu A, Ryan D, Niven R. Lung abscess as a complication of bronchial thermoplasty. J Asthma 2015; 52:740-2.
22.Wechsler ME, Laviolette M, Rubin AS, Fiterman J, Lapa e Silva JR, Shah PL, Fiss E, Olivenstein R, Thomson NC, Niven RM, Pavord ID, Simoff M, Hales JB, McEvoy C, Slebos DJ, Holmes M, Phillips MJ, Erzurum SC, Hanania NA, Sumino K, Kraft M, Cox G, Sterman DH, Hogarth K, Kline JN, Mansur AH, Louie BE, Leeds WM, Barbers RG, Austin JH, Shargill NS, Quiring J, Armstrong B, Castro M;
Asthma Intervention Research 2 Trial Study Group. Bronchial thermoplasty: long-term safety and effectiveness in patients with severe persistent asthma. J Allergy Clin Immunol 2013; 132:1295-1302.
23.Chupp G, Laviolette M, Cohn L, et al;Other members of the PAS2 Study Group. Long-term outcomes of bronchial thermoplasty in subjects with severe asthma: a comparison of 3-year follow-up results from two prospective multicentre studies. Eur Respir J 2017;50(2):1700017.
24.Chupp G, Kline JN, Khatri SB, McEvoy C, Silvestri GA, Shifren A, Castro M, Bansal S, McClelland M, Dransfield M, Trevor J, Kahlstrom N, Simoff M, Wahidi MM, Lamb CR, Ferguson JS, Haas A, Hogarth DK, Tejedor R, Toth J, Hey J, Majid A, LaCamera P, Fitzgerald JM, Enfield K, Grubb GM, McMullen EA, Olson JL, Laviolette M. Bronchial Thermoplasty in Patients With Severe Asthma at 5 Years: The Post-FDA Approval Clinical Trial Evaluating Bronchial Thermoplasty in Severe Persistent Asthma Study. Chest 2022; 161:614-628.
25.Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43:343-373. [Published erratum appears in Eur Respir J 43:1216; Published erratum appears in Eur Respir J 52:1352020.]
26.Hall CS, Quirk JD, Goss CW, Lew D, Kozlowski J, Thomen RP, Woods JC, Tustison NJ, Mugler JP, 3rd, Gallagher L, Koch T, Schechtman KB, Ruset IC, Hersman FW, Castro M. Single-Session Bronchial Thermoplasty Guided by (129)Xe Magnetic Resonance Imaging. A Pilot Randomized Controlled Clinical Trial. Am J Respir Crit Care Med 2020; 202:524-34.
27.Chung KF.
New treatments for severe treatment-resistant asthma: targeting the right patient. Lancet Respir Med 2020; 8:P639-652.
DOI: https://doi.org/10.1016/S2213-2600(13)70128-0
28.Fong KY, Zhao JJ, Syn NL, Nair P, Chan YH, Lee P. Comparing bronchial thermoplasty with biologicals for severe asthma: Systematic review and network meta-analysis. Respir Med 2023; 216:107302.
29.Samant M, Krings JG, Lew D, Goss CW, Koch T, McGregor MC, Boomer J, Hall CS, Schechtman KB, Sheshadri A, Peterson S, Erzurum S, DePew Z, Morrow LE, Hogarth DK, Tejedor R, Trevor J, Wechsler ME, Sam A, Shi X, Choi J, Castro M. Use of Quantitative CT Imaging to Identify Bronchial Thermoplasty Responders. Chest 2024; 165:775-784.
30.Cloutier MM, Baptist AP, Teach SJ, Umscheid CJ, Walsh CG, et al. 2020 Focused Updates to the Asthma Management Guidelines: A Report from the National Asthma Education and Prevention Program Coordinating Committee Expert Panel Working Group. JACI 2020;146:1217-1270. DOI:https://doi.org/10.1016/j.jaci.2020.10.003.
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|