|
Asma
Tratamento da Asma
BIOLÓGICOS NA ASMA
Aproximadamente 3–10% dos pacientes têm asma severa.1,2 A asma grave é caracterizada pela dificuldade de controle da doença,
apesar da estratégia de manejo aplicada com altas doses de CI-LABA e atenção aos fatores desencadeantes.
A inflamação Tipo 2-alta, mediada por citocinas, como IL-4, IL-5 e IL-13, ocorre em aproximadamente 50% dos pacientes com asma leve a moderada3 e em aproximadamente 70% de adultos com asma grave.4
O corticoide oral (CO) está indicado em baixa dose na Etapa 5 da GINA como droga adjuvante na asma com sintomas persistentes ou exacerbações apesar da técnica correta de uso do inalador e boa aderência ao tratamento.5 Evidências sugerem que um aumento na morbidade e mortalidade esteja associado à exposição cumulativa ao CO ao longo da vida o que significa que mesmo cursos curtos repetidos podem ter um impacto significativo.6,7 Mesmo exposições cumulativas tão baixas quanto 0,5-1 g de equivalente da prednisolona foram relatadas como associadas a resultados adversos.8
Estudo de Eger et al.9 demonstrou que na Holanda 47% dos usuários de COs não aderiram ao tratamento com corticoide inalatório, o que está de acordo com avaliações anteriores, que evidenciavam taxas semelhantes decepcionantes, variando de 42,5 a 65%.10-12 Na Alemanha um estudo em pacientes com asma tratados com altas doses de CI/LABA mostrou que cerca de 22% necessitaram de ≥1 prescrição de COs em 1 ano.13 Na atualidade o uso do CO por longo tempo não é apropriado em situações nas quais outras opções de tratamento, como os biológicos, se encontrem disponíveis.
Entretanto, os médicos não devem prescrever produtos biológicos até que tenham verificado minuciosamente se o tratamento com CI está sendo usado de "maneira adequada e apropriada".
Existem dois fenótipos específicos, Tipo 2 (T2) alto e baixo, que são importantes para identificar quando se introduzir o tratamento com biológicos.
A asma T2 alto inclui dois endótipos principais: asma eosinofílica alérgica e asma eosinofílica não alérgica, cujos pacientes apresentam exacerbações graves frequentes, comorbidades como rinossinusite crônica com pólipos nasais e necessidade de altas doses de corticoides para controle.
Esses fenótipos são definidos com base no nível de expressão de citocinas, como IL-4, IL-5 e IL-13, que podem ser secretadas pelas células T helper clássicas do tipo 2 (Th2), bem como por linfócitos CD4 ou células imunes não clássicas, como as células linfoides inatas – tipo 2 (ILC-2), daí a mudança na terminologia de Th2 para T2.
A inflamação alta Tipo 2 (T2-alta) é caracterizada por inflamação eosinofílica nas vias aéreas e elevações no sangue de eosinófilos ou elevações da Fração exalada do Óxido Nítrico (FeNO) (Tabela 1). A asma de inflamação baixa Tipo 2 (T2-baixa) engloba a asma neutrofílica, a paucigranulocítica e asma granulocítica mista — que seria a concomitância de inflamação neutrofílica e eosinofílica das vias aéreas.
No curso da doença deve-se avaliar o fenótipo de asma grave durante o tratamento com altas doses de corticoide inalatório (CI) para saber se o paciente tem inflamação Tipo 2-alta nas vias aéreas:14
Tabela 1 – Caracterísicas da Inflamação Tipo 2-alta
Características da Inflamação Tipo 2-alta
|
● |
Eosinófilos no sangue ≥ 150 µl e/ou; |
● |
FeNO ≥ 20 ppb e/ou; |
● |
Eosinófilos no escarro ≥ 2% e/ou; |
● |
Asma é clinicamente causada por alérgenos e/ou; |
● |
Pólipos nasais e/ou; |
● |
Necessidade de corticoide oral para manutenção. |
| (repita eosinófilos no sangue e FeNO até 3 x na dose mais baixa possível de COs) |
|
Além do tratamento anti-IgE que melhorou os desfechos em asma alérgica por duas décadas, quatro biológicos anti-IL-5 (mepolizumabe, reslizumabe e depemoquimabe) e o benralizumabe, tendo como alvo o receptor IL-5R-α (Figura1), o dupilumabe
bloqueando a sinalização da IL-4 e da IL-13, e o
tezepelumabe (anti-TSLP) atuando mesmo em paciente com marcadores T2 mais baixos,
surgiram como tratamentos da inflamação crônica das vias aéreas (Tabela 2). Estão indicados para os pacientes que já estão em uso de altas doses do CI-LABA, com mau controle dos sintomas, histórico de exacerbações, com biomarcadores alérgicos eosinofílicos ou com relato de necessitar de CO para controle. Quando da indicação desta forma de tratamento levar em consideração o custo, frequência de dosagem, a via (SC ou IV) e a preferência do paciente.
O uso de biológicos na asma grave determina reduções de dose clinicamente relevantes ou da descontinuação do tratamento com CO, diminui substancialmente a frequência de exacerbações, bem como as taxas de atendimento hospitalar.15,16
Atualmente existe uma proposta para se introduzir os medicamentos biológicos mais precocemente no tratamento da asma, a fim de se evitar os danos irreversíveis do remodelamento das vias aéreas. A necessidade dessa mudança surge em função de:
● |
Os estudos clínicos atuais não incluírem pacientes reais com sintomas diários, mas com função respiratória ainda normal.17 |
| |
|
● |
Novas evidências mostrarem que pacientes com inflamação tipo 2 alta (avaliada através de eosinófilos ≥ 150/µL ou FeNO > 25 ppb) apresentam risco de piora da função respiratória, mesmo sem sofrer exacerbações frequentes.18,19 |
Assim, defende-se que o tratamento biológico precoce seja considerado para um novo perfil: pacientes com asma leve a moderada, sintomas diários e inflamação persistente, independentemente de terem exacerbações ou função pulmonar comprometida.20
Anticorpos Monoclonais que Têm como Alvo anti-IL-5/IL-5Rα
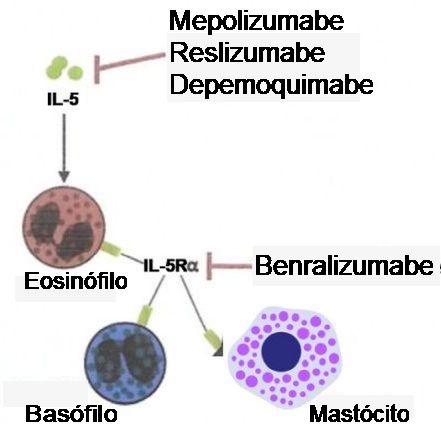
Figura 1 – Locais de atuação dos biológicos anti-IL-5 e anti-IL-5Rα
Mepolizumabe
Mepolizumabe é um anticorpo monoclonal IgG1k murino humanizado. Atua seletivamente contra a cadeia α da IL-5, impede sua ligação ao receptor
α de IL-5 (IL-5Rα), que é expresso na superfície de eosinófilos e basófilos. Como consequência, a diferenciação, ativação e crescimento de eosinófilos são inativados.
Haldar et al.21 analisando uma amostra de 61 indivíduos com asma eosinofílica grave recorrente, durante 50 semanas, em um estudo
randomizado duplo-cego, placebo controlado, obtiveram redução no número das exacerbações com a droga.
Cerca de trinta e um por cento dos indivíduos do grupo mepolizumabe não tiveram exacerbações durante o estudo, em comparação com 16% do placebo; sendo que houve três internações hospitalares por exacerbações de asma no grupo tratado em comparação com 11 internações no grupo placebo.
O número total de dias de hospitalização foi significativamente menor para aqueles tratados com o biológico do que aqueles que receberam placebo (12 dias x 48 dias – p < 0,001).
O mepolizumabe reduziu significativamente a contagem de eosinófilos no sangue (p <0,001) e no escarro (p = 0,002).
Não houve diferenças significativas entre os grupos em relação aos sintomas, VEF1 após uso de broncodilatador ou hiper-responsividade das vias aéreas.
Outro estudo o SIRIUS (Steroid Reduction with Mepolizumab Study)22 quantificou as vantagens do mepolizumabe em pacientes com asma eosinofílica. No desfecho primário pré-especificado, mais pacientes no grupo mepolizumabe do que no grupo placebo tiveram uma redução de 90 a 100% na dose de corticoide oral (23% v. 11%) e uma redução de 70 a menos de 90% (17% v. 8%).
O estudo MENSA (Mepolizumab as Adjunctive Therapy in Patients with Severe Asthma)23 fez comparações entre a taxa de exacerbações em pacientes com exacerbações recorrentes de asma e evidências de inflamação eosinofílica, apesar de estarem em uso de altas doses de corticoides por inalação.
Nestes pacientes foram testadas as vias venosa e subcutânea de mepolizumabe comparadas ao placebo.
Quando comparada ao placebo, a taxa de exacerbações de doentes tratados com mepolizumabe IV foi reduzida em 47% e 53% para mepolizumabe SC (p<0,001 para ambos), e exacerbações que exigiram visitas a emergências ou hospitalização diminuíram em 32% para IV e 61% para mepolizumabe SC.
Houve concomitante melhora nos parâmetros que analisam a qualidade de vida (questionários St. George, ...ACQ-5 ).
Magnan et al.24 em revisão Cochrane demonstraram que pacientes com asma que receberam mepolizumabe tiveram uma elevação no VEF1 de 110 ml e redução nas exacerbações da doença em cerca de 50%. Ocorreu após uso do fármaco melhora clínica e significativa da qualidade de vida, avaliadas através do questionário de St. George.
A dose recomendada de mepolizumabe (Nucala®) para ≥ 12 anos é de 100 mg  administrada uma vez a cada 4 semanas por via SC através de injeção no braço, coxa ou abdome. Admite-se o tratamento para crianças acima de ≥ 6 anos na dose de 40 mg por via SC uma vez a cada quatro semanas. É necessário observar a evolução por um prazo de 4 meses e o tratamento com mepolizumabe deve ser continuado indefinidamente se for obtida uma resposta clínica.
Deve ser destacado que os dados de eficácia do mepolizumabe em crianças menores de 6 anos ainda são limitados. administrada uma vez a cada 4 semanas por via SC através de injeção no braço, coxa ou abdome. Admite-se o tratamento para crianças acima de ≥ 6 anos na dose de 40 mg por via SC uma vez a cada quatro semanas. É necessário observar a evolução por um prazo de 4 meses e o tratamento com mepolizumabe deve ser continuado indefinidamente se for obtida uma resposta clínica.
Deve ser destacado que os dados de eficácia do mepolizumabe em crianças menores de 6 anos ainda são limitados.
A vacinação contra herpes-zóster (preferencialmente recombinante, não com vírus vivos) precisa ser administrada 4 semanas antes do início do medicamento naqueles com ≥ 50 anos de idade.
Reslizumabe
O reslizumabe é um anticorpo anti-IL-5 monoclonal humanizado (IgG4 kappa) indicado como terapêutica complementar de manutenção para o tratamento de pacientes com asma severa a partir de 18 anos de idade, com fenótipo eosinofílico.
Castro et al.27 avaliaram a eficácia e a segurança do reslizumabe em pacientes com asma de moderada a grave inadequadamente controlada, que estavam em altas doses de corticoides por inalação. O protocolo durou 15 semanas. Foram dois ensaios de fase 3 duplicados, multicêntricos, duplo-cegos, de grupos paralelos, randomizados e controlados por placebo. Ambos os estudos incluíram pacientes com asma de 12 a 75 anos (de 128 centros de pesquisa clínica no estudo 1 e 104 centros no estudo 2 da Ásia, Austrália, América do Norte, América do Sul, África do Sul e Europa, cuja asma foi inadequadamente controlada por doses médias a altas de tratamento à base de corticoides inalatórios e que tiveram eosinófilos no sangue de ≥ 400 células por µL e uma ou mais exacerbações no ano anterior. Os pacientes foram aleatoriamente designados (1:1) para receber reslizumabe intravenoso (3,0 mg / kg) ou placebo a cada 4 semanas durante 1 ano por randomização central computadorizada. Em ambos os estudos, os doentes que receberam reslizumabe tiveram uma redução significativa na frequência de exacerbações da asma (estudo 1: taxa de frequência [RR] 0,50 [IC95% 0,37-0,67]; estudo 2: 0,41 [0,28-0,59], ambos p <0,0001) em comparação com aqueles que receberam placebo. Eventos adversos comuns no reslizumabe foram semelhantes ao placebo.
A dose preconizada de reslizumabe (Cinqair®) para ≥ 18 anos é de 3 mg/kg por infusão endovenosa lenta de 20–50 minutos, a cada quatro semanas. O reslizumabe destina-se apenas à perfusão intravenosa e não pode ser administrado por injeção em bolus ou IV. A infusão deve ser preparada por um profissional de saúde, utilizando técnica asséptica e administrada em um serviço de saúde por um profissional capaz de gerenciar possível anafilaxia.
Benralizumabe
Benralizumabe, outro anticorpo monoclonal humanizado (classe kappa de IgG1) antieosinófilo que se liga à cadeia alfa da IL-5 do receptor IL-5, prevenindo a transdução de sinal e que depleta os eosinófilos via antibody dependent cell-mediated cytotoxicity (ADCC); o processo pelo qual as células natural killer são ativadas para atingir os eosinófilos. Benralizumabe induz à depleção direta, rápida e quase completa de eosinófilos na medula óssea, no sangue e no tecido alvo. A afucosilação do benralizumabe mAb aumenta sua capacidade de se envolver com FcyRIIIa em células natural killer, causando agregação ao redor do eosinófilo e resultando em citotoxicidade mediada por células dirigidas por anticorpos e apoptose de eosinófilos, seguida de fagocitose por macrófagos.28 Este mecanismo resulta em depleção quase completa de eosinófilos.
Os estudos – SIROCCO de 48 semanas, CALIMA de 56 semanas e ZONDA de 28 semanas – testaram o efeito do benralizumabe, na dose de 30 mg administrada a cada 4 semanas ou 8 semanas, combinado com corticoides inalatórios em alta dose associados a ß2-agonistas de longa ação.
No SIROCCO (n = 1.205), o benralizumabe reduziu a frequência de exacerbação na população com eosinófilos elevados em comparação com o placebo (RR, 0,55 a cada 4 semanas; RR, 0,49 a cada 8 semanas; p<0,0001 para ambas as comparações).29 No CALIMA (n = 1.306), essas comparações também favoreceram o benralizumabe (RR, 0,64 a cada 4 semanas; RR, 0,72 a cada 8 semanas); ambas as comparações foram significativas ( p = 0,0018 a cada 4 semanas; p = 0,0188 a cada 8 semanas).30 No estudo ZONDA, o benralizumabe reduziu o uso oral de corticoide em 75%, em comparação ao placebo e em 25% ao basal.31
Outro estudo, o BORA, indica que o benralizumabe quando administrado por dois anos, manteve as melhoras nas medidas de eficácia obtidas nos estudos clínicos randomizados controlados anteriores (SIROCCO e CALIMA) em pacientes com asma severa e não controlada com fenótipo eosinofílico.32
Os pacientes tratados com benralizumabe tinham mais de quatro vezes a probabilidade de reduzir a dose de corticoide oral do que aqueles em placebo. Em pacientes com asma grave e mal controlada, o benralizumabe, também reduziu as taxas globais de exacerbação em 70% e as visitas à emergência ou hospitalizações em 93%.30,33 O benralizumabe raramente causa reações de hipersensibilidade.
No estudo PONENTE envolvendo 598 pacientes dependentes de COs tratados com benralizumabe, foi observado que mais de 80% conseguiram interromper o seu uso ou conseguiram reduzir a dose para 5 mg ou menos.34 Até o momento, o PONENTE destaca-se como o maior estudo poupador de CO desse gênero.
A dose preconizada de benralizumabe (Fasenra®) é de 30 mg por via subcutânea em seringa preenchida, a cada quatro semanas
durante as três primeiras doses, como fase de indução (para reduzir a eosinofilia tecidual) após cada 8 semanas, para manutenção. Um teste de 4 meses deve ser dado para avaliar a resposta.35
Recentemente o benralizumabe teve aprovação para uso em pacientes com idades entre 6 e 11 anos. Uma nova apresentação de 10 mg já está disponível para crianças de 6 a 11 anos com peso inferior a 35 kg. Para aquelas com 6 anos ou mais e peso igual ou superior a 35 kg, recomenda-se a dose originalmente aprovada de 30 mg. O tratamento é administrado por via subcutânea em intervalos de 4 semanas, nas três primeiras doses e, a partir de então a cada 8 semanas. Os preditores que prognosticam boa resposta ao tratamento com biológicos anti-IL-5 e anti-IL-5Rα estão citados na Tabela 3 .
Os efeitos colaterais não são comuns às três drogas e podem incluir cefaleia, prurido, congestão nasal, reações no local da injeção, mialgia, faringite, dor lombar, fadiga, náusea e elevação da enzima creatinoquinase (CK), ITU. Infecções por herpes-zóster são relatadas em pacientes em uso de mepolizumabe. Podem também causar reações graves de hipersensibilidade, incluindo anafilaxia, e por isso estas drogas devem ser administradas em um ambiente onde os doentes possam ser observados durante um período de tempo após a aplicação por pessoal habilitado.
Tabela 3 – Precedentes que Prognosticam Boa Resposta ao anti-IL-5 ou anti-IL5R
∎ Elevada contagem de eosinófilos no sangue36
∎ Alto número de exacerbações graves de asma no ano anterior36
∎ Início da asma na idade adulta37
∎ Uso regular de corticoide oral38
∎ Polipose nasal38
∎ Prova de função respiratória alterada (VEF1 < 65% do teórico em uma avaliação)39
Anticorpo Monoclonal que Tem como Alvo anti-IL-4/IL-13
Dupilumabe
O dupilumabe é um mAB humanizado (IgG4) contra o receptor de IL-4 atuando em uma subunidade alfa que inibe a sinalização de IL-4 e IL-1340 (Figura 2). Avaliações do dupilumabe com 200 mg por 2 semanas ou 4 semanas ou 300 mg por 2 ou 4 semanas comparados ao placebo evidenciaram melhora de cerca de 18% no VEF1 para o grupo que recebeu o dupilumabe contra 6% do grupo placebo (p<0,001). Dupilumabe é eficaz melhorando os sintomas e sua eficácia parece ser independente da contagem dos eosinófilos em pacientes com asma moderada a grave. Dupilumabe reduziu a taxa anualizada ajustada de exacerbações severas.41 Rabe Klaus et al.42 constataram em pacientes com asma grave dependente de corticoides, que o tratamento com dupilumabe reduziu o uso de corticoides por via oral, diminuindo a taxa de exacerbações graves com aumento do VEF1. Eosinofilia transitória foi observada em aproximadamente 1 em cada 7 pacientes.42
Mario Castro et al.43 no estudo Liberty Asthma Quest (n = 1.902) compararam o dupilumabe em uma população com intenção de tratar durante um período de intervenção de 52 semanas. A taxa anualizada ajustada de exacerbações graves de asma foi de 0,46 (IC de 95%, 0,39 a 0,53) entre os pacientes que receberam 200 mg de dupilumabe a cada 2 semanas versus 0,87 (IC de 95%, 0,72 a 1,05) entre aqueles do grupo placebo (taxa 47,7% menor com dupilumabe do que com placebo, p<0,001). O benefício do dupilumabe em relação ao VEF1 foi maior entre os pacientes com uma contagem de eosinófilos no sangue de ≥ 300 por mm3 no início do estudo. A variação na 12ª semana foi de 0,43 l com a dose mais baixa de dupilumabe versus 0,21 l com placebo (diferença, 0,21 l; IC de 95%, 0,13 a 0,29) e 0,47 l com a dose mais alta de dupilumabe versus 0,22 l com o placebo (diferença, 0,24 l; IC 95%, 0,16 a 0,32; P<0,001). Maiores benefícios foram observados em pacientes com níveis basais mais altos de eosinófilos e FeNO.

Figura 2 – A figura evidencia os efeitos biológicos proeminentes das Interleucinas 4 e 13 exercidos através de sua ligação aos seus receptores IL-4R e IL-13Rα. O dupilumabe é um anticorpo monoclonal que inibe a sinalização da IL-4 e IL-13. Se liga ao receptor compartilhado para ambas as citocinas, impedindo que essas proteínas se conectem aos seus receptores nas células.
Em pacientes com asma dependente de CO, o dupilumabe restringiu significativamente o seu uso em cerca de 70%, sendo que quase metade dos pacientes foi capaz de descontinuar a droga. Em paralelo ocorreram reduções nas exacerbações em 60% e melhora na função pulmonar.44
Teoricamente, o bloqueio de IL-4 / IL-13 também reduzirá a formação de IgE pois, IL-4 e IL-13 são citocinas-chave que promovem a produção de IgE; afetará a secreção de muco das vias aéreas decorrente da hiperplasia de células caliciformes e as mudanças estruturais do remodelamento brônquico. O dupilumabe pode ser uma opção para pacientes com severa asma eosinofílica, especialmente aqueles com comorbidades concomitantes, tais como a rinossinusite crônica, dermatite atópica ou polipose nasal.
Segundo recomendação da ERS/ATS, o anti-IL-4/13 também é indicado para indivíduos asmáticos graves dependentes de corticoides sistêmicos, independentemente do status eosinofílico.45 Entre as crianças com asma moderada a grave não controlada, aquelas que receberam dupilumabe complementar (add-on) tiveram menos exacerbações de asma e melhora na função respiratória e controle da asma do que aquelas que receberam placebo.46
As doses recomendadas de Dupilumabe (Dupixent®): Para crianças de 6-11 anos com ≥ 30 kg a dose recomenada é de 200 mg a cada 2 semanas. Adultos e adolescentes ≥ 12 anos com asma eosinofílica T2: em pacientes com asma grave e que estão fazendo uso de corticoide oral ou pacientes que possuem asma grave e dermatite atópica de moderada a grave simultaneamente, é recomendada uma dose inicial de 600 mg (duas
seringas preenchidas de 300 mg), seguida de uma dose de 300 mg administrada a cada duas semanas sob a forma de injeção subcutânea.
Efeitos adversos mais relatados: reação no local da injeção (infecção), dor orofaríngea e herpes oral, conjuntivite alérgica, prurido ocular, blefarite, cefaleia. Reações anafiláticas podem ocorrer.
Anticorpo Monoclonal que Tem como Alvo anti-TSLP
Tezepelumabe
É um anticorpo que tem como alvo a TSLP (thymic stromal lymphopoietin), uma citocina superexpressa nas vias aéreas de asmáticos graves, derivada do epitélio, que afeta diversos tipos de células imunes nas respostas inflamatórias Tipo 2. Em paciente com asma os níveis de TSLP estão correlacionados com a resistência das vias aéreas, gravidade da doença e resistência aos corticoides.47,48 Pacientes que receberam tezepelumabe, um anticorpo monoclonal que bloqueia a TSLP, apresentaram taxas mais baixas de exacerbações de asma do que aqueles que receberam placebo, independentemente da contagem basal de eosinófilos no sangue (estudo PATHWAY).49 Menzies-Gow et al. em um ensaio clínico de fase 3 mais amplo (NAVIGATOR) em pacientes adultos e adolescentes com asma grave malcontrolada, durante 52 semanas duplo cego, randomizado, controlado, recebendo 210 mg de tezepelumabe, ou placebo por via SC a cada quatro semanas, obtiveram melhor performance na função pulmonar, na qualidade de vida e desfecho de menos exacerbações — redução da taxa anual em 56% — com taxa anual de 0,93 (IC de 95%, 0,80 a 1,07) e 2,10 (IC de 95%, de 1,84 a 2,39) com placebo (razão da taxa 0,44; IC 95%, 0,37 a 0,53; p<0,001).50
O tezepelumabe se constituiu no primeiro biológico a mostrar eficácia em uma população mais ampla de pacientes, embora modesta, com asma Tipo 2-baixa grave.51 Corren et al. em análise agrupada post hoc dos estudos PATHWAY e NAVIGATOR demonstraram que o tezepelumabe reduz as exacerbações em adultos com asma grave não controlada, incluindo o subgrupo tipo 2-baixa.52
A posologia recomendada de tezepelumabe
(Tezspire®)
para adultos e crianças ≥ 12 anos é de 210 mg administrados por via subcutânea uma vez a cada 4 semanas. Reações de hipersensibilidade como rash cutâneo e conjuntivite alérgica podem ocorrer após a administração da droga ou mais tardiamente, bem como faringite, artralgias. As reações adversas descritas no local da injeção foram o eritema e o edema.
Outras opções terapêuticas emergentes estão em fase de desenvolvimento clínico e estão sendo avaliadas. Os que bloqueiam a via da IL-13 como lebriquizumabe e o traloquinumabe apresentaram resultados pouco consistentes, sem respostas significativas na função pulmonar (VEF1) em pacientes com asma leve a moderada ou que denotem redução expressiva das exacerbações da asma.51,54-56
Anticorpo Monoclonal que Tem como Alvo anti-IL-5 (de Longa Ação)
Exdensur
O depemoquimabe é o primeiro anticorpo monoclonal com alta afinidade de ligação pela IL-5, possibilitando meia-vida prolongada com potencial inibitório mais sustentado sobre a inflamação. Dois estudos – SWIFT-1 e 2 – quando 382 e 380 adultos e adolescentes com asma grave foram randomizados para receber depemoquimabe ou placebo, respectivamente ao tratamento padrão.com CI em doses médias/altas, obtiveram resultados positivos em pacientes com asma eosinofílica grave não controlada, com redução da taxa de exacerbações no período.57 O depemoquimabe poderá ser uma opção de inibição sustentada desta via, com esquema de doses de apenas duas injeções por ano. A posologia recomendada de depemoquimabe para adultos e adolescentes ≥ 12 anos é de 100 mg administrados em solução injetável em seringa pré-preenchida por via subcutânea via subcutânea com administração duas vezes ao ano..
PERSPECTIVAS FUTURAS
Bloquear a IL-33 pode resultar na melhora dos sintomas e na prevenção de exacerbações, ao conter a inflamação persistente e impedir a remodelação das vias aéreas. Anticorpos anti-IL-33 humanos encontram-se em fase de avaliação como o astegolimabe e o itepequimabe.58
O astegolimabe é um anticorpo monoclonal IgG2 humano que inibe seletivamente o receptor IL-33/ST2. O astegolimabe reduziu as exacerbações da asma em uma ampla população de pacientes, incluindo aqueles com baixo nível de eosinófilos, com asma grave e mal controlada. Astegolimabe foi seguro e bem tolerado.58,59
O itepequimabe é um anticorpo monoclonal IgG4 anti-IL-33 humano. Uma observação de fase 2 comparou a segurança e a eficácia de itepequimabe em um estudo randomizado com 296 pacientes em 12 semanas, que constou de (300 mg SC a cada duas semanas), dupilumabe (300 mg SC a cada duas semanas), itepequimabe + dupilumabe ou placebo em pacientes com asma moderada a grave.58,60 O desfecho primário foi um evento indicativo de perda do controle da asma, avaliado no grupo itepequimabe e no grupo combinado, em comparação com o grupo placebo. Um evento indicando perda do controle da asma ocorreu em 22% do grupo itepequimabe, 27% do grupo combinação, 19% do grupo dupilumabe, em comparação com 41% do grupo placebo. O bloqueio da IL-33 com itepequimabe apresentou poucos eventos adversos e possibilitou melhora na função respiratória em pacientes com asma moderada a grave.60
O tozoracimabe (MEDI3506) um potente anticorpo monoclonal humano anti-IL-33 demonstrou eficácia na inibição das respostas inflamatórias dependentes de ST2, que são impulsionadas pela IL-33, tanto em células humanas primárias quanto em um modelo murino de lesão epitelial pulmonar. Além disso, este agente terapêutico foi capaz de prevenir a oxidação da IL-33 e sua atividade, atuando através da via de sinalização RAGE/EGFR. Este duplo mecanismo de ação do tozoracimabe resultou no aumento da migração e reparação de células epiteliais in vitro.61,62 Atualmente está em curso um estudo de fase 2a sobre o tozoracimabe (MEDI3506) para o tratamento da asma moderada a grave. Ao contrário da abordagem terapêutica anti-TSLP, a eficácia dos anticorpos anti-IL-33/ST2 parece ser mais pronunciada em pacientes com contagens basais de eosinófilos sanguíneos mais baixas, embora não esteja restrita a eles, em comparação com pacientes com contagens elevadas de eosinófilos sanguíneos.
A prostaglandina D2 (PGD2) é um mediador lipídico, liberado predominantemente por mastócitos, mas também por outras células como os linfócitos Th2, células ILC2 e as células dendríticas, que desempenham um papel significativo na fisiopatologia da asma. A PGD 2 exerce suas funções biológicas principalmente por meio de dois receptores acoplados à proteína G, o receptor 1 (DP1) e 2 (DP2) da PGD2.55 O DP2 também conhecido como CRTh2 (chemoattractant receptor–homologous molecule expressed on Th2 cells) é expresso por células ILC2, linfócitos Th2, mastócitos e eosinófilos.63 O Fevipipranto é um antagonista do receptor de prostaglandina D2 (CRTh2) administrado por via oral (150 mg uma vez ao dia ou 75 mg duas vezes ao dia) que alcançou resultados promissores em dois estudos de fase II. Em um estudo realizado em pacientes com asma eosinofílica de moderada a grave, na média, o percentual de eosinófilos no escarro diminuiu desde o início do ensaio até a semana 12 em 4,5 vezes no grupo de fevipipranto e em 1,3 vezes no grupo placebo (p = 0,0014). Fevipipranto evidenciou boa tolerabilidade.64 Fevipipranto produziu uma melhora estatisticamente significativa no desfecho primário de mudança no VEF1 pré-administração na semana 12 (p = 0,0035) com uma diferença média para o placebo de 0,112 L.65Embora nenhum dos estudos LUSTER-1 e LUSTER-2 tenha mostrado uma redução estatisticamente significativa nas exacerbações da asma após o ajuste para múltiplos testes, reduções consistentes e modestas nas taxas de exacerbações foram observadas em ambos os estudos somente com a dose de 450 mg de fevipipranto.66 Portanto, o fevipipranto provavelmente não será uma opção futura de tratamento.50
Tratamento com Biológicos — Duração
No tratamento da asma, a maioria dos biológicos foi introduzida recentemente e atualmente é reservada para pacientes com doença grave não controlada.5,67 O que se busca é a modificação da doença, controle sustentado e se possível a remissão.
Normalmente é administrado por 3 a 6 meses antes de avaliar a resposta. Em pacientes em que há resposta deve se continuar indefinidamente. Levar em consideração: adesão, controle da asma através do número de exacerbações, qualidade de vida, problemas de segurança, facilidade para obtenção do medicamento, redução na dose do CO etc. Aguardam-se dados de ensaios clínicos para determinar se a dose de CI pode ser reduzida ou retirada com segurança em pacientes bem controlados com terapia biológica.
Habitualmente, o tratamento com um biológico é eficaz no controle de sintomas em pacientes asmáticos, entretanto, em alguns casos mais complexos, a combinação de várias drogas pode ser necessária para se obter uma regulação mais extensa do padrão inflamatório.64-69
De acordo com a literatura atual em humanos e em modelos de camundongos, especificamente no que concerne à terapêutica que visa à depleção quase completa de eosinófilos, esta não demonstrou disfunção homeostática ou imunológica nos principais mecanismos de defesa do hospedeiro – sem efeitos prejudiciais à saúde.70
⮚ Pacientes que apresentam boa tolerância aos biológicos e resposta clínica favorável tendem a obter maior benefício ao manter o tratamento, em vez de reduzí-lo ou interrompê-lo. Contudo a eficácia terapêutica desses fármacos está diretamente relacionada à adesão sustentada ao longo do tempo.
São várias as possibilidades para que o paciente não responda ao tratamento com um biológico: 1) erro na avaliação inicial do fenótipo; 2) consequências de comorbidades concomitantes; 3) incapacidade do biológico em reverter integralmente o processo inflamatório das vias aéreas; 4) remodelamento irreversível das vias aéreas/obstrução fixa; 5) adesão inadequada ao tratamento e 6) desenvolvimento de anticorpos neutralizantes antidrogas (ADAs) (Tabela 4).71-75
Tabela 4 – Resposta Parcial ou Ausente aos Biológicos
Resposta Parcial ou Ausente aos Biológicos
|
● |
Não aderência ao tratamento |
● |
Comorbidades: rinossinusite, obesidade, DRGE |
● |
Remodelamento irreversível / obstrução fixa |
● |
Formação de anticorpos antidrogas (ADAs) |
● |
Diferenças individuais na farmacocinética |
BIOLÓGICOS NA GRAVIDEZ
Os dados atuais através de estudo Delphi internacional indicam que os biológicos podem ser utilizados desde a concepção e ao  longo de toda a gestação, podendo inclusive ser iniciados durante a gravidez conforme os mesmos critérios aplicados a pacientes não grávidas, e mantidos durante a amamentação. A recomendação é ainda mais relevante diante de efeitos adversos relacionados ao uso de corticoides ou de internações hospitalares/UTI por asma nos últimos 12 meses. Essas condutas devem sempre ser discutidas em um processo de decisão compartilhada, considerando as prioridades e preocupações individuais da paciente.76,77 longo de toda a gestação, podendo inclusive ser iniciados durante a gravidez conforme os mesmos critérios aplicados a pacientes não grávidas, e mantidos durante a amamentação. A recomendação é ainda mais relevante diante de efeitos adversos relacionados ao uso de corticoides ou de internações hospitalares/UTI por asma nos últimos 12 meses. Essas condutas devem sempre ser discutidas em um processo de decisão compartilhada, considerando as prioridades e preocupações individuais da paciente.76,77
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
Referências
01.Reddel HK, Bacharier LB, Bateman ED, Brightling CE, Brusselle GG, Buhl R, Cruz AA, Duijts L, Drazen JM, FitzGerald JM, Fleming LJ, Inoue H, Ko FW, Krishnan JA, Levy ML, Lin J, Mortimer K, Pitrez PM, Sheikh A, Yorgancioglu AA, Boulet LP. Global Initiative for Asthma Strategy 2021: Executive Summary and Rationale for Key Changes. Am J Respir Crit Care Med 2022 Jan 1;205(1):17-35.
02.Hekking PW, Wener RR, Amelink M, Zwinderman AH, Bouvy ML, Bel EH. The prevalence of severe refractory asthma.JACI 2015;135: 896–902.
03.Fahy JV . Type 2 inflammation in asthma — present in most, absent in many. Nat Rev Immunol 2015;15: 57-65.
04.Frøssing L, Silberbrandt A, Von Bülow A, Backer V, Porsbjerg C. The prevalence of subtypes of type 2 inflammation in an unselected population of patients with severe asthma. J Allergy Clin Immunol Pract 2021;9: 1267-75.
05.Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. 2024. Disponível em: https://www.ginasthma.org
06.Price DB, Trudo F, Voorham J, Xu X, Kerkhof M, Ling Zhi Jie J, et al. Adverse outcomes from initiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy 2018; 11:193–204.
07.Sullivan PW, Ghushchyan VH, Globe G, Schatz M. Oral corticosteroid exposure and adverse effects in asthmatic patients. J Allergy Clin Immunol 2018; 141:110–116,e7.
08.Bleecker ER, Menzies-Gow AN, Price DB, Bourdin A, Sweet S, Martin AL, et al. Systematic literature review of systemic corticosteroid use for asthma management. Am J Respir Crit Care Med 2020; 201 :276–93.
09.Eger K, Amelink M, Hashimoto S, Hekking PP, Longo C, Bel EH. Overuse of Oral Corticosteroids, Underuse of Inhaled Corticosteroids, and Implications for Biologic Therapy in Asthma. Respiration 2022;101(2):116-121.
10.Engelkes M, Janssens HM, de Jongste JC, Sturkenboom MC, Verhamme KM. Medication adherence and the risk of severe asthma exacerbations: a systematic review. Eur Respir J 2015; 45:396–407.
11.Murphy AC, Proeschal A, Brightling CE, Wardlaw AJ, Pavord I, Bradding P, et al. The relationship between clinical outcomes and medication adherence in difficult-to-control asthma. Thorax 2012; 67:751–3.
12.Gamble J, Stevenson M, McClean E, Heaney LG. The prevalence of nonadherence in difficult asthma. Am J Respir Crit Care Med 2009; 180:817–22.
13.Taube C, Bramlage P, Hofer A, Anderson D. Prevalence of oral corticosteroid use in the German severe asthma population. ERJ Open Res. 2019; Oct 30;5(4):00092-2019.
14.Difficult-to-Treat & Severe Asthma in adolescent and adult patients. Diagnosis and Management. GINA, 2021 (ginasthma.org)
15.Nair P, Wenzel S, Rabe KF, Bourdin A, Lugogo NL, Kuna P, Barker P, Sproule S, Ponnarambil S, Goldman M; ZONDA Trial Investigators. Oral Glucocorticoid-Sparing Effect of Benralizumab in Severe Asthma. N Engl J Med 2017;376: 2448-2458.
16.Dupin C, Belhadi D, Guilleminault L, Gamez AS, Berger P, De Blay F, Bonniaud P, Leroyer C, Mahay G, Girodet PO, Raherison C, Fry S, Le Bourdellès G, Proust A, Rosencher L, Garcia G, Bourdin A, Chenivesse C, Didier A, Couffignal C, Taillé C. Effectiveness and safety of dupilumab for the treatment of severe asthma in a real-life French multi-centre adult cohort. Clin Exp Allergy 2020;50: 789-798.
17.Lugogo N. The Rapidly Evolving Landscape of Asthma Therapies Is Exhilarating, Yet a Lack of Innovation in Clinical Trial Design Makes Feasibility a Real Concern. Am J Respir Crit Care Med 2025; 211:674-675.
18.van Veen IH, Ten Brinke A, Sterk PJ, Sont JK, Gauw SA, Rabe KF, Bel EH. Exhaled nitric oxide predicts lung function decline in difficult-to-treat asthma. Eur Respir J 2008; 32:344-9.
19.Graff S, Demarche S, Henket M, Paulus V, Louis R, Schleich F. Increase in blood eosinophils during follow-up is associated with lung function decline in adult asthma. Respir Med 2019; 152:60-66.
20.Porsbjerg C, Rupani H, Brannan JD, Ueki S, Nawijn MC, Erjefält JS, Chanez P, Anderson GP, Pavord ID. Reframing remission in severe asthma: a conceptual framework for distinguishing disease activity versus damage. Lancet Respir Med 2025; 13:1026-1040.
21.Haldar P, Brightling CE, Hargadon B, et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med 2009;360:973-984.
22.Busse WW, et al. Safety profile, pharmacokinetics, and biologic activity of MEDI-563, an anti-IL-5 receptor alpha antibody, in a phase I study of subjects with mild asthma. J Allergy Clin Immunol 2010; 125 (6):1237–1244 e2.
23.Kolbeck R, et al. MEDI-563, a humanized anti-IL-5 receptor alpha mAb with enhanced antibody-dependent cell-mediated cytotoxicity function. J Allergy Clin Immunol 2010; 125 (6):1344–1353 e2.
24.Magnan A, Bourdin A, Prazma CM, Albers FC, Price RG, Yancey SW, et al. Treatment response with mepolizumab in severe eosinophilic asthma patients with previous omalizumab treatment. Allergy 2016;71:1335–1344.
25.Wechsler ME, Akuthota P, Jayne D, Khoury P, Klion A, Langford CA, Merkel PA, Moosig F, Specks U, Cid MC, Luqmani R, Brown J, Mallett S, Philipson R, Yancey SW, Steinfeld J, Weller PF, Gleich GJ; EGPA Mepolizumab Study Team. Mepolizumab or Placebo for Eosinophilic Granulomatosis with Polyangiitis. N Engl J Med 2017; 376:1921-1932.
26.Han JK, Bachert C, Fokkens W, Desrosiers M, Wagenmann M, Lee SE, Smith SG, Martin N, Mayer B, Yancey SW, Sousa AR, Chan R, Hopkins C; SYNAPSE study investigators. Mepolizumab for chronic rhinosinusitis with nasal polyps (SYNAPSE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med 2021; 9:1141-1153.
27.Castro M, Zangrilli J, Wechsler M, Bateman E, Brusselle GG, Bardin P, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials.Lancet Respir Med 2015;3:355-366.
28.Pelaia C, Calabrese C, Vatrella A, Busceti MT, Garofalo E, Lombardo N, et al. Benralizumab: from the basic mechanism of action to the potential use in the biological therapy of severe eosinophilic asthma. BioMed Res Int 2018;2018:4839230.
29.Bleecker ER, FitzGerald JM, Chanez P, Papi A, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting ß 2 -agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet 2016;388:2115-2127.
30.FitzGerald JM, Bleecker ER, Nair P, Korn S, Ohta K, Lommatzsch M, et al. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 2016;388:2128-41.
31.Phase III ZONDA trial for benralizumab shows ability to reduce oral steroid use in severe asthma patients.Disponível na internet via WWW. Arquivo capturado em 14/07/2017. URL: https://www.astrazeneca.com/media-centre/press-releases/2017/phase-iii-zonda-trial-for-benralizumab-shows-ability-to-reduce-oral-steroid-use-in-severe-asthma-patients-22052017.html.
32.Busse WW, Bleecker, FitzGerald JM, Ferguson GT, Barker P, Sproule S, et al. Long-term safety and efficacy of beralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir Med 2018 Nov8.pii:S2213-2600(18)30406-5.
33.Nair P, Wenzel S, Rabe KF, Bourdin A, Lugogo NL, Kuna P, et al. Oral glucocorticoid-sparing effect of benralizumab in severe asthma. N Engl J Med 2017;376:2448-58.
34.Menzies-Gow A, Gurnell M, Heaney LG, Corren J, Bel EH, Maspero J, Harrison T, Jackson DJ, Price D, Lugogo N, Kreindler J, Burden A, de Giorgio-Miller A, Padilla K, Martin UJ, Garcia Gil E. Oral corticosteroid elimination via a personalised reduction algorithm in adults with severe, eosinophilic asthma treated with benralizumab (PONENTE): a multicentre, open-label, single-arm study. Lancet Respir Med 2022; 10:47-58.
35.McGregor MC, Krings JG, Nair P, Castro M. Role of biologics in asthma. Am J Respir Crit Care Med. 2019;199:433-445.
36.Albers FC, Licskai C, Chanez P, Bratton DJ, Bradford ES, Yancey SW, Kwon N, Quirce S. Baseline blood eosinophil count as a predictor of treatment response to the licensed dose of mepolizumab in severe eosinophilic asthma. Respir Med 2019;159: 105806.
37.Brusselle G, Germinaro M, Weiss S, Zangrilli J. Reslizumab in patients with inadequately controlled late-onset asthma and elevated blood eosinophils. Pulm Pharmacol Ther 2017; 43:39-45.
38.FitzGerald JM, Bleecker ER, Menzies-Gow A, Zangrilli JG, Hirsch I, Metcalfe P, Newbold P, Goldman M. Predictors of enhanced response with benralizumab for patients with severe asthma: pooled analysis of the SIROCCO and CALIMA studies. Lancet Respir Med 2018; 6:51-64.
39.Bleecker ER, Wechsler ME, FitzGerald JM, Menzies-Gow A, Wu Y, Hirsch I, Goldman M, Newbold P, Zangrilli JG. Baseline patient factors impact on the clinical efficacy of benralizumab for severe asthma. Eur Respir J 2018; 52:1800936.
40.Vatrlla A, Fabozzi I, Calabrese C, Maselli R, Pelaia G. Dupilumab: a novel treatment for arthma. J Asthma Allergy 2014;7:123-130.
41.Wenzel S, Castro M, Corren J, Maspero J, Wang L, et al. Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium-to-high-dose inhaled corticosteroids plus a long-acting ß 2 agonist: a randomised double-blind placebo-controlled pivotal phase 2b dose-ranging trial. Lancet 2016;388:31-44.
42.Rabe KF, Nair P, Brusselle G, Maspero JF, Castro M, Sher L, Zhu H, Hamilton JD, Swanson BN, Khan A, Chao J, Staudinger H, Pirozzi G, Antoni C, Amin N, Ruddy M, Akinlade B, Graham NMH, Stahl N, Yancopoulos GD, Teper A. Efficacy and Safety of Dupilumab in Glucocorticoid-Dependent Severe Asthma. N Engl J Med 2018;378: 2475-2485.
43.Castro M, Corren J, Pavord ID, Maspero J, Wenzel S, Rabe KF, Busse WW, Ford L, Sher L, FitzGerald JM, Katelaris C, Tohda Y, Zhang B, Staudinger H, Pirozzi G, Amin N, Ruddy M, Akinlade B, Khan A, Chao J, Martincova R, Graham NMH, Hamilton JD, Swanson BN, Stahl N, Yancopoulos GD, Teper A. Dupilumab Efficacy and Safety in Moderate-to-Severe Uncontrolled Asthma. N Engl J Med 2018; 28;378: 2486-2496.
44.Rabe KF , Nair P , Brusselle G , Maspero JF , Castro M , Sher L , et al . Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. N.Engl J Med 2018 ;378: 2475 – 2485 .
45.Holguin F, Cardet JC, Chung KF, et al. Management of severe asthma: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J 2020; 55: 1900588 [https://doi.org/ 10.1183/13993003.00588-2019].
46.Bacharier LB, Maspero JF, Katelaris CH, Fiocchi AG, Gagnon R, de Mir I, Jain N, Sher LD, Mao X, Liu D, Zhang Y, Khan AH, Kapoor U, Khokhar FA, Rowe PJ, Deniz Y, Ruddy M, Laws E, Patel N, Weinreich DM, Yancopoulos GD, Amin N, Mannent LP, Lederer DJ, Hardin M; Liberty Asthma VOYAGE Investigators. Dupilumab in Children with Uncontrolled Moderate-to-Severe Asthma. N Engl J Med 2021; 385:2230-2240.
47.Gauvreau GM, Sehmi R, Ambrose CS, Griffiths JM. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets 2020;24:777-792.
48.Liu S, Verma M, Michalec L, et al. Steroid resistance of airway type 2 innate lymphoid cells from patients with severe asthma: the role of thymic stromal lymphopoietin. J Allergy Clin Immunol 2018;141:257.
49.Corren J, Parnes J, Wang L, Mo M, Roseti SL, Griffiths JM, van der Merwe R. Tezepelumab in adults with uncontrolled asthma. N Engl J Med 2017; 377:936-946.
50.Menzies-Gow A, Corren, J, Bourdin, A, Chupp G, Israel E, et al. Tezepelumab in adults and adolescentes with severe, uncontrolled asthma. N Engl J Med 2021; 384:1800-1809.
51.Brusselle GG, Koppelman GH. Biologic therapies for severe asthma. N Engl J Med 2022; 386:157-171.
52.Corren J, Menzies-Gow A, Chupp G, Israel E, Korn S, Cook B, et al. Efficacy of tezepelumab in severe, uncontrolled asthma: pooled analysis of the PATHWAY and NAVIGATOR studies. Am J Respir Crit Care Med 2023; 208:13-24.
53.Jackson DJ, Wechsler ME, Jackson DJ, Bernstein D, Korn S, Pfeffer PE, Chen R, Saito J, de Luíz Martinez G, Dymek L, Jacques L, Bird N, Schalkwijk S, Smith D, Howarth P, Pavord ID; SWIFT-1 and SWIFT-2 Investigators; SWIFT-1 Investigators; SWIFT-2 Investigators. Twice-Yearly Depemokimab in Severe Asthma with an Eosinophilic Phenotype. N Engl J Med 2024; 391:2337-2349.
54.Hanania NA, Korenblat P, Chapman K, Bateman E, Kopecky P, Paggiaro P, et al. Efficacy and safety of lebrikizumab in patients with uncontrolled asthma (LAVOLTA and LAVOLTA II): replicalte, phase 3, randomised, double-blind, placebo-controlled trials. Lancet 2016;4:781-796.
55.Korenblat P, Kerwin E. Leshchernko I, Yen K, Holweg, Anzures-Cabrera J, Martin C, et al. Efficacy and safety of lebrikizumab in adult patients with mild-to-moderate asthma not receiving inhaled corticosteroids. Resour Med 2018;134:143-149.
56.Panettieri RA Jr, Sjobring U, Peterffy AM, Wessman P, Bowen K, Piper E, et al.Tralokinumab for severe, uncontrolled asthma (STRATOS 1 and STRATOS 2): two randomised, double-blind, placebo-controlled, phase 3 clinical trials. Lancet Respir Med 2018;6:511-25.
57.Jackson DJ, Wechsler ME, Jackson DJ, Bernstein D, Korn S, Pfeffer PE, Chen R, Saito J, de Luíz Martinez G, Dymek L, Jacques L, Bird N, Schalkwijk S, Smith D, Howarth P, Pavord ID; SWIFT-1 and SWIFT-2 Investigators; SWIFT-1 Investigators; SWIFT-2 Investigators. Twice-Yearly Depemokimab in Severe Asthma with an Eosinophilic Phenotype. N Engl J Med 2024; 391:2337-2349.
58.Varricchi G, Ferri S, Pepys J, Poto R, Spadaro G, Nappi E, Paoletti G, Virchow JC, Heffler E, Canonica WG. Biologics and airway remodeling in severe asthma. Allergy 2022; 77:3538-3552.
59.Kelsen SG, Agache IO, Soong W, Israel E, Chupp GL, Cheung DS, Theess W, Yang X, Staton TL, Choy DF, Fong A, Dash A, Dolton M, Pappu R, Brightling CE. Astegolimab (anti-ST2) efficacy and safety in adults with severe asthma: A randomized clinical trial. J Allergy Clin Immunol 2021; 148:790-798.
60.Wechsler ME, Ruddy MK, Pavord ID, Israel E, Rabe KF, Ford LB, Maspero JF, Abdulai RM, Hu CC, Martincova R, Jessel A, Nivens MC, Amin N, Weinreich DM, Yancopoulos GD, Goulaouic H. Efficacy and Safety of Itepekimab in Patients with Moderate-to-Severe Asthma. N Engl J Med 2021 28; 385:1656-1668.
61.England E, Rees DG, Scott IC, Carmen S, Chan DTY, Chaillan Huntington CE, Houslay KF, Erngren T, Penney M, Majithiya JB, Rapley L, Sims DA, Hollins C, Hinchy EC, Strain MD, Kemp BP, Corkill DJ, May RD, Vousden KA, Butler RJ, Mustelin T, Vaughan TJ, Lowe DC, Colley C, Cohen ES. Tozorakimab (MEDI3506): an anti-IL-33 antibody that inhibits IL-33 signalling via ST2 and RAGE/EGFR to reduce inflammation and epithelial dysfunction. Sci Rep 2023; 13:9825.
62.Allinne J, Scott G, Lim WK, Birchard D, Erjefält JS, Sandén C, Ben LH, Agrawal A, Kaur N, Kim JH, Kamat V, Fury W, Huang T, Stahl N, Yancopoulos GD, Murphy AJ, Sleeman MA, Orengo JM. IL-33 blockade affects mediators of persistence and exacerbation in a model of chronic airway inflammation. J Allergy Clin Immunol 2019; 144:1624-1637.e10.
63.Domingo C, Palomares O, Sandham DA, et al. The prostaglandin D2 receptor 2 pathway in asthma: a key player in airway inflammation. Respir Res 2018;19:189.
64.Gonem S, Berair R, Singapuri A, et al. Fevipiprant, a prostaglandin D2 receptor 2 antagonist, in patients with persistent eosinophilic asthma: a single-centre, randomised, double-blind, parallel-group, placebo-controlled trial. Lancet Respir Med 2016;4:699-707.
65.Bateman ED, Guerreros AG, Brockhaus F, et al. Fevipiprant, an oral prostaglandin DP2 receptor (CRTh2) antagonist, in allergic asthma uncontrolled on low-dose inhaled corticosteroids. Eur Respir J 2017;50:1700670. doi:10.1183/13993003.00670-2017.
66.Brightling CE, Gaga M, Inoue H, Li J, Maspero J, Wenzel S, Maitra S, Lawrence D, Brockhaus F, Lehmann T, Brindicci C, Knorr B, Bleecker ER. Effectiveness of fevipiprant in reducing exacerbations in patients with severe asthma (LUSTER-1 and LUSTER-2): two phase 3 randomised controlled trials. Lancet Respir Med 2021; 9:43-56.
67.EUFOREA – Pocket guide asthma. 2023. Disponível em: https://www.euforea.eu/sites/default/files/2023%20EUFOREA%20Asthma%20Pocket%20Guide.pdf
68.Dedaj R, Unsel L. Case study: A Combination of Mepolizumab and Omaluzimab injections for severe asthma. J Asthma 2019; 56:473-474.
69.Domingo C, Pomares X, Morón A, Sogo A. Dual Monoclonal Antibody Therapy for a Severe Asthma Patient. Front Pharmacol 2020; 11:587621.
70.Jackson DJ, Pavord ID. Living without eosinophils: evidence from mouse and man. Eur Respir J 2023; 61:2201217.
71. Mattucci A, Micheletto C, Vultaggio A. Severe asthma and biologics: Managing complex patients. J Investig Allergol Clin Immunol 2023; 33:168-178
72.van Schouwenburg PA, Rispens T, Wolbink GJ. Immunogenicity of anti-TNF biologic therapies for rheumatoid arthritis. Nat Rev Rheumatol 2013; 9:164-72.
73.De Groot AS, Scott DW. Immunogenicity of protein therapeutics. Trends Immunol 2007; 28:482-90.
74.Hansel TT, Kropshofer H, Singer T, Mitchell JA, George AJ. The safety and side effects of monoclonal antibodies. Nat Rev Drug Discov 2010; 9:325-38.
75.Ortega H, Meyer E, Brusselle G, Asano K, Price R, Prazma C, et al. Immunogenicity of Mepolizumab in Patients with Severe Eosinophilic Asthma: Experience from the Clinical Development Program. Eur Resp J 2018; 52:OA1650.
76.Naftel J, Jackson DJ, Coleman M, d'Ancona G, Heaney LG, Dennison P, Bossios A, Rupani H. An international consensus on the use of asthma biologics in pregnancy. Lancet Respir Med 2025; 13:80-91.
77.Seluk L, Rhoads SL, Davis A, et al. Biologic therapies in asthma. In: Jackson DJ, McDonald VM, Pavord ID, eds. Asthma (ERS Monograph). Sheffield, European Respiratory Society, 2025; pp. 257–270
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|