|
Asma
DIAGNÓSTICO DIFERENCIAL DA ASMA
Há mais de 100 anos o laringologista americano Chevalier-Jackson, o pai da broncoscopia, citava “nem tudo que sibila é asma”.1 Inúmeras patologias são capazes de reduzir a luz das vias aéreas, com manifestações estetoacústicas semelhantes às observadas na asma brônquica. Nas Tabelas 1.1 e 1.2 são apresentadas as principais doenças que fazem diagnóstico diferencial com a asma, nas crianças e em adultos respectivamente.
Tabela 1.1 — Diagnóstico Diferencial da Asma nas Crianças
| • Doenças das Vias Aéreas Superiores |
| Rinite Alérgica e Sinusite |
| • Obstrução nas Grandes Vias Aéreas |
| Corpo Estranho na Traqueia ou Brônquios (aspiração) |
| Obstrução Laríngea Induzível |
| Anéis Vasculares |
| Laringotraqueomalácia, Estenose de Traqueia ou Estenose Brônquica |
| • Obstrução em Pequenas Vias Aéreas |
| Bronquiolite Viral ou Bronquiolite Obliterante |
| Fibrose Cística |
| Displasia Broncopulmonar |
| Doença Cardíaca |
| • Outras Causas |
| Tosse recorrente por outra causa que não a asma |
| Aspirações traqueais por assincronia de degluitição ou refluxo gastresofagiano |
Tabela 1.2 — Diagnóstico Diferencial da Asma nos Adultos
Diagnostico Diferencial da Asma |
| Doença Pulmonar Obstrutiva Crônica |
| Aspergilose Broncopulmonar Alérgica |
| Reações Alérgicas e Anafiláticas |
| Insuficiência Cardíaca Congestiva |
| Embolia Pulmonar |
| Obstrução Mecânica das Vias Aéreas (tumorações) |
| Síndrome Carcinoide com Metástases Hepáticas |
| Infiltração Pulmonar por Eosinófilos |
| Tosse Secundária a Drogas (inibidores da ECA...) |
| Disfunção das Cordas Vocais |
| Paralisia de Cordas Vocais |
Outras causas de sibilos pouco comuns e que podem induzir um errôneo diagnóstico de asma incluem: deposição amiloide, síndrome carcinoide, condromalacia, aneurismas da aorta descendente, bócio mergulhante, granulomas, granulomatose eosinofílica com poliangiite (GEPA) antigamente conhecida como Síndrome de Churg-Strauss, torção brônquica pós-lobectomia, estenose por irradiação e a sépsis.2
Doença Pulmonar Obstrutiva Crônica
Na prática clínica, algumas patologias, com maior frequência, mimetizam a asma. A doença pulmonar obstrutiva crônica (DPOC) nos adultos talvez seja a mais comum. Embora ambas possam coexistir (> 10% dos pacientes com asma têm características de DPOC), às vezes torna-se um desafio para o clínico distingui-las. Ambas apresentam semelhanças entre si, pois ambas são doenças crônicas, apresentam inflamação com limitação ao fluxo aéreo, causam broncoconstrição e consequente dispneia, acometem as pequenas vias aéreas e secretam muco.
Na maioria das vezes a asma inicia-se na infância, enquanto que a DPOC em pessoas com mais de 40 anos, sendo mais prevalente na sexta e sétima décadas, ocorrendo nítida associação com o tabagismo. Quando o início da asma ocorre na idade adulta em pacientes fumantes, a distinção nem sempre é clara. Um fator importante é a atopia, pois a grande maioria dos asmáticos são atópicos, apresentando por vezes outras doenças como a rinite alérgica e o eczema, devendo ser ressaltado, entretanto, que nem todo o atópico apresenta asma. A asma caracteriza-se pela hiper-responsividade brônquica que predispõe o paciente ao broncospasmo quando exposto a agentes desencadeantes como a inalação de poeira doméstica, pólens, pelos, substâncias excretadas por animais, irritantes (fumaça de cigarro, poluição ambiental, smog, gás natural, propano), pó de giz, odores fortes, aerossóis químicos, mudanças de temperatura e pressão do ambiente etc. Os sintomas da asma variam de um dia para o outro. A DPOC caracteriza-se pela dispneia durante o exercício.
As provas de função pulmonar contribuem para o diagnóstico e para distinguir uma doença da outra. Embora ambas sejam doenças obstrutivas, as provas funcionais são normais nos asmáticos leve intermitentes e leve persistentes. A obstrução na DPOC se deve primariamente à obstrução fixa das vias aéreas e ao consequente aumento na resistência das mesmas e é sempre progressiva. Por outro lado, a asma caracteriza-se pela reversibilidade da obstrução ao uso de broncodilatadores, muitas vezes com resultados espetaculares, e normalização dos parâmetros, ao contrário da DPOC, que responde mal aos broncodilatadores e o seu VEF1 permanece sempre abaixo dos 80% do teórico. Os asmáticos no período intercrises apresentam provas funcionais normais. O pico de fluxo expiratório (PFE) na asma apresenta uma variabilidade > 20% no decurso do dia, o que não ocorre na DPOC. Quando as provas funcionais não forem capazes de estabelecer o diagnóstico, pode-se indicar o teste de provocação brônquica com a metacolina. Na asma a resposta é considerada positiva se o VEF1 cair mais de 20% ou quando de queda > 45% na condutância específica. Outras diferenças entre as duas doenças são descritas na Tabela 2.
Alguns autores preconizam investigar a deficiência do inibidor de protease alfa1-antitripsina (AAT) nos pacientes adultos jovens com diagnóstico de asma brônquica com obstrução irreversível pois, a deficiência de AAT aumenta o risco de DPOC.
Do ponto de vista histopatológico, tanto na asma quanto na DPOC (sobretudo na grave) ocorre a inflamação da parede brônquica. Na asma grave, mas não na DPOC, há hipertrofia do músculo liso das vias aéreas. Na asma, mesmo nas formas leves observa-se o espessamento da membrana basal, característica ausente na DPOC. Na asma há fibrose subepitelial, enquanto que na DPOC a fibrose é peribronquiolar, por fora das vias aéreas, o que leva a seu estreitamento progressivo. Na asma não existe destruição das paredes alveolares, o que é característico dos casos de DPOC. Tabela 3
Tabela 2 — Diferenças Entre a Asma e a DPOC
Características |
Asma |
DPOC |
| Anatomia |
vias aéreas |
vias aéreas e parênquima |
| Tipo de Inflamação |
eosinofílica tipo 2 |
inflamação neutrofílica |
| Reversibilidade da obstrução |
quase sempre reversível |
quase sempre irreversível |
| Progressão da doença |
crônica, porém não caracterizada como progressiva |
crônica com obstrução progressiva |
| Declínio funcional |
fisiológico ou leve |
acelerado |
| Condições relacionadas |
alergias, rinite, eczema |
dois fenótipos principais bronquite crônica e enfisema |
| Sintomas noturnos |
comuns |
incomuns |
| Tabagismo |
geralmente não fumantes |
quase sempre fumantes |
| Resposta aos corticoides inalatórios |
boa resposta |
inconsistente, pouco êxito na limitação ao fluxo aéreo |
| Resposta ao broncodilatador |
boa |
apenas em 15–25% |
| Limitação ao fluxo aéreo |
aumento da variabilidade diurna |
variabilidade diurna normal
|
| Função respiratória |
pode ser normal entre episódios agudos |
tipicamente anormal e obstrutiva e diminui ao longo do tempo |
| FeNO |
geralmente elevada |
geralmente normal |
| Radiologia de tórax |
usualmente normal |
quase sempre alterada |
Tabela 3 — Diferenças entre a Asma e a DPOC - Histopatologia
Características |
Asma |
DPOC |
| Inflamação |
+++ |
+++ |
| Músculo Liso Brônquico |
+++ |
+ |
| Membrana Basal |
++ |
– |
| Fibrose |
+ (subepitelial) |
+++ (peribronquiolar) |
| Rotura Alveolar |
– |
+++ |
| Vasos Brônquicos |
++ |
Inalterado |
| Mastócitos |
Ativados |
Normal |
| Células Dendríticas |
++ |
Indeterminado |
| Eosinófilos |
++ |
Normal |
| Neutrófilos |
Normal |
++ |
| Linfócitos |
Th2 |
Th1 e Tc1 |
| Epitélio |
Despreendido |
Pseudoestratificado |
| Células Caliciformes |
++ |
++ |
Síndrome de Sobreposição Asma e DPOC (ACOS) — Asma e DPOC são duas doenças inflamatórias crônicas que afetam as vias aéreas do sistema respiratório. Quando elas estão combinadas, o termo Síndrome de Sobreposição Asma e DPOC (ACOS) se aplica e está incluído nos últimos Consensos Internacionais de Doenças Respiratórias.
Nas discussões sobre a história natural da DPOC remonta à década de 1960, a chamada hipótese holandesa.3 Esta enfatiza o papel da hipersensibilidade na modulação da resposta das vias aéreas à exposição a irritantes. Nesta teoria, a suscetibilidade foi proposta como relacionada em grande parte às características do paciente associadas à alergia e manifestada parcialmente por sibilos. Os asmáticos que têm asma desde a infância e que apresentam fatores de risco como tabagismo ou exposição a combustível de biomassa tendem a desenvolver características semelhantes à DPOC nos seus últimos anos de vida. Este é um fenótipo de pacientes que podem ter ACOS.4
A ACOS torna-se cada vez mais prevalente de acordo com o aumento da idade e a história de tabagismo, dando a impressão de que com a idade existe uma progressão da obstrução reversível das vias aéreas dos asmáticos mais jovens para obstrução mais irreversível dos pacientes mais velhos com DPOC.
Em um relatório de uma coorte longitudinal de 3.099 indivíduos do Tucson Epidemiological Study of Airway Obstructive Disease, adultos diagnosticados com asma apresentaram um risco 12,5 vezes maior de adquirir DPOC ao longo do tempo em comparação com aqueles sem asma, mesmo após o ajuste para história de tabagismo.5
Insuficiência Cardíaca Congestiva
Outra patologia que produz sibilância e em muitas ocasiões confunde-se com a asma, principalmente nas salas de emergência, é a insuficiência cardíaca congestiva (ICC), em decorrência de falência ventricular esquerda. Tanto a asma como a ICC provocam dispneia, sibilos, ortopneia e opressão torácica. Até recentemente acreditava-se que os sibilos e o broncospasmo da ICC eram decorrência do edema da mucosa, líquido intraluminal e edema intersticial, em consequência da elevação da pressão de enchimento do ventrículo e átrio esquerdos, com aumento da resistência vascular sistêmica, ou seja, um broncospasmo com mediação unicamente hemodinâmica. A congestão com o ingurgitamento dos vasos brônquicos pode reduzir a luz das vias aéreas periféricas, com aumento da resistência ao fluxo aéreo, determinando alterações de ventilação-perfusão, com elevação do gradiente alvéolo-arterial P(A-a)O2, hipoxemia e aumento na relação VD/VT.
Sabe-se na atualidade que as vias aéreas na ICC são hiper-responsivas, e talvez este seja outro fator com implicações na fisiopatologia da dispneia. Snashall e Chung6 avaliaram a obstrução brônquica em pacientes com ICC e estenose mitral através de testes de provocação com metacolina, acetilcolina e histamina, tendo obtido resultados consistentes que comprovavam a hiper-responsividade em 69% dos pacientes examinados. A broncoconstrição inflamatória da ICC parece ser mediada pelas terminações nervosas de fibras-C desmielinizadas nos brônquios, na circulação pulmonar e no parênquima pulmonar (receptores J ou justacapilares). Em animais de experimentação (cão), estes receptores sob estimulação vagal têm a sua atividade quintuplicada como resultado do edema pulmonar.7
Cabanas et al.8 estudaram como a congestão vascular estimula as fibras-C na parede brônquica, desencadeando o reflexo de broncoconstrição em pacientes com ICC, pela provocação com a metacolina inalada. Neste estudo, o pré-tratamento com a metoxamina (10 mg por inalação), um agente agonista adrenérgico a1-receptor-seletivo com potente ação vasoconstritora, prevenia um declínio no VEF1 após a inalação da metacolina. Este efeito protetor da metoxamina era abolido quando 6 dos 12 indivíduos recebiam a fentolamina, um antagonista a-adrenérgico. A administração de salbutamol levava a reversão do quadro em 43% dos casos em que a VEF1 reduzira-se sob o efeito da metacolina. Os autores concluíram que a hiper-responsividade brônquica aos agentes agonistas colinérgicos é frequente em pacientes com insuficiência ventricular esquerda e pode contribuir para o broncospasmo e dispneia frequentemente observada nestes pacientes. A broncoconstrição pode ser mediada pelo menos em parte pela dilatação dos vasos brônquicos. Estes achados sugerem que a estimulação das fibras-C pode aumentar a vasodilatação brônquica.
Muitas vezes para o diagnóstico, exames complementares são necessários, como as provas de função pulmonar, ecocardiografia com doppler e raramente o cateterismo cardíaco.
Obstrução Respiratória Alta
Várias condições que determinam obstrução de vias aéreas superiores configuram um grupo de doenças que pode se confundir com a asma, dentre elas os tumores, as estenoses, os pólipos, a paralisia das cordas vocais, o edema de laringe, a epiglotite, as malformações vasculares, a amiloidose, os granulomas, a disfunção das cordas vocais etc.
Os tumores podem ser os benignos, malignos ou metastáticos. Os tumores malignos mais frequentes são os da laringe (epidermoide). Quando comparado com a laringe e os brônquios, o tumor de traqueia é um sítio raro de tumoração maligna, sendo, entretanto, os mais comuns, o carcinoma adenomatoso cístico, o epidermoide e por vezes a extensão de um carcinoma broncogênico primário. Pacientes com neoplasia de traqueia são frequentemente tratados como asmáticos por longos períodos até que o diagnóstico correto seja efetuado.9-11 As metástases podem determinar obstrução e sibilância,10 sendo os tumores primários mais comuns, os linfomas e os adenocarcinomas de mama e cólon. Embora o sarcoma de Kaposi acometa principalmente a pele, os gânglios e o trato gastrintestinal, é comum em pacientes com SIDA determinar obstrução alta por comprometimento laríngeo e traqueal, confundindo-se com a asma.12
A obstrução das vias aéreas superiores não é bem discriminada pela espirometria, pois o VEF1 só cai quando a luz se reduz a um diâmetro inferior a 6 mm. A curva fluxo-volume expiratória/inspiratória permite determinar o nível da obstrução e a natureza da lesão.13 Os efeitos dinâmicos das lesões das vias aéreas altas dependem de sua situação intratorácica ou extratorácica, se é fixa ou variável e de sua extensão. As vias aéreas extratorácicas estão submetidas à pressão atmosférica, enquanto que as intratorácicas à pressão pleural.
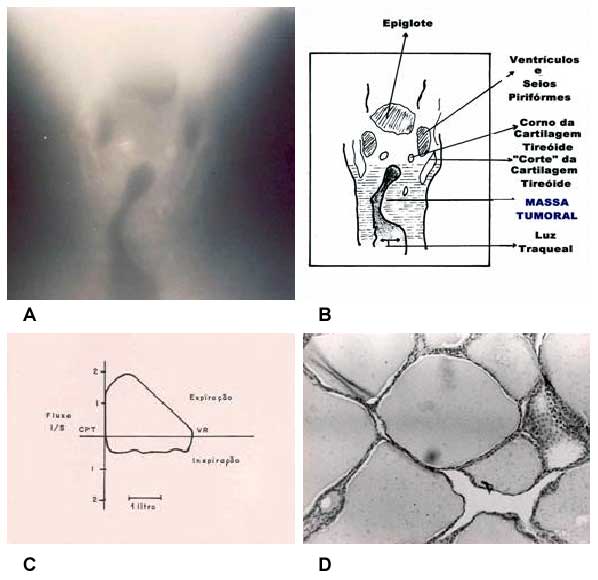
Na Figura 1 é descrito um caso raro de tireoide intratraqueal, tratada erroneamente como asma brônquica por quatro anos.14 A tumoração exofítica crescente permite um diâmetro de área transversal variável. Durante a inspiração a traqueia extratorácica apresenta-se com pressão transmural que favorece ao estreitamento, pois a pressão intraluminal é subatmosférica, enquanto que a extraluminal é aproximadamente a da atmosfera. Desta forma uma lesão variável extratorácica tende a causar diminuição dos fluxos inspiratórios e relativamente pouca alteração na fase expiratória quando a pressão intraluminal é positiva em relação à extraluminal.
Obstrução Laríngea Induzível
Outra patologia que algumas vezes se confunde com a asma é a
obstrução laríngea induzível (OLI) antes conhecida como
disfunção das cordas vocais (DCV).
As OLIs abrangem a disfunção das cordas vocais (DCV) e o movimento paradoxal das cordas vocais, entre outros. Em sua essência, essas condições são caracterizadas por um reflexo laríngeo hiperfuncionante, que conduz a uma adução anormal das cordas vocais ou a um movimento glótico, resultando na obstrução do fluxo de ar. Essa obstrução é clássica durante a inspiração, mas também pode manifestar-se durante a expiração.
Atualmente, aproximadamente 25% dos pacientes encaminhados ao National Jewish Medical & Research Center com o diagnóstico de asma têm DCV. 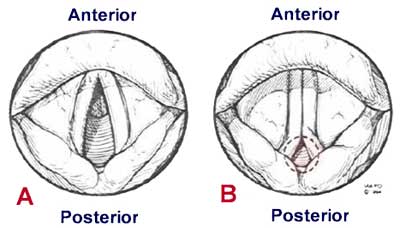 A OLI é uma entidade associada a distúrbio funcional da laringe, com forte componente psicossomático (conversão) ou a outros distúrbios psicológicos,15-17 que determinam episódios recorrentes de dispneia “fictícia” e em certas ocasiões severa obstrução com retenção de CO2. A OLI é uma causa comum de dispneia também em asmáticos. A OLI é uma entidade associada a distúrbio funcional da laringe, com forte componente psicossomático (conversão) ou a outros distúrbios psicológicos,15-17 que determinam episódios recorrentes de dispneia “fictícia” e em certas ocasiões severa obstrução com retenção de CO2. A OLI é uma causa comum de dispneia também em asmáticos.
Para entender a OLI é útil saber como as cordas vocais normalmente funcionam. Quando da inspiração, as cordas vocais se abrem, permitindo a passagem do ar em direção à traqueia. Na OLI elas não se abrem, ou utilizando outra terminologia, elas se contraem, quando da inalação do ar. Isto deixa somente uma pequena passagem para o ar fluir, através de uma pequena abertura na fenda posterior da glote.18 (Figura 2)
A etiologia da OLI ainda não foi estabelecida. Uma teoria vigente relaciona-a à hiper-responsividade da laringe decorrente de uma função nervosa autonômica alterada, pós-inflamação local. Esta anormalidade na função autônoma pode ser temporária ou persistente.
 O diagnóstico da OLI é difícil devido aos seus sintomas inespecíficos. A OLI acomete indivíduos de qualquer idade, sendo mais comum, entretanto, em mulheres entre 20 e 40 anos, com problemas psicológicos e história de depressão e ansiedade. A sintomatologia dominante é dispneia não responsiva ao broncodilatador, sendo o ruído típico o estridor inspiratório monofônico, enquanto a asma se caracteriza por sibilância polifônica expiratória. O exercício, a atividade física e situações estressantes podem causar a OLI. A OLI geralmente ocorre durante a inspiração e surge repentinamente com sintomas localizados na laringe ou parte superior do tórax. O diagnóstico é efetuado pela laringoscopia, durante a crise, quando se demonstra a não abertura das cordas vocais durante a inspiração, com a abertura da fenda posterior da glote.
Ao longo dos anos, vários termos foram utilizados para descrever esse distúrbio, mais frequentemente movimento paradoxal das cordas vocais, disfunção das cordas vocais (DCV) e, mais recentemente, OLI.
O diagnóstico da OLI é difícil devido aos seus sintomas inespecíficos. A OLI acomete indivíduos de qualquer idade, sendo mais comum, entretanto, em mulheres entre 20 e 40 anos, com problemas psicológicos e história de depressão e ansiedade. A sintomatologia dominante é dispneia não responsiva ao broncodilatador, sendo o ruído típico o estridor inspiratório monofônico, enquanto a asma se caracteriza por sibilância polifônica expiratória. O exercício, a atividade física e situações estressantes podem causar a OLI. A OLI geralmente ocorre durante a inspiração e surge repentinamente com sintomas localizados na laringe ou parte superior do tórax. O diagnóstico é efetuado pela laringoscopia, durante a crise, quando se demonstra a não abertura das cordas vocais durante a inspiração, com a abertura da fenda posterior da glote.
Ao longo dos anos, vários termos foram utilizados para descrever esse distúrbio, mais frequentemente movimento paradoxal das cordas vocais, disfunção das cordas vocais (DCV) e, mais recentemente, OLI.
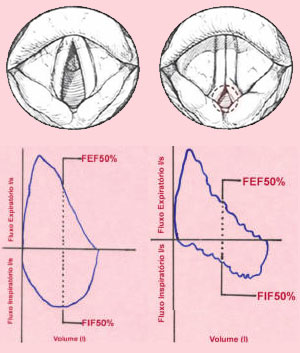
O teste diagnóstico padrão-ouro é a laringoscopia direta, permitindo a visualização da adução excessiva das cordas vocais ou das estruturas laríngeas durante a inspiração ou ao longo do ciclo respiratório. A laringoscopia normal em ausência de sintomas não exclui o diagnóstico, havendo relatos de 40% de falsos negativos. Torna-se necessário "provocar" os sintomas, através de exercícios ou pelo teste com a metacolina.19 Utilizam-se também a hiperventilação voluntária eucápnica20,21 e o teste de oscilometria de impulso22,23 como auxiliares no diagnóstico. A experiência do endoscopista é muito importante, evitando diagnósticos errôneos como o laringoespasmo. A curva fluxo-volume evidencia fluxos muito baixos na alça inspiratória, sendo um exame normal entre as crises (Figura 3). Na Tabela 4 estão os indicadores que podem auxiliar no diagnóstico da OLI.24
Tabela 4 — Indicadores Diagnósticos para a Obstrução Laríngea Induzível
Indicadores Diagnósticos |
| • Início súbito |
• Recuperação rápida |
| • Aperto na "garganta" |
• Som inspiratório típico (estridor) |
| • Tosse (seca) |
• Alterações associadas na voz |
| • Sensação de globo faríngeo |
• Sem resposta a medicamentos (inaladores, COs) |
| • Alça Inspiratória "achatada" na curva fluxo-volume |
• Adução da abertura glótica/supraglótica na laringoscopia |
Traqueobronquiomalácia e Colapso Dinâmico Excessivo das Vias Aéreas
Outras condições que eventualmente podem fazer diagnóstico diferencial de asma e às vezes participam como comorbidades são a
traqueobronquiomalácia (TBM) e o colapso dinâmico excessivo das vias aéreas – (EDAC – Excessive Dynamic Airway Collapse). São anormalidades das vias aéreas que compartilham a característica comum de estreitamento expiratório, mas representam entidades fisiopatológicas distintas. Ambas as condições são coletivamente referidas como colapso central expiratório das vias aéreas – (ECAC – Expiratory Central Airway Collapse).
São condições em que há debilidade patológica das paredes traqueal e de brônquios principais por perda de sua rigidez normal devido à fraqueza das cartilagens (malácia) e pela hipotonia dos elementos mioelásticos.25 O termo colapso das grandes vias aéreas é utilizado para descrever o fenômeno no qual a traqueia e/ou os brônquios principais demonstram movimento excessivo
de sua membrana muscular posterior para dentro da via aérea durante a fase expiratória do ciclo respiratório (Figura 4).26,27

Figura 4 – Ilustrações com traqueia normal (A), colapso dinâmico excessivo das vias aéreas (EDAC) demonstrando a curvatura exagerada da membrana posterior da traqueia com integridade da cartilagem (B) e traqueomalácia com cartilagem traqueal deformada, achatada (C). Figura baseada em Aslam, A et al.32
A ECAC é algumas vezes diagnosticada erroneamente como asma, pois se apresenta com sintomas semelhantes aos da asma com dispneia, produção de muco, tosse persistente que não responde a tratamentos convencionais e episódios de infecções recorrentes.25
O ECAC é mais comum que a TBM e ambas são mais prevalentes em mulheres, com idade avançada e asma grave. Até 70% e 19% dos pacientes de uma coorte de asma grave apresentaram EDAC e TBM, respectivamente.28
O critério diagnóstico mais relatado em metanálises para diagnóstico é o da redução ≥ 50% no calibre traqueal ou de brônquios principais na expiração final na TC expiratória dinâmica.29-31
Drogas e Efeitos Colaterais
Muitas drogas estão associadas à broncoconstrição (Tabela 5), podendo seus efeitos colaterais levar a um errôneo diagnóstico de asma brônquica.
Tabela 5 — Drogas que Podem Determinar Broncospasmo e Tosse
Drogas Associadas à Broncoconstrição |
| β-Bloqueadores (oral, IV, colírios) |
| Inibidores de Colinesterase |
| Aspirina e Anti-inflamatórios não hormonais |
| Inibidores da Enzima Conversora da Angiotensina |
| Meios de Contraste |
| Bloqueadores Neuromusculares |
| Agentes por Inalação – propelentes, dispersantes, pentamidina |
| Vacinas (se alergia ao ovo) |
| Anestésicos Locais – sulfitos |
Os ß-bloqueadores podem causar dispneia mesmo em pacientes que não apresentem história prévia de asma,33 porém quando isto ocorre, muitos apresentam história familiar de atopia e asma. O broncospasmo pode ser desencadeado após a administração de gotas de colírio, sendo que os sintomas desenvolvem-se em minutos. Um dos mais utilizados para o tratamento do glaucoma é o timolol, um agente ß-bloqueador não seletivo.34
Mesmo a administração ocular apresenta um rápido acesso da droga à circulação sistêmica, via ducto nasolacrimal e mucosa nasal; sendo que mesmo uma gota de uma solução a 0,5% apresenta níveis plasmáticos mensuráveis.35 O betaxolol é um bloqueador ß1 -seletivo que pode ser utilizado como colírio alternativo ao timolol. Outra droga alternativa é a dipivefrin, pró-droga da adrenalina, formada pela diesterificação da adrenalina e ácido piválico, efetiva no glaucoma, sem provocar os riscos de broncoconstrição.34
Os inibidores da colinesterase, utilizados no tratamento da miastenia gravis, como o brometo de piridostigmina, a neostigmina e o ambenonium também podem determinar broncospasmo.32 Inibidores da colinesterase têm sido empregados localmente em uma variedade de patologias oftalmológicas como a exotropia acomodativa, assim como na própria miastenia gravis limitada aos músculos extraoculares e das pálpebras.35
Outras drogas como a aspirina e os anti-inflamatórios não hormonais podem ser melhor estudados no capítulo específico sobre o assunto, nesta publicação.
Quanto aos meios de contraste, a maioria dos pacientes apresenta doença subclínica com redução do fluxo aéreo medido pelo PFE37 ou VEF1.38,39 A redução ocorre após 4 a 5 minutos, em média 7,5% abaixo do valor basal, retornando ao valor basal em 30 minutos.33 Esta redução foi notada também naqueles com e sem história de alergia, embora, a percentagem de redução apresente uma maior tendência naqueles com história de alergia.37 O mecanismo do broncospasmo pelos meios de contraste não é conhecido. Algumas teorias são propostas como a ativação dos mastócitos com liberação de histamina e leucotrienos. Os contrastes com menor osmolaridade apresentam menor sintomatologia adversa respiratória.
Quanto aos inalantes, os próprios propelentes e dispersantes das "bombinhas" podem desencadear broncospasmo. A pentamidina utilizada como agente profilático contra a pneumonia pelo Pneumocystis carinii em pacientes com SIDA pode frequentemente determinar tosse e broncospasmo.16,40 O broncospasmo tem sido relatado após a administração de bloqueadores neuromusculares como a D-tubocurarina,40 alcuronium,41,42 atracurium42,43 e vecuronium.42 A incidência é baixa, entretanto, com percentual de 0,2% de 1.856 pacientes que receberam atracurium e 0,1% de 1.425 pacientes que receberam alcuronium.40 O broncospasmo é atribuído à liberação de histamina por estas drogas. Embora considerada a droga de escolha em asmáticos, há relato de broncospasmo inclusive pelo pancuronium.45,46
A tosse tem sido relatada em 1 a 25% dos pacientes que utilizam inibidores da enzima conversora da angiotensina (ECA).33 A hiper-responsividade brônquica tem sido demonstrada em muitos pacientes que apresentam esta sintomatologia com sua utilização. Não há, entretanto, consenso quanto ao achado de níveis elevados de bradicinina nestes pacientes.2
Referências
01.Ahmed T, Krieger BP, Wanner A. — Differential diagnosis of asthma in the elderly. In : Barbee RA, Bloom JW. Asthma in the Elderly . New York: Marcel Dekker; 1997:93:120.
02.Krieger BP. When wheezing may not mean asthma. Postgrad Méd 2002; 112:101-2.
03.Orie NGM, Sluiter ID, De Vries K, Tammeling GJ, Witkop J. —The host factor in bronchitis. In: Orie NGM, Sluiter HJ, eds. Bronchitis. Assen, Netherlands: Royal Van Gorcum; 1961:43-59.
04.Fabbri LM, Romagnoli M, Corbetta L. Differences in airway inflammation in patients with fixed airflow obstruction due to asthma or chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2003; 167:418-24.
05.Silva GE, Sherrill DL, Guerra S, Barbee RA. Asthma as a risk factor for COPD in a longitudinal study. Chest 2004; 126:59-65.
06.Snashall PD, Chung KF. Airway obstruction and bronchial hiperresponsiveness in left ventricular failure and mitral stenosis. Am Rev Respir Dis 1991; 144:945-56.
07.Roberts AM, Bhattacharya J, Schultz HD, Coleridge HM, Coleridge JC.
Stimulation of vagal afferent C-fibers by lung edema in dogs. Circ Res 1986; 58:512-22.
08.Cabanes LR, Weber SN, Matran R, Regnard J, Richard MO, Degeorges ME, Lockhart A.
Bronchial hyperresponsiveness to metacholine in patients with impaired left ventricular function. N Engl J Med 1989; 320:1317-22.
09.Houston HE, Payne WS, Harrison EG Jr, Olsen AM.
Primary cancers of trachea. Arch Surg 1969; 99:132-40.
10.Garces M, Tsai E, Marsan RE. Endotracheal metastasis. Chest 1974; 65:350-1.
11.Hakami M, Pai RP, Fine G et al. Fibrous histocytoma of trachea. Chest 1975 ; 68:367-8.
12.Argyros Gj, Torrington KG. Fiberoptic bronchoscopy in the evaluation of carcinoma metastatic to the lung. Chest 1994; 105:454-7.
13.Buist AS. — Closing Volumes and Flow-Volume Studies. In : Chusid EL. The Selective and Comprehensive Testing of Adult Pulmonary Function . New York: Futura Publishing Company, Inc.; 1983:55-75.
14.Telles Filho PA, Teixeira CC, Bellizzi CE, Mota GV. Tireóide intratraqueal: causa rara de obstrução respiratória alta. Pulmão RJ 1991; 1:66.
15.Cristopher KL, Wood RP, Eckert RC, Blager FB, Raney RA, Souhrada JF. Vocal cord dysfunction presenting as asthma. N Engl J Med 1983; 308:1566-70.
16.Rodenstein DO, Francis C, Stanescu DC. Emotional larybgeal wheezing: a new syndrome. Am Rev Respir Dis 1983; 127:354-6.
17.Remirez RJ, Leon I, Rivera IM. Episodic laryngeal dyskinesia; clinical and psychiatric characterization. Chest 1986; 90:716-21.
18.Patterson DL, O'Connell EJ. Vocal dysfunction: What have we learned in 150 years? Insights in Allergy, Mosby-Year Book, Inc 1994; 9:6-12.
19.Guss J, Mirza N. Methacholine challenge testing in the diagnosis of paradoxical vocal fold motion. Laryngoscope 2006; 116:1558–1561.
20.Christensen PM, Rasmussen N. Eucapnic voluntary hyperventilation in diagnosing exercise-induced laryngeal obstructions. Eur Arch Otorhinolaryngol 2013; 270:3107–3113.
21.Turmel J, Gagnon S, Bernier M, Boulet LP. Eucapnic voluntary hyperpnoea and exercise-induced vocal cord dysfunction. BMJ Open Sport Exerc Med 2015; 1(1):e000065.
22.Hira HS, Singh A. Significance of upper airway influence among patients of vocal cord dysfunction for its diagnosis: role of impulse oscillometry. Lung India 2009; 26:5–8
23.Komarow HD, Young M, Nelson C, Metcalfe DD. Vocal cord dysfunction as demonstrated by impulse oscillometry. J Allergy Clin Immunol Pract 2013; 1:387-93.
24.Ludlow S, Haines J, Chalmers S, Fowler S. Inducible laryngeal obstruction. In: Jackson DJ, McDonald VM, Pavord ID, eds. Asthma (ERS Monograph). Sheffield, European Respiratory Society, 2025:389–402.
25.Gherasim A, Dao A, Bernstein JA. Confounders of severe asthma: diagnoses to consider when asthma symptoms persist despite optimal therapy. World Allergy Organ J 2018; 11(1):29.
26.Zhang J, Hasegawa I, Feller-Kopman D, Boiselle PM. 2003 AUR Memorial Award. Dynamic expiratory volumetric CT imaging of the central airways: comparison of standard-dose and low-dose techniques. Acad Radiol 2003; 10:719-24.
27.Gilkeson RC, Ciancibello LM, Hejal RB, Montenegro HD, Lange P. Tracheobronchomalacia: dynamic airway evaluation with multidetector CT. AJR Am J Roentgenol 2001; 176:205-10.
28.Dal Negro RW, Tognella S, Guerriero M, Micheletto C. Prevalence of tracheobronchomalacia and excessive dynamic airway collapse in bronchial asthma of different severity. Multidiscip Respir Med 2013; 8:32.
29.Mitropoulos A, Song WJ, Almaghlouth F, Kemp S, Polkey M, Hull JH. Detection and diagnosis of large airway collapse: a systematic review. ERJ Open Res 2021; 7:00055-2021.
30.Murgu S, Colt H. Tracheobronchomalacia and excessive dynamic airway collapse. Clin Chest Med 2013; 34:527-55.
31.Lee KS, Boiselle PM. Update on multidetector computed tomography imaging of the airways. J Thorac Imaging 2010; 25:112-24.
32.Aslam A, De Luis Cardenas J, Morrison RJ, Lagisetty KH, Litmanovich D, Sella EC, Lee E, Agarwal PP. Tracheobronchomalacia and Excessive Dynamic Airway Collapse: Current Concepts and Future Directions. Radiographics 2022; 2:1012-1027.
33.Meeker DP, Wiedemann HP. Drug-induced bronchospasm. Clin Chest Med 1990; 11:163-75.
34.Diggory P, Franks WA. Glaucoma therapy may take your breath away. Age Ageing 1997; 26:63-7.
35.Passo MS, Palmer EA, Van Buskirk EM. Plasma timolol in glaucoma patients. Ophthalmology 1984 ;91:1361-3.
36.Taylor P. — Anticholinesterase Agents. In : Hardman JG, Limbird LE, Gilman AG. The Pharmacological Basis of Therapeutics . New York: McGraw-Hill; 2001:175.
37.Bertrand P, Rouleau O, Allison D, Chastin I. Use of peak expiratrory flow rate to identify patients with increased risk of contrast medium reaction. Results of preliminary study. Invest Radiol 1988; 23:S203-5.
38.Dawson P, Pitfield J, Britton J. Contrast media and bronchospasm: A study with iopamidol. Clin Radiol 1983; 34:227-30.
39.Littner MR, Ulreich S, Putman CE, Rosenfield AT, Meadows G.
Bronchospasm during excretory urography: Lack of specificity for the methylglucamine cation. AJR 1981; 137:477-81.
40.Montgomery AB, Debs RJ, Luce JM, Corkery KJ, Turner J, Brunette EN, Lin ET, Hopewell PC.
Aerosolised pentamidine as sole therapy for Pneumocystis carinii pneumonia in patients with acquired immunodeficiency syndrome. Lancet 1987; 2:480-3.
41.Yeung ML, NG LY, Koo AW. Severe bronchospasm in an asthmatic patient following alcuronium and D-tubocurarinne. Anaesth Intensive Care 1979; 7:62-4.
42.Beemer GH, Dennis WL, Platt PR, Bjorksten AR, Carr AB.
Adverse reactions to atracurium and alcuronium. Br J Anaesth 1988; 61:680-4.
43.Siler JN, Mager JG, Melville Q, Wyche MQ Jr. Atracurium: hypotension, tachycardia, and bronchospasm. Anesthesiology 1985; 62:645-6.
44.O'Callaghan AC, Scadding G, Watkins J. Bronchospasm following the use of vecuronium. Anesthesia 1986; 41:940-2.
45.Buckland RW, Avery AF. Histamine release followion pancuronium: a case report. Br J Anaesth 1973; 45:518-21.
46.Heath ML. Bronchospasm in an asthmatic patient following pancuronium. Anaesthesia 1973; 28:437-40.
|