|
Asma
TIPOS DE ASMA
ASMA E REFLUXO GASTRESOFAGIANO
A coexistência entre asma e doença do refluxo gastresofágico (DRGE) é observada com uma frequência acima daquela considerada eventual. De 10–20% dos adultos, nos países ocidentais e quase 5% das pessoas na Ásia, manifestam semanalmente sintomas de DRGE.1 Três a dez por cento da população adulta mundial sofre de asma. Os sintomas e/ou diagnóstico de DRGE são mais comuns em indivíduos com asma do que na população em geral,2 mas isso pode ser em parte devido à tosse ser atribuída à asma.
O refluxo gastresofágico é uma disfunção do esôfago inferior, caracterizada por lesão da mucosa esofagiana, resultante da passagem do conteúdo gastroduodenal (ácido, pepsina, tripsina e ácidos biliares) para o esôfago, determinando esofagite. Dependendo do agente causal ocorre esofagite por refluxo ácido ou péptico e esofagite por refluxo alcalino por refluxo biliar. O discreto refluxo gastresofágico que ocorre após a alimentação deve ser considerado fisiológico, particularmente nas crianças e grávidas.
O refluxo do conteúdo gástrico ocorre na maioria dos casos em decorrência de três mecanismos:3
• relaxamento transitório do esfíncter esofágico inferior
• baixa pressão do esfíncter esofágico inferior
• hérnia de hiato por deslizamento
A região esofagogástrica apresenta várias estruturas que contribuem para a barreira antirrefluxo: o esfíncter esofágico inferior (EEI), o ângulo de His, o ligamento frenoesofágico e a roseta gástrica.
• O EEI ao nível da junção gástrica é constituído por músculo liso e ao nível do diafragma crural por músculo estriado – denominado esfíncter esofágico interno e externo no esôfago terminal – medindo no adulto de 2,5 a 3,5 cm, capaz de desenvolver alta pressão, que pode variar de 15 a 40 mmHg. O esfíncter esofagiano inferior e o diafragma crural são sobrepostos anatomicamente e firmemente ancorados pelas duas folhas do ligamento frenoesofágico.4 ]
• O ligamento frenoesofágico é constituído pela fáscia subdiafragmática e a sua função é a de impedir que o esfíncter esofágico inferior seja submetido à pressão intratorácica negativa. É essencial para a manutenção da posição oblíqua do esôfago terminal e fundo gástrico, impedindo a herniação do esôfago durante a respiração, funcionando como elemento fixador do corpo esofágico. As duas folhas são inseridas na adventícia do esôfago e no tecido conjuntivo entre os músculos longitudinais e circulares.5
• O hiato diafragmático é formado por fibras da crura direita do diafragma, por onde o esôfago penetra no abdome. Durante a inspiração, o hiato diafragmático se contrai, aumentando a pressão intraluminal, da junção esofagogástrica, impedindo o refluxo.
• O ângulo de His é formado pelo esôfago abdominal e o fundo gástrico. No adulto em situações normais este ângulo é agudo. Funciona como uma válvula. Conforme aumenta a pressão intragástrica veda a passagem de seu conteúdo para o esôfago.
• A roseta gástrica possui uma mioarquitetura exclusiva, formada pelas pregas concêntricas da mucosa gástrica, na área de transição que ajuda na contenção do conteúdo gástrico, evitando sua passagem para o esôfago. Ele se divide em dois feixes e os fascículos musculares se cruzam nas extremidades póstero-inferior e ventral-superior do hiato em forma de tesoura e circundam o esôfago.
Os primeiros relatos entre asma e refluxo ácido gastresofagiano (RAGE) datam de 1912 quando Sir William Osler6 afirmava que “ataques de asma podem ser devidos à irritação direta da mucosa brônquica ou indiretamente, também, por influências reflexas do estômago”. Em 1935, Winkelstein propôs uma nova entidade chamada esofagite péptica.7 Alguns anos mais tarde o termo esofagite de refluxo foi introduzido para indicar o mecanismo fisiopatológico.8
Várias doenças pulmonares foram relacionadas ao RAGE, dentre elas a asma, a bronquite crônica,9,10 a bronquiectasia, a pneumonia de aspiração, a atelectasia, a fibrose pulmonar idiopática,11 a laringite12,13 e a asfixia noturna na criança.14 A asma é a mais estudada, com argumentos e resultados de pesquisas mais convincentes, em animais de experimentação e em humanos. A RAGE é comum em pacientes com asma, e isto tem sido demonstrado em estudos de prevalência.
Os principais sintomas não respiratórios referidos pelos pacientes com RAGE são: a sensação de desconforto e queimação retroesternal, a pirose, a dor torácica, a regurgitação, a disfagia e mais raramente a sialorreia e a odinofagia. O refluxo com ausência de esofagite usualmente é assintomático. Outros sinais e sintomas associados ao RAGE são descritos na Tabela 1. Medicamentos como bifosfonatos ou antagonistas dos canais de cálcio podem piorar a doença de refluxo pré-existente.
Tabela 1 — Sintomas e Sinais Associados ao Refluxo Gastresofágico
Sintomas e Sinais Associados ao Refluxo Gastresofágico |
| • Gastresofágico |
queimação, azia, dor (torácica epigástrica, cervical), eructações, indigestão, náuseas, vômitos, hematêmese, odinofagia, disfagia, halitose, sialorreia |
| • Respiratório |
tosse, sibilos, dispneia, hiperventilaçao |
| • Laríngeo |
rouquidão, pigarro, alteração na voz, sensação de "nó na garganta", laringospasmo |
| • Oral/Faringe |
rouquidão matinal, sede, sialorreia ou xerostomia, boca amarga |
| • Nasal |
congestão, prurido, coriza, espirros |
| • Seios da Face |
cefaleia, secreção purulenta, pressão |
| • Ouvido |
otalgia |
| • Dental |
perda do esmalte dentário |
| • Cardiovascular |
bradicardia sinusal, aumento das respostas vasovagais, "angina" |
| • Neurológico |
posturas cervicais anormais, opistótono, apneia |
| • Psicológico |
anorexia |
O RAGE é encontrado em cerca de 10–15% da população geral, sendo que destes cerca de 10% referem-se a sintomas respiratórios15 como:
▢ Rouquidão, principalmente matinal;
▢ Pigarro frequente;
▢ Tosse crônica persistente;
▢ Sibilos à noite ou início da manhã;
▢ Hiperventilação;
▢ Laringospasmo.
A prevalência de refluxo ácido gastresofagiano na asma tem sido estimada entre 34 a 89%, enquanto que em controles oscila entre 5–19%. Em 40% dos pacientes com asma existem evidências de esofagite erosiva16 e em 58% de hérnia de hiato.17 Andze et al.18 analisaram 500 crianças com asma e detectaram o RAGE em mais de 60%, sendo que em 41% ocorria refluxo severo.
Nas últimas quatro décadas inúmeras publicações demonstraram relação entre RAGE e asma,19-23 sendo que duas publicações24,25 ressaltam esta forte combinação. Pacientes com RAGE associado à asma, ou asma desencadeada por RAGE manifestam os mesmos sintomas, porém 25–30% se apresentam com refluxo gastresofágico silencioso, ou assintomático.25 Kennedy26 em 1962 pela primeira vez relatou esta associação entre refluxo gastresofagiano silencioso e asma. Estudos em animais e humanos estabeleceram pelo menos três mecanismos que podem determinar a asma induzida pelo RAGE:
Tono vagal exacerbado, decorrente da estimulação dos receptores do esôfago inferior pelo refluxo ácido10
Intensificação da hiper-responsividade brônquica
Microaspiração de ácido, determinando broncoconstrição e edema da mucosa27,28
A broncoconstrição mediada pelo vago foi primeiro demonstrada por Mansfield e Stein10 em modelo animal utilizando o cão, quando evidenciaram aumento da resistência respiratória após infusão de ácido no esôfago. Este reflexo esofagobrônquico mediado pelo vago não é encontrado em indivíduos normais, não sendo portanto fisiológico, havendo necessidade de prévia hiper-responsividade brônquica. Em outro estudo Wright et al.29 estudando 136 pacientes obtiveram redução significante do fluxo aéreo e saturação arterial de oxigênio após infusão de ácido no esôfago inferior, sendo que a utilização prévia de atropina impedia estas alterações.
O segundo mecanismo decorre da hiper-responsividade brônquica não específica à provocação pela metacolina, histamina ou hiperventilação isocápnica30,31 que se encontra exacerbada em pacientes com RAGE, como Pomari et al.32 puderam evidenciar. Em outra publicação Hervé et al.30 demonstraram que a estimulação ácida esofagiana é capaz de agravar a asma por aumento da responsividade broncomotora a outro estímulo, por interação dos receptores esofagianos ácido-sensíveis com o tono colinérgico brônquico através de um reflexo mediado pelo vago.
O terceiro mecanismo é decorrente da microaspiração de conteúdo gástrico por “incontinência” do esfíncter esofagiano inferior. A acidificação traqueal é um potente estímulo broncoconstritor como pôde ser demonstrado por vários autores como Chernow et al.33 e Tuchman et al.34 A microaspiração pode ser evidenciada em 63% dos pacientes com RAGE e asma, através de técnicas com radioisótopos utilizando Tc 99.35 Jack et al.36 estudaram quatro pacientes asmáticos com refluxo gastresofagiano comprovado e com queda do PFE noturno no qual efetuaram medidas simultâneas, por um período de 24 horas, do pH esofagiano e pH traqueal. Esta técnica permitiu quantificar o número e a duração dos episódios de microaspiração, quando eram efetuadas, em paralelo, medidas do PFE. Puderam, então, evidenciar estreita relação entre a significante queda do PFE e o baixo pH traqueal, indicando microaspiração.
A inflamação neurogênica parece contribuir para a broncoconstrição ácido-induzida. Estudos morfométricos identificaram uma conexão entre o esôfago e o pulmão com neurônios contendo óxido nítrico. Em modelos animais, a estimulação do nervo aferente esofagiano resulta em liberação de taquicininas (substância P e neurocinina-A) nos pulmões.37 A aspiração pode danificar o epitélio brônquico, resultando na liberação de citocinas e moléculas de adesão determinando inflamação neurogênica e iniciação de outras vias inflamatórias.38 Estes mecanismos são dependentes da ativação de nervos sensoriais capsaicin-sensitivos, com subsequente liberação de taquicininas que, em conjunção com cininas, óxido nítrico, radicais livres e proteases modulam diversos aspectos da inflamação das vias aéreas.39
Em pacientes com refluxo severo associado à esofagite ocorre estreita relação na variação da resistência pulmonar e simultânea monitorização do pH esofagiano. A utilização deste teste evidencia aumento de 4-5 vezes na resistência, quando comparado aos valores basais, antes que o refluxo seja desencadeado.40
A asma por si só pode desencadear um refluxo transitório ou agravar um refluxo preexistente pelo aumento do gradiente de pressão entre o tórax e o abdome,41 ou pela utilização de broncodilatadores beta-agonistas que podem determinar relaxamento do esfíncter gastresofagiano e atuam também na redução da amplitude de contração da musculatura lisa do corpo do esôfago, sendo dose dependente.42 A retificação dos diafragmas devido ao air trapping pode modificar o ângulo de His, de agudo para obtuso, determinando tração do esfíncter esofagiano inferior, com perda de sua competência propiciando o refluxo.43,44
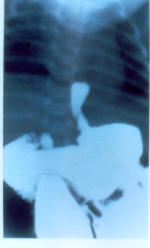 Em pacientes com esfíncter inferior com baixa tonicidade, associado ou não à presença de hérnia de hiato, pode ocorrer asma noturna devido ao decúbito supino, que favorece o refluxo, a esofagite e a microaspiração, salientando-se que a secreção ácida gástrica está aumentada durante o período noturno.45 Em pacientes com esfíncter inferior com baixa tonicidade, associado ou não à presença de hérnia de hiato, pode ocorrer asma noturna devido ao decúbito supino, que favorece o refluxo, a esofagite e a microaspiração, salientando-se que a secreção ácida gástrica está aumentada durante o período noturno.45
Gislason et al.46 revisaram uma população de 2.661 indivíduos de três países (Islândia, Bélgica e Suécia) a fim de estimar a possível associação entre sintomas de RAGE após a hora de dormir, distúrbios do sono e respiração e sono e sintomas respiratórios e asma. A asma foi relatada em 9% dos indivíduos com RAGE em comparação com 4% daqueles que não relataram RAGE (p < 0,05). Além disso, a RAGE relacionada ao sono foi associada a sibilos (odds ratio [OR] 2,5 – (IC 95% 1,6–3,9), aperto no peito relacionado ao sono [OR] 2,3 – (IC 95% 1,4–3,8), tosse durante o sono – tempo [OR] 3,0, (IC 95% 1,9–4,9) e diagnóstico de asma [OR 2,2] (IC 95% 1,0–4,7).
A relação entre RAGE e síndrome da apneia obstrutiva do sono (SAOS) deve ser ressaltada pois, tanto a apneia quanto a hipopneia podem ter atuação importantes na sintomatologia da asma, com exacerbação dos sintomas da asma ocorrendo não somente por microaspiração de ácido gástrico, mas em decorrência também do reflexo vagal deflagrado face a presença de ácido no esôfago distal. Semelson, em seu estudo, evidenciou uma prevalência de 71,4% de RAGE nos pacientes com AOS, com 10,4% destes sendo assintomáticos.47,48 Em contrapartida, os pacientes com SAOS também apresentam maior prevalência para asma brônquica.
No caso de sintomas ou suspeita clínica de RAGE, dispomos de vários procedimentos diagnósticos que possibilitam identificá-lo.49 Dentre eles citamos aqueles que demonstram que o refluxo está potencialmente presente como a seriografia esofagogastroduodenal (SEGD) capaz de evidenciar hérnia hiatal e a esofagomanometria que possibilita demonstrar diferenças de pressão que favoreçam o refluxo. Os testes capazes de demonstrar refluxo “atual” são a SEGD, a monitorização do pH esofagiano (pHmetria), a impedanciometria intraluminal, a cintilografia esofagiana noturna seguida de cintilografia pulmonar matinal e a ultrassonografia. Temos ainda o grupo de exames que fornece informações sobre os efeitos do refluxo dentre eles: a endoscopia digestiva alta com biópsia e o teste de Bernstein (instilação de 0,1 N HCl diretamente no esôfago, sendo considerado positivo quando determina dor, ardência retroesternal e broncospasmo em dez minutos pós-instilação). O monitoramento ambulatorial de impedância-pH enquanto o paciente está tomando um inibidor da bomba de prótons pode identificar o pequeno grupo de pacientes cujos sintomas são decorrentes de refluxo contínuo de ácido ou suco gástrico fracamente ácido contendo ácidos biliares.3
A medida do pH esofagiano é considerada o teste "gold standard" para a identificação de RAGE. Embora apresente sensibilidade e especificidade de aproximadamente 90% não é considerado um teste perfeito.50 O refluxo ácido esofagiano varia dia a dia com a atividade e com a dieta. Para tentar abolir os efeitos da interferência e desconforto causados pelo cateter nasal, que também interfere nas atividades normais do indivíduo testado, já se dispõe de uma alternativa que constitui-se na avaliação da pHmetria sem o cabo intranasal. Esta nova técnica (wireless) é efetuada por telemetria, permitindo análises por períodos mais longos (>48 h), através de uma cápsula posicionada transoral via endoscopia, seis centímetros acima da junção esofagogástrica.51 O sinal transmitido pela cápsula é recebido e gravado por um pequeno pager, sendo que os dados de pH registrados são posteriormente enviados para um computador para análise.
➭ Poucos dados estão disponíveis para crianças com sintomas de asma e sintomas de DRGE.52,53
IMPORTANTE: –
Para pacientes portadores de asma e que apresentem sintomas indicativos de refluxo, a realização de um ensaio empírico com medicamentos antirrefluxo, como os inibidores de bomba de prótons, pode ser considerada, de maneira análoga ao tratamento aplicado à população em geral. A supressão ácida empírica com um inibidor da bomba de prótons (IBP) tem sensibilidade razoável de 71–78 %, mas baixa especificidade de 41–54%.54 Algumas evidências sugerem que, uma vez que os pacientes desenvolvem a doença, a gravidade é determinada precocemente e os pacientes parecem continuar com esse fenótipo a longo prazo. Infelizmente, a maioria dos pacientes não responde aos conselhos sobre estilo de vida e requer terapia adicional. A maioria dos pacientes precisa de tratamento de longo prazo porque a doença geralmente recai.
  Tratamento da Asma :: Tratamento da Asma ::    Situações Específicas - Situações Específicas -    Asma e Refluxo Gastresofagiano Asma e Refluxo Gastresofagiano
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
Referências
01.Dent J, El-Serag HB, Wallander MA, Johansson S. Epidemiology of gastrooesophageal reflux disease: a systematic review. Gut 2005; 54:710–717.
02.Boulet LP. Influence of comorbid conditions on asthma. Eur Respir J 2009; 33:897-906.
03.Mittal R, Vaezi MF. Esophageal motility disorders and gastroesophageal reflux disease. N Engl J Med 2020; 383:1961-1972.
04.Mittal RK, Zifan A, Kumar D, Ledgerwood-Lee M, Ruppert E, Ghahremani G. Functional morphology of the lower esophageal sphincter and crural diaphragm determined by three-dimensional high-resolution esophago-gastric junction pressure profile and CT imaging. Am J Physiol Gastrointest Liver Physiol 2017; 313:G212-G219.
05.Kwok H, Marriz Y, Al-Ali S, Windsor JA. Phrenoesophageal ligament re-visited. Clin Anat 1999; 12:164-170.
06.Osler WB. - The principles and practice of medicine . 8nd edn. New York: D. Appletron; 1912.
07.Winkelstein A. Peptic esophagitis: a new clinical entity. JAMA 1935; 104:906-9.
08.Allison PR. Peptic ulcer of the esophagus. J Thorac Surg 1946;15:308-17.
09.Danus O, Casar L, Latrain A, Pope CE. Esopageal reflux and unrecognized cause of recurrent obstructive bronchitis in children. J Pediatr 1976; 89:220-4.
10.Mansfield LE, Stein MR. Gastroesophageal reflux and asthma: a possible reflex mechanism. Ann Allergy 1978; 41:224-6.
11.Moran TJ. Experimental aspiration pneumonia: IV. Inflammatory and reparative changes produced by intratracheal injections of autologous gastric juice and hydrochloric acid. Arch Pathol 1965; 60:122-9.
12.Kambic V, Radsel Z. Acid posterior laryngitis aetiology, histology diagnosis and treatment. J Laryngol Otol 1984; 98:1237-40.
13.Hanson DG, Kamel PL, Kahrilas PJ. Outcomes of anti-reflux therapy in the treatment of chronic laryngitis. Ann Otol Rhinol Laryngol 1995; 104:550-5.
14.Herbst JJ, Book LS, Bry PF. Gastroesophageal reflux in the “near miss” sudden infant death syndrome. J Pediatr 1978; 92:73-5.
15.Davis MV. Relationship between pulmonary disease, hiatal hernia, and gastroesophageal reflux. NY State J Med 1972; 72:935-8.
16.Sontag SJ, O'Connell S, Khandelwal S. Most asthmatics have gastroesophageal reflux with or without bronchodilator therapy. Gastroenterology 1990; 99:613-20.
17.Sontag SJ, Schnell TG, Miller TQ, et al. Prevalence of esophagitis in asthmatics. Gut 1992; 33:872-6.
18.Andze GO, Brandt ML, St Vil D, Bensoussan AL, Blanchard H. Diagnosis and treatment of gastroesophageal reflux in 500 children with respiratory symptoms: the value of pH monitoring. J Pediatr Surg 1991; 26:295-9.
19.Richter JE, Castell DO. Gastroesophageal reflux pathogenesis, diagnosis and therapy. Ann Intern Med 1982; 97:93-103.
20.Deschner WK, Benjamin SB. Extraesophageal manifestations of gastroesophageal reflux disease. Am J Gastroenterol 1989; 84:1-5.
21.A Gallup survey on heartburn across America. The Gallup Organization, Princeton NJ, 1988.
22.Nabel OY, Fornes MF, Castell DO. Symptomatic gastroesophageal reflux: incidence and precipitating factors. Dig Dis Sci 1976; 21:953-6.
23.Harding SM, Richter JE. Gastroesophageal reflux disease and asthma. Semin Gastrointest Dis 1992; 3:139-50.
24.Kiljander TO, Laitinen JO, The prevalence of gastroesophageal reflux disease in adult asthmatics. Chest 2004; 126:1490-4.
25.Simpson WG. Gastroesophageal reflux disease and asthma: diagnosis and management. Arch Intern Med 1995; 155:798-803.
26.Kennedy JH. Silent gastroesophageal reflux: an important but little known course of pulmonary complications. Dis Chest 1962; 42:42-5.
27.Holmes PW, Campbell AM, Barter CE, et al. Changes of lung volumes and lung mechanics in asthma and normal subjects. Thorax 1978; 33:394-400.
28.Moote DW, Lloyd DA, McCourtie DR, et al. Increase in gastroesophageal reflux during methacholine-induced bronchospasm. J Allergy Clin Immunol 1986; 78:619-23.
29.Wright RA, Miller SA, Corsello BF. Acid-induced esophagobronchial cardiac reflexes in humans. Gastroenterology 1990; 99:71-3.
30.Hervé P, Denjean A, Jian R, Simonneau G, Duroux P. Intraesophageal perfusion of acid increases the bronchomotor reponse to methacholine and to isocapnic hyperventilation in asthmatic subjects. Am Rev Respir Dis 1986; 134:986-9.
31.Ekström T, Tibbling L. Esophageal acid perfusion, airway function and symptom in asthmatic patients with marked bronchial hyperreactivity. Chest 1989; 96:995-8.
32.Pomari GC, Micheletto C, Turco P, Dal Negro RW, et al. Acid drink enhances methacholine responses in GER only in subjects showing hypoxic response to ultrasonically nebulized distilled water. Eur Respir J 1995; 10:66s.
33.Chernow B, Johnson LF, Janowitz WR, et al. Pulmonary aspiration as a consequence of gastroesophageal reflux: a diagnostic approach. Dig Dis Sci 1979; 24:839-44.
34.Tuchman DN, Boyle JT, Pack AI, Scwartz J, Kokonos M, Spitzer AR, Cohen S.
Comparison of airways rsponses following tracheal or esophageal acidification in the cat. Gastroenterology 1984; 87:872-81.
35.Ghaed N, Stein MR. Assessment of a technique for scintigraphic monitoring of pulmonary aspiration of gastric contents in asthmatics with gastrooesophageal reflux. Ann Allergy 1979; 42:306-8
36.Jack CIA, Calverley PMA, Donnelly RJ, Tran J, Russel G, Hind CRK, Evans CC. Simultaneous tracheal and oesophageal pH measurements in asthmatic patients with gastro-oesophageal reflux. Thorax 1995; 50:201-4.
37.Harding SM. Recent clinical investigations of asthma and gastroesophageal reflux. Am J Med 2003; 115(suppl)3A:39S-44S.
38.Stein MR. Advances in the approach to gastroesophageal reflux (GER) and asthma. J Asthma 1999; 36:309-14.
39.Ricciardolo FL, Gaston B, Hunt J. Acid stress in the pathology of asthma. J Allergy Clin Immunol 2004; 113:610-9.
40.Visconti A, Cuttitta G, Insalaco G, Peralta G, Catania G, Trizzino A, Bonsignore G. Gastroesophageal reflux and nocturnal bronchoconstriction, In: Oliveri D, Bianco S (eds) Airway Obstruction and Inflammation. Progress Respir Res , vol 24, Karger, Basel, 1990.
41.Harding SM, Richter JE. The role of gastroesophageal reflux in chronic cough and asthma. Chest 1997; 111:1389-402.
42.Crowell MD, Zayat EN, Lacy BE, Schetter-Duncan A, Liu MC. The effects of an inhaled ß2-adrenergic agonist on lower esophageal function. A dose-response study. Chest 2001; 120:1184-9.
43.Pope CE. Acid reflux disorders. N Engl J Med 1994; 331:656-60.
44.Bechard DE, Schubert ML. Gastroesophageal reflux-induced asthma: new insights. Gastroenterology 1998; 114:849-50.
45.Moore JG, Wolfe M. The relation of plasma gastrin to the circadian rhythm of gastric acid secretion in man. Digestion 1973; 9:97-105.
46.Gislason T, Janson C, Vermeire P, Plaschke P, Björnsson E, Gislason D, Boman G. Respiratory symptoms and nocturnal gastroesophageal reflux: a population-based study of young adults in three European countries. Chest. 2002;121(1):158-163.
47.Samelson CF. Gastroesophageal reflux and obstructive sleep apnea. Sleep 1989; 12:475-6.
48.Pacheco FA, Togeiro, SMGP. - Sono na Asma, Doença Pulmonar Obstrutiva Crônica e Fibrose Pulmonar. In: Sônia Maria Guimaraes P. Togeiro, Pedro Rodrigues Genta, Geraldo Lorenzi Filho. Sono. São Paulo;2018:163-174.
49.Allegra L. Bronchial asthma and GER. In: Dal Negro RW, Allegra L (eds) Pneumological aspects of gastroesophageal reflux. Milano: Springer;1999.
50.Kahrilas PJ, Quigley EM. Clinical esophageal pH recording: a technical review for practice guideline development. Gastroenterology 1996; 110:1982-96.
51.Pandolfino JE, Richter JE, Ours T, Guardino JM, Chapman J, Kahrilas PJ.
Ambulatory esophageal pH monitoring using a wireless system. Am J Gastrenterol 2003; 98:740-9.
52.Sopo SM, Radzik D, Calvani M. Does treatment with proton pump inhibitors for gastroesophageal reflux disease (GERD) improve asthma symptoms in children with asthma and GERD? A systematic review. J Investig Allergol Clin Immunol 2009; 19:1-5.
53.Writing Committee for the American Lung Association Asthma Clinical Research Centers; Holbrook JT, Wise RA, Gold BD, Blake K, Brown ED, Castro M, Dozor AJ, Lima JJ, Mastronarde JG, Sockrider MM, Teague WG. Lansoprazole for children with poorly controlled asthma: a randomized controlled trial. JAMA 2012; 307:373-81.
54.Numans ME, Lau J, de Wit NJ, Bonis PA. Short-term treatment with proton-pump inhibitors as a test for gastroesophageal reflux disease: a meta-analysis of diagnostic test characteristics. Ann Intern Med 2004; 140:518-27.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|