|
Asma
MASTÓCITOS
Os mastócitos são células-chave na resposta inflamatória e broncoconstrição, notadamente nos pacientes asmáticos com inflamação do tipo 2 (Th2 alta).
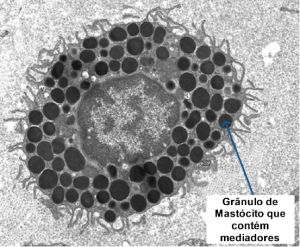
Os mastócitos (MCs) foram descritos pela primeira vez em 1878 por Paul Ehrlich.1 São células imunes multifuncionais, de vida longa, originam-se na medula óssea, pertencem à linhagem mieloide, derivadas de progenitores hematopoiéticos CD34+ que migram da medula óssea para o sangue e completam sua diferenciação em quase todos os tecidos.2 (Figura 1) Pelo menos dois estudos revelaram que o número de células CD34+ está elevado nas vias aéreas de indivíduos com asma.3,4 Os MCs expressam exclusivamente o receptor de superficie celular do fator de células-tronco (SCF) também conhecido como Kit ou CD117.5 O SCF desempenha papel determinante na diferenciação, proliferação e modulação de MCs.6 Os progenitores em seguida migram do sangue para os vários tecidos como pele, pulmões, interfaces mucosas, onde adquirem seus fenótipos específicos teciduais.7 Expressam em sua superfície uma variedade de moléculas de adesão, promovem sua fixação às outras células, incluindo em particular as células endoteliais. Migram para os tecidos sob influência de citocinas, onde sofrem processo de maturação até adquirirem seu fenótipo final, de acordo com o microambiente. Os mastócitos são células mulifuncionais imunes que residem em quase todos os tecidos expostos ao ambiente externo ou próximo a vasos sanguíneos e linfáticos. Por expressarem uma variedade de receptores (como Toll-like, de citocinas, e para antígenos via IgE-FcεRI, são capazes de detectar patógenos, alérgenos, danos teciduais e sinais inflamatórios, desempenhando papel essencial no desencadeamento de respostas imunológicas rápidas.8-10 (Figura 1)
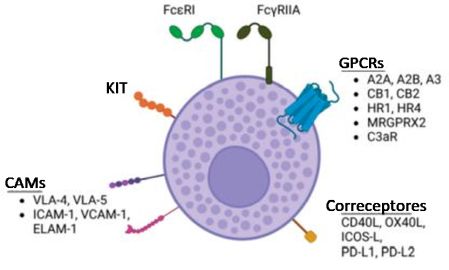
Os MCs possuem um arsenal de receptores de superfície que definem como eles são ativados e como interagem com o ambiente. Podem ser estimulados à liberação de mediadores ou à degranulação total através de:11
● |
Receptores de Imunoglobulinas: como o FcεRI (alta afinidade para IgE) e o FcγRIIA. |
● |
Receptor Kit: liga-se ao Fator de células-tronco (KIT/SCF). |
● |
Receptores Acoplados à Proteína G (GPCRs): incluindo receptores de adenosina (A2A, A2B, A3), receptores canabinoides (CB1, CB2), receptores de histamina, (H1R, H4R), o MRGPRX2 e o receptor do complemento C3aR. |
Além disso, os MCs utilizam moléculas de adesão celular (CAMs) e correceptores para se ligar a outras células, tecidos e superfícies, permitindo sua localização estratégica e interações funcionais.
A primeira classificação elaborada de MCs em subtipos foi realizada originalmente em roedores,12,13 baseada na caracterízação pela coloração e na localização anatômica, quando os MCs de roedores foram divididos em MCs de tecido conjuntivo e MCs de mucosa.
Na asma se identificam dois fenótipos de MCs em função de sua localização e no tipo de proteases que contêm e liberam. MCs de mucosa que contêm principalmente triptase MC(T), sendo o tipo dominante na asma, mais abundantes na mucosa das vias aéreas e MCs com triptase e quimase M(TC), mais encontrados no tecido conjuntivo. No paciente asmático além do aumento significativo da migração e acúmulo de MCs intraepiteliais estudos sugerem um padrão enzimático mais 'pró-inflamatório' diferente daqueles em indivíduos sadios.14
Existem ainda os MCs alveolares que representam um número substancialmente menor do que aquele encontrado na mucosa brônquica.
A função fisiológica dos MCs alveolares ainda não está totalmente esclarecida.15 Entretanto, sua função fisiológica pode estar relacionada diretamente à detecção rápida de ameaças, iniciando a cascata inflamatória protetora que recruta outras células do sistema imune. Quando de lavado broncoalveolar os MCs representam percetual muito pequeno, oscilando em 1–2% das células alveolares. Achado importante em análise tecidual foi detectado por Andersson et al.16 que tanto para o MC(TC) quanto para o MC(T), o receptor de alta afinidade para a IgE (FcεRI) foi altamente expresso nas vias aéreas, no entanto, se encontrava praticamente ausente no parênquima alveolar. Posteriormente se constatou que os MCs alveolares da mesma forma podem ter participação, contribuindo para a inflamação no parênquima pulmonar periférico, bem como para o remodelamento notadamente em casos de asma grave. Estudos identificaram mudanças significativas nos MCs alveolares em casos de asma alérgica.17 Em pacientes com asma atópica mal controlada não tratados com corticoides inalatórios, observou-se que os mastócitos MCT e MCTC, normalmente com baixa expressão de FcεRI, se expandem nos pulmões e passam a expressar esse receptor.
O SCF desempenha importante papel na diferenciação, proliferação e modulação de MCs humanos.6 Os MCs humanos respondem a ampla profusão de estímulos, incluindo fatores de crescimento, citocinas, nucleotídeos, complemento, lipídios, proteases, produtos de infecção (MCs humanos expressam todos os receptores TLR), poluentes, agentes ocupacionais, estímulos físicos, fármacos e sinalização célula a célula.18 Entretanto, durante décadas a investigação da sinalização dos MCs concentrou-se na ativação IgE dependente por alérgenos, através do receptor IgE de alta afinidade FceRI.
A maioria dos MCs nas vias aéreas de pacientes com asma está localizada abaixo do epitélio brônquico, mas um número considerável de células é encontrado inserido entre as células epiteliais e adjacente à superfície brônquica. Estas células em função de sua localização entrariam em contato imediato com os antígenos inalados, apresentando grande importância na modulação das fases iniciais da resposta alérgica.19
Nos pulmões, a reação antígeno induzida determina a liberação de  mediadores de um pequeno número de mastócitos localizados na luz brônquica, o que pode determinar aumento da permeabilidade local e aumentar a exposição antigênica aos mastócitos de localização mais profunda, como os da submucosa, os das glândulas mucosas e do músculo liso. Na mucosa das vias aéreas existem cerca de 20.000 mastócitos por mm3.20,21 mediadores de um pequeno número de mastócitos localizados na luz brônquica, o que pode determinar aumento da permeabilidade local e aumentar a exposição antigênica aos mastócitos de localização mais profunda, como os da submucosa, os das glândulas mucosas e do músculo liso. Na mucosa das vias aéreas existem cerca de 20.000 mastócitos por mm3.20,21
Os MCs produzem uma ampla gama de mediadores, incluindo monoaminas (histamina), serglicina, proteoglicanos (no mastócito humano a heparina representa mais de 75% do total, sendo o restante composto por mistura de condroitina sulfatos), proteases (principalmente quimase e triptase) e mediadores lipídicos fator de ativação plaquetária (PAF), leucotrienos e prostaglandinas (PGs).22
O MC é um componente essencial da imunidade inata e pode servir para amplificar a imunidade adaptativa. Os MCs podem responder a patógenos, como bactérias e vírus, por meio de múltiplos receptores do tipo Toll expressos em sua superfície celular.
A ativação dos MCs acarreta hipersensibilidade imediata e inflamação alérgica tardia. Deve ser ressaltado que mesmo um nível muito baixo de alérgenos é suficiente para desencadear a desgranulação que ocorre durante reação alérgica imediata, minutos após a exposição ao alérgeno, com liberação de histamina, produzindo contração da musculatura lisa das vias aéreas e hipersecreção de muco. A segunda fase de ativação do MC, que acontece cerca de 20 a 40 minutos após a exposição ao alérgeno, é caracterizada pela liberação de uma série de mediadores pré-formados e recém-formados.23
Receptor para IgE – Receptor de Alta Afinidade FcεRI
 O MC pode ser considerado como uma célula primária participante de reação alérgica precoce assim como de inflamação alérgica crônica. O MC pode ser considerado como uma célula primária participante de reação alérgica precoce assim como de inflamação alérgica crônica.
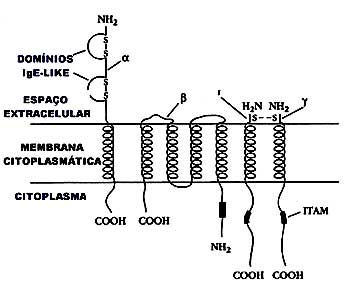
Possuem em sua superfície 10.000 – 100.000 receptores para a fração Fc da IgE.24 A IgE está fixada à membrana de MCs teciduais e basófilos circulantes,25,26 por um receptor tetrâmero de alta afinidade FcεRI (kD = 1-2 X 10-9 M) (Figura 3).
A cadeia β com 263 aminoácidos transpõe a membrana celular quatro vezes e as duas cadeias γ com 86 aminoácidos se prolongam a considerável distância no citoplasma. O receptor FcεRI interage com os domínios CH3/CH3 e CH4/CH4 da molécula de IgE via dois domínios immunoglobulin-like da cadeia alfa. O FcεRI envolve um simples domínio Cε3, fazendo contato em ambos os lados ou interage com faces opostas do domínio Cε3 de um lado da IgE. As cadeias β e γ estão envolvidas na transmissão de sinais que partem da superfície da célula, ocorrendo uma série de eventos na membrana e citoplasma (transdução de sinal, tradução e amplificação de sinal e ativação de proteínas alvos/efetoras) do mastócito, utilizando Ca2+ e mecanismos energia dependente. As cadeias β e γ possuem em seu domínio citoplasmático dois resíduos de tirosina ITAM. Os receptores na fisiologia celular do MC cumprem um papel relevante, podendo atuar na sua ativação, maturação e proliferação.26 Nos últimos anos, avançou-se significativamente na compreensão da síntese de IgE e dos mecanismos de sinalização do FceRI envolvidos na ativação dos mastócitos mediada por IgE.
Ativação, Degranulação, Exocitose e Apoptose dos Mastócitos
.
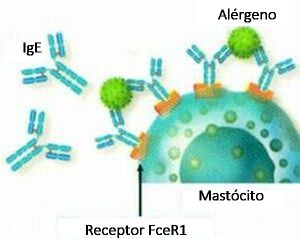
A ligação cruzada de duas moléculas ou mais de IgE adjacentes por um alérgeno (Figura 4) faz com que seus receptores de alta afinidade FceRI da superfície da membrana celular sejam justapostos, resultando na secreção de substâncias (mediadores pré-formados e na síntese de novo de mediadores recém-gerados) que podem ter ações efetoras, imunorreguladoras ou autócrinas.
A interação entre o complexo alérgeno-IgE e o receptor FcεRI na superfície dos MCs desencadeia a desgranulação dos MCs e a liberação de histamina, citocinas/quimiocinas, enzimas como triptase e quimase, e a geração de eicosanoides (ou seja, LTC4 e PGD2) e fatores de crescimento que contribuem para o acúmulo de células imunes e remodelação na asma.27,28
Após a ligação cruzada de IgE, os MCs liberam uma variedade de mediadores que impulsionam a inflamação ao ativar outras células. Os MCs contribuem para os sintomas de asma ao desencadear broncoconstrição e alterar a permeabilidade da barreira epitelial das vias aéreas. Eles também recrutam outras células imunes e promovem sua proliferação e ativação.
Os MCs não ativados apresentam mais de 1.000 grânulos secretórios que contêm um complexo de natureza cristalina, constituído pelos mediadores inflamatórios pré-formados, ionicamente ligados à matriz dos proteoglicanos. Quando os MCs são ativados, os grânulos se expandem, perdem a característica cristalina quando o complexo se solubiliza, movem-se para a periferia da célula junto à membrana plasmática, onde ocorre a fusão, e os mediadores são expostos ao ambiente extracelular, através do processo de exocitose.
Estudos de microscopia de alta resolução mostraram que a exocitose induzida por IgE/FcεRI pode ocorrer por três modalidades diferentes:29
1. Kiss-and-run – quando ocorre a liberação rápida e parcial do conteúdo do grânulo secretor através de um poro de fusão transitório e reversível, preservando-se o grânulo; permite secreção finamente modulada e reaproveitamento do grânulo; envolve proteínas reguladoras de Ca 2+ e Rab3D.
2. Exocitose completa (full fusion) – o grânulo se funde totalmente à membrana plasmática, liberando todo o conteúdo; observado em respostas intensas e sustentadas.
3. Exocitose composta (compound exocytosis) – em vez de cada grânulo se unir separadamente à membrana plasmática — o que exigiria muito espaço e um canal amplo para liberar seu conteúdo — a exocitose composta permite que vários grânulos liberem suas substâncias por meio de um único grânulo que já está conectado ao canal de saída (lúmen); leva à liberação maciça de mediadores.30
Esse processo não é aleatório, mas sim estritamente regulado por um complexo maquinário molecular. O elemento central são as proteínas SNAREs (altamente conservadas), que são essenciais para mediar a fusão entre a membrana dos grânulos e a membrana plasmática celular. A ação das SNAREs é ajustada por diversos reguladores acessórios, incluindo proteínas como Munc13, Munc18, Rab GTPases, complexinas e sinaptotagminas. Em conjunto esses componentes controlam a liberação precisa e rápida dos mediadores inflamatórios.31
Nas últimas décadas foram efetuados avanços nos conhecimentos da maquinária da secreção e exocitose dos MCs devido ao papel central que desempenham nas reações alérgicas e na asma. Como consequência, o papel das guanosina trifosfatases (GTPases) no transporte vesicular foi revelado pela primeira vez, quando o análogo de guanosina trifosfato (GTP) resistente à hidrólise,
guanosina-5'-O-(3-tiotrifosfato)
(GTPYS), induziu exocitose quando introduzido no interior do MC.32 Trabalhos subsequentes mostraram que várias famílias de GTPase, incluindo Rabs, fatores de ribosilação de adenosina difosfato, dinamina e proteínas G triméricas, regulam aspectos distintos do transporte intercompartimental.33-35 As proteínas Rabs são pequenas proteínas de ligação ao GTP relacionadas à Ras, que se acredita atuam como reguladoras em cada etapa do tráfego da membrana intracelular. Assim, as Rab GTPases, especialmente Rab27a, Rab3d e Rab5, têm se mostrado fundamentais na orquestração da mobilização, acoplamento e fusão dos grânulos de secreção com a membrana plasmática.29,36,37 Alterações na expressão ou função dessas proteínas afetam o tipo de exocitose e, com isso, a intensidade da liberação de mediadores alérgicos como histamina, triptase, prostaglandinas e leucotrienos — diretamente implicados na asma.
As proteínas SNARE (Soluble NSF Attachment Protein Receptor) — como VAMP8, syntaxin-4, SNAP-23 — são agora reconhecidas como os principais determinantes do tipo de fusão.38-40
A inibição seletiva de SNAREs pode redirecionar o tipo de exocitose (por exemplo, de completa para kiss-and-run), o que tem sido explorado como alvo terapêutico experimental para limitar a liberação de mediadores inflamatórios na asma.
Em algumas formas de asma grave, há evidências de que a exocitose composta esteja aumentada, contribuindo para uma liberação massiva de mediadores.
O modelo das três vias ainda é útil, especialmente para fins didáticos e descritivos. Mas hoje sabemos que:
● Há regulação fina por proteínas específicas (Rabs, SNAREs, Munc13-4 etc.),
● A escolha da via de exocitose é dinâmica e influenciável por sinalização celular, fosforilação de proteínas, cálcio intracelular e citocinas,
● Isso abre caminho para novos tratamentos para doenças alérgicas como a asma.
Em síntese hoje se reconhece que a exocitose mastocitária é um processo modular e heterogêneo, que varia kiss-and-run, fusão composta e (pouco a pouco), determinado pelo estímulo, contexto tecidual e perfil de sinalização intracelular.
Assim:
■ FcεRI (IgE dependente tendem à exocitose composta)
■ Estímulos via TLRs, IL-33 ou neuropeptídeos favorecem piecemeal e kiss-and-run
■ O microambiente (hipóxia, IL-10, IL-4, etc.) modula o tipo predominante de fusão.
Estudos recentes ampliaram os estudos mostrando que a exocitose mastocitária é mais plástica e dinâmica. Isto significa que existem formas intermediárias e fusões parciais prolongadas ( Kiss-and-stay), o que permite a liberação seletiva de mediadores (p.ex. citocinas, prostaglandinas sem histamina). Outra concepção seria a secreção seletiva sem que haja desgranulação maciça ( piecemeal degranulation). Compreende tráfego vesicular dirigido de mediadores específicos (tal como TNF, IL-4, VEGF), sem rompimento dos grânulos principais, ocorrendo em particular nas inflamações crônicas (asma, dermatite atópica).
O mediador mais conhecido dos mastócitos é a histamina, que se encontra presente nos grânulos em concentrações de 100 nmol/l, equivalente a 1–4 pg por célula, dependendo do número de grânulos presentes. A histamina participa na reação alérgica imediata, desenvolvendo vasodilatação com aumento da permeabilidade vascular, contração do músculo liso brônquico e intestinal, e aumento da secreção de muco. Sua ação é curta, pois a histamina é rapidamente metabolizada em 1–2 minutos, sendo 70% metabolizados pela histamina N-metiltransferase e 30% pela diamina oxidase (histaminase). Os efeitos da histamina dependem do tipo de receptor encontrado nos tecidos: H1 – contração do músculo liso, H2 – dilatação dos vasos sanguíneos, H3 – inibição da liberação da noradrenalina e H4 – pode estar envolvido na patogênese da alergia e inflamação, ativando as células Th2 e Th17.41
Credita-se aos MCs papel relevante na orquestração das respostas inflamatórias alérgicas pois, os MCs tanto em roedores como em humanos expressam moléculas do complexo principal de histocompatibilidade (MHC),42-44 podendo ter participação na apresentação de antígenos às células T secretando IL-4 e IL-13, podem manifestar potencial influência na produção de IgE pelos linfócitos B;45,46 e são também capazes de regular a diferenciação celular Th2.47,48 Os MCs podem causar mudanças estruturais via produção de laminina, colágeno IV e ativação de fibroblastos.
Ativação de Mastócitos Independente de IgE
Os mastócitos possuem uma via alternativa de ativação que não depende do mecanismo clássico de IgE e alérgenos (hipersensibilidade Tipo I). Esta via é mediada em humanos via receptor X2 acoplado à proteína G (GPCR) relacionada ao Mas (MRGPRX2) e Mrgprb2 em murinos. O MRGPRX2 permite a rápida desgranulação e liberação de mediadores de MCs em resposta a diversos estímulos (não IgE), explicando as chamadas pseudoalergias.49 A relevância desse receptor é destacada em doeças inflamatórias como na asma fatal, onde se detecta expressão elevada de MRGPRX2 nos MCs pulmonares de pacientes, sugerindo que essa via de ativação alternativa pode contribuir na gravidade da doença.50
.Os MCs não reagem de forma uniforme. Eles conseguem decodificar diferentes estímulos de ativação em padrões de secreção de grânulos distintos (diferentes em forma, tamanho e tempo de liberação). Sinais não IgE como Substância P, C3a, C5a e Endotelina 1 têm um padrão de seceção rápido e preciso, com liberação imediata de grânulos pequenos e esféricos (secreção individual). Por outro lado, um estímulo de ativação por alérgenos, anti-IgE, apresenta padrão de secreção comparativamente lento e sustentado com características fisiológicas de maior retardo entre o sinal e a secreção, associado à formação de grânulos maiores com formato heterogêneo (exteriorização prolongada). Ou seja, a dinâmica de desgranulação dos MCs (observada in vitro e in vivo) não é a mesma para todos os estímulos. Diferentes sinais conduzem a diferentes padrões de liberação de mediadores, o que, no entanto, está associado a distintas respostas inflamatórias e fisiopatológicas no organismo.51
A IL-33 é capaz de induzir uma ativação pleiotrópica dos MCs, desencadeando não apenas a liberação de mediadores pré-formados (desgranulação),52 mas também a síntese de novo de um amplo painel de citocinas e quimiocinas.53 A sua importância clínica é corroborada por vários estudos que associam a IL-33 a doenças alérgicas de difícil controle, como a asma severa54 e a polipose nasal refratária.55
| Interações dos Mastócitos comCélulas Epiteliais, Músculo Liso, |
| Glândulas Mucosas e Células Caliciformes |
Na atualidade os MCs não são vistos unicamente como células efetoras do sistema imune que residem no tecido conjuntivo e são recrutadas quando de episódios de asma. Está bem estabelecido que existe um microambiente específico de MCs residentes intraepitelial em indivíduos com asma especialmente nas suas formas mais severas. Esses MCs interagem de modo direto com as células epiteliais, criando um ciclo de inflamação e disfunção epitelial. Deve ser destacado que em indivíduos saudáveis os MCs estão praticamente ausentes no epitélio. Isto implica reiterar que sua localização intraepitelial os posiciona em contato direto com o ambiente externo (alérgenos, microrganismos, poluentes atmosféricos, inalantes), atuando como sensores e efetores de linha de frente. Assim os MCs que causam o broncospasmo imediato são os residentes da submucosa. Eles não migram naquele momento, eles desgranulam onde já se situam (localização próxima ao músculo liso). A migração para o epitélio (infiltração intraepitelial é um fenômeno crônico que leva a aumento da população de MCs tornando a asma mais grave. Essa migração e proliferação anormais são induzidas por citocinas inflamatórias liberadas por células T auxiliares e por células epiteliais com perda da integridade (alarminas).
O epitélio medeia processos inflamatórios complexos em resposta à exposição a alérgenos ou gatilhos não alérgicos, incluindo a liberação de um trio de citocinas epiteliais, conhecidas como "alarminas".56 As alarminas IL-25, IL-33 e linfopoetina estromal tímica (TSLP) estimulam respostas inflamatórias por meio de inúmeras vias, incluindo endótipo tipo 2 (IL-4, IL-13 e IL-5) e outros, como vias conduzidas por Th1 – ou Th17 – (IL-17), resultando em vários desdobramentos fisiopatológicos que podem levar a sintomas de asma e exacerbações.56,57
Os MCs podem potencializar a resposta imune do tipo Th2 produzindo IL-25.58 Por outro lado também expressam o receptor IL-25 cuja provocação alérgica induz aumento funcionalmente relevante na expressão de IL-25 e seu receptor na mucosa brônquica asmática.59 A IL-25 se liga ao receptor heterodimérico, o IL-17RA/IL-17RB (IL-25R), o qual está presente em diversos tipos celulares, como ILC2s, células Th2 de memória ativada, células dendríticas (DCs) ativadas por TSLP, incluindo MCs, eosinófilos e células endoteliais.60-64
A IL-33 favorece a desgranulação dos MCs e a produção de quimiocinas, aumentando a magnitude da resposta individual dos mastócitos.65 IL-33 modifica o fenótipo e a infiltração de MCs.
Os receptores TSLP foram descritos em MCs66 como tembém em basófilos.67 Os MCs também demonstraram regular a expressão de TSLP,68 sugerindo que a TSLP derivada do epitélio pode afetar diretamente a função dos MCs e os MCs, por sua vez, podem regular a expressão de TSLP epitelial. Os MCs que são estimulados pela TSLP agem sinergicamente com IL-1ß e TNF-α para liberar IL-5, IL-13, IL-6, IL-8, IL-10, GM-CSF e quimiocinas CXCL8 e CCL1, enquanto suprime a liberação de TGF-ß.69
As ILC2s desempenham papel relevante no processo da asma alérgica, pois são ativadas a jusante das células epiteliais das vias aéreas. As ILC2s apresentam muitas ações análogas às células Th2, entretanto são as únicas a secretar a IL-9 capaz de promover metaplasia de células caliciformes e estimular não só o crescimento como a sobrevivência dos MCs.70
A presença de MCs nos feixes de músculo liso das vias aéreas está aumentada em asmáticos em comparação a controles.71. Ocorre correlação inversa entre o número de mastócitos no músculo liso das vias aéreas e a
concentração de estímulo de metacolina para provocar queda de 20% no VEF1(PC20). Isto em outros termos significa que maior quantidade de mastócitos no músculo liso está associada à maior hiper-responsividade brônquica (HRB),71
Outra doença pulmonar eosinofílica, a bronquite eosinofílica, apresenta inflamação na via aérea similar à da asma, incluindo a fibrose subepitelial, porém não manifesta HRB, tida como a principal característica da asma.72
Os MCs que se localizam perto das glândulas mucosas e submucosas, ao desgranularem liberam substância que atuam como secretagogos como PGD2, LTC4, IL-4 e IL-13, que a longo prazo determinam hiperplasia e metaplasia de células caliciformes e hipertrofia das glândulas submucosas que determinam aumento na produção e secreção de muco.73
➭ Os mastócitos pulmonares podem contribuir significativamente para a indução imunológica do remodelamento na asma liberando mediadores lipídicos e uma série de citocinas, além de interferir na angiogênese 74-77
A ativação de MCs pulmonares humanos libera vasto conjunto de mediadores pré-formados e recém- sintetizados, citocinas, quimiocinas, eicosanoides.74,78,79 (Tabela 1)
MEDIADORES DOS MASTÓCITOS (lista parcial) |
Categoria |
Mediador |
Tipo |
Liberação |
Monoaminas |
Histamina |
Pré-formado |
Segundos a minutos |
Proteoglicanos |
Heparina, Condroitina sulfato |
Pré-formado |
Segundos a minutos |
Proteases |
β-triptase, Quimase, Carboxipeptidase A3 |
Pré-formado |
Segundos a minutos |
Enzimas lisossômicas |
β-Hexosaminidase, β-Glucoronidase, Arilsulfatases |
Pré-formado |
Segundos a minutos |
Citocina |
TNF-α (pré-formada) |
Pré-formado |
Minutos |
Eicosanoides |
Prostaglandina D2 (PGD2) |
Neoformado |
5–30 minutos |
|
Leucotrienos C4, D4, E4 |
Neoformado |
5–30 minutos |
Citocinas / Quimiocinas |
IL-4, IL-5, IL-6, IL-8, IL-13, GM-CSF, CCL2, CCL5, CCL11 |
Neoformado |
1–6 horas |
Fatores de crescimento |
VEGF, FGF-2, TGF-β, NGF |
Neoformado |
Horas |
Outros mediadores lipídicos |
PAF |
Neoformado |
Minutos |
Referências
01.Ehrlich, P. Beitrage sur Theorie und Praxis der Histologischen Farbung. Ph.D. Thesis, University of Leipzig, Leipzig, Germany, 1878.
02.Dahlin JS, Ekoff M, Grootens J, Löf L, Amini RM, Hagberg H, Ungerstedt JS, Olsson-Strömberg U, Nilsson G. KIT signaling is dispensable for human mast cell progenitor development. Blood 2017; 130:1785-1794.
03.Allakhverdi Z, Comeau MR, Smith DE, Toy D, Endam LM, Desrosiers M, Liu YJ, Howie KJ, Denburg JA, Gauvreau GM, Delespesse G. CD34+ hemopoietic progenitor cells are potent effectors of allergic inflammation. J Allergy Clin Immunol 2009; 123:472-8.
04.Smith SG, Gugilla A, Mukherjee M, Merim K, Irshad A, Tang W, Kinoshita T, Watson B, Oliveria JP, Comeau M, O'Byrne PM, Gauvreau GM, Sehmi R. Thymic stromal lymphopoietin and IL-33 modulate migration of hematopoietic progenitor cells in patients with allergic asthma. J Allergy Clin Immunol 2015; 135:1594-602.
05.Yamamoto T, Katayama I, Nishioka K. Expression of stem cell factor in basal cell carcinoma. Br J Dermatol 1997; 137:709-13.
06.Tsai M, Valent P, Galli SJ. KIT as a master regulator of the mast cell lineage. J Allergy Clin Immunol 2022; 149:1845-1854.
07.Theohatides TC, Valent P, Akin C. Mast cells, mastocytosis, and related disorders. N Engl J Med 2015; 373:163-172.
08.Agier J, Pastwinska J, Brzezinska-Blaszczyk E. An overview of mast cell pattern recognition receptors. Inflamm Res 2018; 67:737-746.
09.Juremalm M, Nilsson G. Chemokine receptor expression by mast cells. Chem Immunol Allergy 2005; 87:130-144.
10.Lyons DO, Pullen NA. Beyond IgE: Alternative Mast Cell Activation Across Different Disease States. Int J Mol Sci 2020; 21:1498.
11.Baran J, Sobiepanek A, Mazurkiewicz-Pisarek A, Rogalska M, Gryciuk A, Kuryk L, Abraham SN, Staniszewska M. Mast Cells as a Target-A Comprehensive Review of Recent Therapeutic Approaches. Cells 2023; 12:1187.
12.Enerbäck L. Mast cells in rat gastrointestinal mucosa. I. Effects of fixation. Acta Pathol Microbiol Scand 1966; 66:289-302.
13.Irani AM, Schwartz LB. Mast cell heterogeneity. Clin Exp Allergy 1989; 19:143-55.
14.Welle M. Development, significance, and heterogeneity of mast cells with particular regard to the mast cell-specific proteases chymase and tryptase. J Leukoc Biol. 1997; 61:233-45.
15.Erjefält JS. Mast cells in human airways: the culprit? Eur Respir Rev. 2014; 23:299-307.
16.Andersson CK, Mori M, Bjermer L, Löfdahl CG, Erjefält JS. Novel site-specific mast cell subpopulations in the human lung. Thorax 2009; 64:297-305.
17.Andersson CK, Bergqvist A, Mori M, Mauad T, Bjermer L, Erjefält JS. Mast cell-associated alveolar inflammation in patients with atopic uncontrolled asthma. J Allergy Clin Immunol 2011; 127:905-12.e1-7.
18.Bradding P, Arthur G. Mast cells in asthma--state of the art. Clin Exp Allergy 2016; 46:194-263.
19.Altman MC, Lai Y, Nolin JD, Long S, Chen CC, Piliponsky AM, Altemeier WA, Larmore M, Frevert CW, Mulligan MS, Ziegler SF, Debley JS, Peters MC, Hallstrand TS. Airway epithelium-shifted mast cell infiltration regulates asthmatic inflammation via IL-33 signaling. J Clin Invest 2019; 129:4979-4991.
20.White MV, Kaliner MA. Mast cells and asthma. In :Asthma: Its Pathology and Treatment . Edited by Kaliner MA, Persson C, Barnes P, New York: Marcel Dekker; 1990-409-440.
21.Kaline MA. Pathogenesis of asthma. In: Clinical Immunology: Principles and Practice. Edited by Rich RR. St Louis: Mosby; 1996;909-923.
22.Kubo M. Innate and adaptive type 2 immunity in lung allergic inflammation. Immunol Rev 2017; 278:162-172.
23.Andersson C, Tufvesson E, Diamant Z, Bjermer L. Revisiting the role of the mast cell in asthma. Curr Opin Pulm Med 2016; 22:10-7.
24.Wasserman SI. Mast cell-mediated inflammation in asthma. Ann Allergy 1989; 636:546-50.
25.Galli SJ. The Paul Kallos Memorial Lecture: the mast cell: a versatile effector cell for a challenging world. Int Arch Allergy Immunol 1997; 113:14-22.
26.Siraganian RP. Mast cell signal transduction from the high-affinity IgE receptor. Curr Opin Immunol 2003; 15:639-646.
27.Banafea GH, Bakhashab S, Alshaibi HF, Natesan Pushparaj P, Rasool M. The role of human mast cells in allergy and asthma. Bioengineered 2022; 13:7049-64.
28.Theoharides TC, Tsilioni I, Ren H. Recent advances in our understanding of mast cell activation - or should it be mast cell mediator disorders? Expert Rev Clin Immunol 2019; 15:639-56.
29.Azouz NP, Matsui T, Fukuda M, Sagi-Eisenberg R. Decoding the regulation of mast cell exocytosis by networks of Rab GTPases. J Immunol 2012; 189:2169-80.
30..Dvorak, AM. – Basophil and Mast Cell Degranulation and Recovery. Blood Cell Biochemistry. New York: Springer;1991.
31.Lorentz A, Baumann A, Vitte J, Blank U. The SNARE Machinery in Mast Cell Secretion. Front Immunol. 2012; 3:143.
32.Fernandez JM, Neher E, Gomperts BD. Capacitance measurements reveal stepwise fusion events in degranulating mast cells. Nature 1984; 312:453-5.
33.Nuoffer C, Balch WE. GTPases: multifunctional molecular switches regulating vesicular traffic. Annu Rev Biochem 1994; 63:949-90.
34.Dickey BF and Birnbaumer L. editors. GTPases in Biology. Berlin: Springer-Verlag; 1993.
35.Pfeffer SR. Rab GTPases: master regulators of membrane trafficking. Curr Opin Cell Biol 1994; 6:522-6.
36.Mizuno K, Tolmachova T, Ushakov DS, Romao M, Abrink M, Ferenczi MA, Raposo G, Seabra MC. Rab27b regulates mast cell granule dynamics and secretion. Traffic 2007l; 8:883-92.
37.Tuvim MJ, Adachi R, Chocano JF, Moore RH, Lampert RM, Zera E, Romero E, Knoll BJ, Dickey BF. Rab3D, a small GTPase, is localized on mast cell secretory granules and translocates to the plasma membrane upon exocytosis. Am J Respir Cell Mol Biol 1999; 20:79-89.
38.Shukla A, Berglund L, Nielsen LP, Nielsen S, Hoffmann HJ, Dahl R. Regulated exocytosis in immune function: are SNARE-proteins involved? Respir Med 2000; 94:10-7.
39.Woska JR Jr, Gillespie ME. SNARE complex-mediated degranulation in mast cells. J Cell Mol Med 2012; 16:649-56.
40.Lorentz A, Baumann A, Vitte J, Blank U. The SNARE Machinery in Mast Cell Secretion. Front Immunol 2012; 3:143.
41.Thangam EB, Jemima EA, Singh H, Baig MS, Khan M et al. The role of histamine receptors in mast cell-mediated allergy and inflammation: The hunt for new therapeutic targets. Front Immunol 2018; 9:1873.
42.Reshef A, MacGlashan DW. Immunogold probe for the light-microscopic phenotyping, of human mast cells and basophils. J Immunol Methods 1987; 99:213-9.
43.Suzumura Y, Ohasi M. Immunoelectron microscopic localization of HLA-DR antigen on mast cells and vessels in normal and tuberculin-reactive skin. Am J Dermatopathol 1991; 13:568-74.
44.Love KS, Lakshmanan RR, Butterfield JH, Fox CC. IFN-gamma-stimulated of MHC class II antigen expression by the human mast cell line HMC-1. Cell Immunol 1996; 170:85-90.
45.Gauchat JF, Henchoz S, Mazzei D et al. Induction of human IgE synthesis in B cells by mast cells and basophils. Nature 1993; 365:340-3.
46.Pawankar R, Okuda M, Yssel H, Okumura K, Ra C. Nasal mast cells in perennial allergic rhinitis exhibit increased expression of the FceRI, CD40L, IL-4 and IL-13, and can induce IgE synthesis in B cells. J Clin Invest 1997; 99:1492-9.
47.Bradding P, Feather IH, Howarth PH, Mueller R, Roberts JA, Britten K, Bews JP, Hunt TC, Okayama Y, Heusser CH, et al. Interleukin 4 is localized to and released by human mast cells. Journal of Experimental Medicine 1992; 176:1381-6.
48.Huels C, Germann T, Goedert S, Hoehn P, Koelsch S, Hültner L, Palm N, Rüde E, Schmitt E. Co-activation of naïve CD4+ T cells and bone marrow-derived mast cells results in the development of TH2 cells. Int Immunol 1995; 7:525-32.
49.Kim HS, Kawakami Y, Kasakura K, Kawakami T. Recent advances in mast cell activation and regulation. F1000Res. 2020 Mar 19;9:F1000 Faculty Rev-196.
50.Manorak W, Idahosa C, Gupta K, Roy S, Panettieri R Jr, Ali H. Upregulation of Mas-related G Protein coupled receptor X2 in asthmatic lung mast cells and its activation by the novel neuropeptide hemokinin-1. Respir Res 2018; 19:1.
51.Gaudenzio N, Sibilano R, Marichal T, Starkl P, Reber LL, Cenac N, McNeil BD, Dong X, Hernandez JD, Sagi-Eisenberg R, Hammel I, Roers A, Valitutti S, Tsai M, Espinosa E, Galli SJ. Different activation signals induce distinct mast cell degranulation strategies. J Clin Invest 2016; 126:3981-3998.
52.Komai-Koma M, Brombacher F, Pushparaj PN, Arendse B, McSharry C, Alexander J, Chaudhuri R, Thomson NC, McKenzie AN, McInnes I, Liew FY, Xu D. Interleukin-33 amplifies IgE synthesis and triggers mast cell degranulation via interleukin-4 in naïve mice. Allergy 2012; 67:1118-26.
53.Allakhverdi Z, Smith DE, Comeau MR, Delespesse G. Cutting edge: The ST2 ligand IL-33 potently activates and drives maturation of human mast cells. J Immunol 2007; 179:2051-4.
54.Guo Z, Wu J, Zhao J, Liu F, Chen Y, Bi L, Liu S, Dong L. IL-33 promotes airway remodeling and is a marker of asthma disease severity. J Asthma 2014; 51:863-9.
55.Reh DD, Wang Y, Ramanathan M Jr, Lane AP. Treatment-recalcitrant chronic rhinosinusitis with polyps is associated with altered epithelial cell expression of interleukin-33. Am J Rhinol Allergy. 2010; 24:105-9.
56.Mitchell PD, O'Byrne PM. Epithelial-derived cytokines in asthma. Chest 2017; 151:1338–1344.
57.Porsbjerg CM, Sverrild A, Lloyd CM, et al. Anti-alarmins in asthma: targeting the airway epithelium with next-generation biologics. Eur Respir J 2020; 56:2000260.
58.Ikeda K, Nakajima H, Suzuki K, Kagami S, Hirose K, Suto A, Saito Y, Iwamoto I. Mast cells produce interleukin-25 upon Fc epsilon RI-mediated activation. Blood 2003; 101:3594-6.
59.Corrigan CJ, Wang W, Meng Q, Fang C, Eid G, Caballero MR, Lv Z, An Y, Wang YH, Liu YJ, Kay AB, Lee TH, Ying S. Allergen-induced expression of IL-25 and IL-25 receptor in atopic asthmatic airways and late-phase cutaneous responses. J Allergy Clin Immunol 2011l; 128:116-24.
60. Calvén J, Ax E, Rådinger M. The Airway Epithelium-A Central Player in Asthma Pathogenesis. Int J Mol Sci 2020; 21:8907.
61.Wang, YH, Liu, YJ. The IL-17 cytokine family and their role in allergic inflammation. Curr Opin Immunol 2008; 20:697–702.
62.Wang YH, Angkasekwinai P, Lu N, Voo KS, Arima K, Hanabuchi S, Hippe A, Corrigan CJ, Dong C, Homey B, Yao Z, Ying S, Huston DP, Liu YJ. IL-25 augments type 2 immune responses by enhancing the expansion and functions of TSLP-DC-activated Th2 memory cells. J Exp Med 2007; 204:1837-47.
63.Wang YH, Ito T, Wang YH, Homey B, Watanabe N, Martin R, Barnes CJ, McIntyre BW, Gilliet M, Kumar R, Yao Z, Liu YJ. Maintenance and polarization of human TH2 central memory T cells by thymic stromal lymphopoietin-activated dendritic cells. Immunity 2006; 24:827-838.
64.Corrigan CJ, Wang W, Meng Q, Fang C, Eid G, Caballero MR, Lv Z, An Y, Wang YH, Liu YJ, Kay AB, Lee TH, Ying S. Allergen-induced expression of IL-25 and IL-25 receptor in atopic asthmatic airways and late-phase cutaneous responses. J Allergy Clin Immunol 2011; 128:116-24.
65.Joulia R, L'Faqihi FE, Valitutti S, Espinosa E. IL-33 fine tunes mast cell degranulation and chemokine production at the single-cell level. J Allergy Clin Immunol 2017; 140:497-509.e10.
66.Soumelis V, Reche PA, Kanzler H, Yuan W, Edward G, Homey B, Gilliet M, Ho S, Antonenko S, Lauerma A, Smith K, Gorman D, Zurawski S, Abrams J, Menon S, McClanahan T, de Waal-Malefyt Rd R, Bazan F, Kastelein RA, Liu YJ. Human epithelial cells trigger dendritic cell mediated allergic inflammation by producing TSLP. Nat Immunol 2002; 3:673-80.
67.Salter BM, Oliveria JP, Nusca G, Smith SG, Watson RM, Comeau M, Sehmi R, Gauvreau GM. Thymic stromal lymphopoietin activation of basophils in patients with allergic asthma is IL-3 dependent. J Allergy Clin Immunol 2015; 136:1636-1644.
68.Miyata M, Hatsushika K, Ando T, Shimokawa N, Ohnuma Y, Katoh R, Suto H, Ogawa H, Masuyama K, Nakao A. Mast cell regulation of epithelial TSLP expression plays an important role in the development of allergic rhinitis. Eur J Immunol 2008; 38:1487-92.
69.Allakhverdi Z, Comeau MR, Jessup HK, Yoon BR, Brewer A, Chartier S, Paquette N, Ziegler SF, Sarfati M, Delespesse G. Thymic stromal lymphopoietin is released by human epithelial cells in response to microbes, trauma, or inflammation and potently activates mast cells. J Exp Med 2007; 204:253-8.
70.Goswami R, Kaplan MH. A brief history of IL-9. J Immunol 2011; 186:3283-8.
71.Brightling C.E., Bradding P., Symon F.A., Holgate S.T., Wardlaw A.J., Pavord I.D. Mast-cell infiltration of airway smooth muscle in asthma. N Engl J Med 2002; 346:1699–1705.
72.Brightling CE. Chronic cough due to nonasthmatic eosinophilic bronchitis: ACCP evidence-based clinical practice guidelines. Chest 2006; 129 (1 Suppl):116S-121S.
73.Carter RJ, Bradding P. The role of mast cells in the structural alterations of the airways as a potential mechanism in the pathogenesis of severe asthma. Curr Pharm Des 2011; 7:685-98.
74.Poto R, Criscuolo G, Marone G, Brightling CE, Varricchi G. Human Lung Mast Cells: Therapeutic Implications in Asthma. Int J Mol Sci 2022; 23:14466.
75.Ali Komi ED, Bjermer L. Mast cell-mediated orchestration of the immune responses in human allergic asthma: current insights. Clin Rev Allergy Immunol 2019; 56:234–247.
76.Chetta A, Zanini A, Foresi A, et al. Vascular component of airway remodeling in asthma is reduced by high dose of fluticasone. Am J Respir Crit Care Med 2003; 167:751–757.
77.Hoshino M, Takahashi M, Aoike N. Expression of vascular endothelial growth factor, basic fibroblast growth factor, and angiogenin immunoreactivity in asthmatic airways and its relationship to angiogenesis. J Allergy Clin Immunol 2001; 107:295–301.
78.Varricchi G, Raap U, Rivellese F, Marone G, Gibbs BF. Human mast cells and basophils-How are they similar how are they different? Immunol Rev 2018; 282:8-34.
79.Galli SJ, Tsai M. IgE and mast cells in allergic disease. Nat Med 2012; 18:693-704.
.
|