|
Asma
ASMA E GRAVIDEZ
A asma é a doença preexistente mais encontrada na gravidez. Estudos epidemiológicos demonstram associação de 3,7 a 8,4% entre asma brônquica e gravidez,1,2 sendo que
a asma mal controlada pode  aumentar a sua gravidade e o risco de exacerbações.3 A asma durante a gravidez pode resultar em aumento da letalidade materna perinatal,4 prematuridade e retardo no crescimento intrauterino, com baixo peso do recém-nato.5 Bahna e Bjerkdal6 encontraram aumento significativo de partos prematuros e baixo peso fetal em 381 pacientes com asma em comparação a 112.530 grávidas não asmáticas.
A asma materna está associada a riscos aumentados de pré-eclâmpsia,5,7 diabetes gestacional,8 cesariana,8 mortalidade perinatal9 e hospitalização neonatal ao nascer.9 aumentar a sua gravidade e o risco de exacerbações.3 A asma durante a gravidez pode resultar em aumento da letalidade materna perinatal,4 prematuridade e retardo no crescimento intrauterino, com baixo peso do recém-nato.5 Bahna e Bjerkdal6 encontraram aumento significativo de partos prematuros e baixo peso fetal em 381 pacientes com asma em comparação a 112.530 grávidas não asmáticas.
A asma materna está associada a riscos aumentados de pré-eclâmpsia,5,7 diabetes gestacional,8 cesariana,8 mortalidade perinatal9 e hospitalização neonatal ao nascer.9
Pacientes com asma sem tratamento conveniente apresentam elevada mortalidade e maior incidência de oligoidrâmnia, hiperêmese gravídica,10 toxemia, hipertensão gestacional11 e hemorragia vaginal espontânea.10
A gravidez produz alterações anatômicas e funcionais no aparelho respiratório. Ocorrem modificações na configuração do tórax, nos volumes pulmonares, no metabolismo e no drive ventilatório.
Com a progressão da gestação o tórax toma a forma de um tonel, com a abertura gradual das últimas costelas. O ângulo subcostal aumenta gradualmente de 68,5º no início da gravidez, para 103,5º no termo.12-14 O diafragma se eleva em ± 4 cm, tornando-se mais curvo, ampliando a base do tórax em 2 cm (diâmetro transverso), com consequente aumento em sua capacidade de gerar pressão: sua área de justaposição à caixa torácica inferior se expande devido ao aumento progressivo da circunferência da parede torácica inferior e alargamento do ângulo costal, proporcionando maior espaço para os pulmões.15 Ressalte-se que a respiração na gravidez é do tipo predominantemente diafragmática, com menor componente costal.
A complacência da parede torácica diminui no final da gestação devido ao aumento do conteúdo abdominal.16
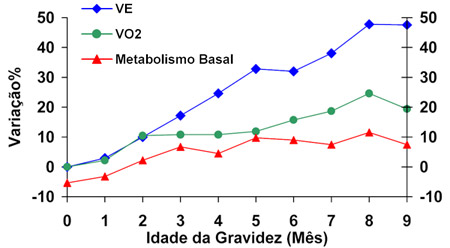 Durante a gravidez evidenciam-se alterações fisiológicas na respiração que devem ser destacadas. Ocorrem elevações no consumo de oxigênio (VO2) no primeiro trimestre e no termo em cerca de 20 a 33% face às demandas fetais e aumento dos processos maternos metabólicos. Há aumento na produção de CO2 e na ventilação alveolar. No curso do ciclo gravídico as concentrações hormonais se elevam, salientando-se a progesterona que ascende de cerca de
25·ng·mL-1 na sexta semana de gravidez, atingindo o pico no termo – 150·ng·mL-1 na 37ª semana.12-14,17 Atribuiem-se às concentrações elevadas de progesterona, a hiperventilação fisiológica da gravidez (conhecida como “dispneia da gravidez”), sendo que ao final da gestação há o aumento de 20–40% na ventilação minuto (VE) (Figura 1).18,19 A hiperventilação decorre por aumento do drive respiratório central, por ativação de receptores de progesterona concentrados no hipotálamo e no hipocampo (já nas primeiras semanas após a concepção). A hiperventilação resulta em diminuição da pressão parcial de dióxido de carbono (PaCO2) com alcalose respiratória transitória.20 Durante a gravidez evidenciam-se alterações fisiológicas na respiração que devem ser destacadas. Ocorrem elevações no consumo de oxigênio (VO2) no primeiro trimestre e no termo em cerca de 20 a 33% face às demandas fetais e aumento dos processos maternos metabólicos. Há aumento na produção de CO2 e na ventilação alveolar. No curso do ciclo gravídico as concentrações hormonais se elevam, salientando-se a progesterona que ascende de cerca de
25·ng·mL-1 na sexta semana de gravidez, atingindo o pico no termo – 150·ng·mL-1 na 37ª semana.12-14,17 Atribuiem-se às concentrações elevadas de progesterona, a hiperventilação fisiológica da gravidez (conhecida como “dispneia da gravidez”), sendo que ao final da gestação há o aumento de 20–40% na ventilação minuto (VE) (Figura 1).18,19 A hiperventilação decorre por aumento do drive respiratório central, por ativação de receptores de progesterona concentrados no hipotálamo e no hipocampo (já nas primeiras semanas após a concepção). A hiperventilação resulta em diminuição da pressão parcial de dióxido de carbono (PaCO2) com alcalose respiratória transitória.20
O aumento da ventilação minuto (VE) ao redor de 30–50% se dá em função da elevação do volume corrente (VC) em 30–50%, mantendo-se a frequência respiratória inalterada.12-14,17 A taquipneia durante a gravidez (irpm > 20/min) é um achado anormal e deve ser investigado. ,
No sangue arterial a hiperventilação determina elevação da PaO2 (102–106 mm Hg) com desvio da curva de dissociação da oxihemoglobina para a direita (devido ao aumento na 2,3-DPG nas hemácias), hipocapnia com PaCO2 em torno de 28–30 mm Hg, com redução paralela compensatória do bicarbonato sérico para 18–22 mmol/L (aumento da exceção renal), com perfil acidobásico de alcalose respiratória primária e acidose metabólica secundária e compensatória, com pH normal, geralmente na banda alcalina da faixa normal (pH 7,44)12,21-25 (Tabela 1). Deve ser ressaltado que uma PCO2 de 40 mm Hg pode representar hipoventilação materna.
Tabela 1 — Parâmetros da Gasometria Arterial em Grávidas e Não Grávidas
|
pH |
PaO2 mm Hg |
PCO2 mm Hg |
HCO3 nmol/L |
|
7,40 |
91–95 |
36–39,4 |
22-26 |
|
7,43–7,46 |
102–106 |
28–30 |
18-21 |
As repercussões das alterações fisiológicas durante a gravidez na função pulmonar começaram a ser avaliadas desde meados do século XIX (ver revisão de Weineberger et al.12). Estudos analisando os volumes pulmonares estáticos foram realizados constatando-se mudanças significativas à medida que a gravidez evolui — o volume de reserva expiratório (VRE), a capacidade residual funcional (CRF) e o volume residual (VR) diminuem de forma constante desde o início da gravidez. A queda progressiva da CRF (média de 20%) está associada à diminuição da complacência torácica, devido ao efeito mecânico do aumento do volume uterino.12,14,26 O VR diminui (em 7 a 22%).17 A queda na CRF pode, entretanto, exacerbar a hipoxemia devido ao fechamento prematuro das pequenas vias aéreas quando a asma aguda complica a gravidez. A capacidade pulmonar total (CPT) pouco se altera, podendo ocorrer leve redução de 4–5%. É provável que a tendência de elevação de diafragma em reduzir a CPT seja compensada por um aumento nos diâmetros anteroposterior e transversal do tórax.27
A Capacidade Vital (CV), o Pico de Fluxo Expiratório (PFE) e o Volume Expiratório Forçado no primeiro segundo (VEF1) não se modificam,28,29 enquanto a capacidade inspiratória (CI) aumenta. Milne et al. mediram a DLCO em 21 grávidas sem comorbidades. Tais avaliações foram mensais e uma vez após o parto. Constataram que a DLCO foi maior no primeiro trimestre da gravidez, ocorrendo queda durante a progressão da gravidez até a 26ª semana de gestação quando houve estabilização. Não se obteve explicação consistente, não sendo explicado pelas alterações da concentração da hemoglobina, volume alveolar ou concentração de estrogênio.30
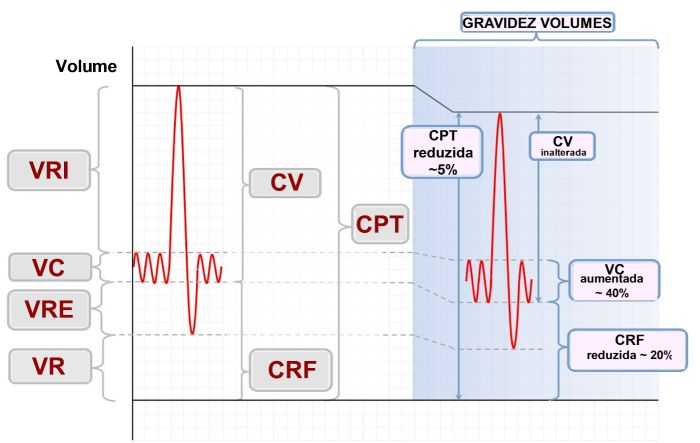
| Figura 2 — Volumes Pulmonares na Gravidez |
VRI – volume de reserva inspiratória; VC – volume corrente; VR – volume residual; VRE – volume de reserva expiratória; CV – capacidade vital; CRF – capacidade residual funcional; CPT – capacidade pulmonar total. Retirado com modificações de
Yartsev, A., Respiratory changes during pregnancy. Deranged Physiology,
Ref. 65 |
O aumento fisiológico da Capacidade de Difusão pelo Monóxido de Carbono (DLCO) que ocorre na posição supina, está ausente ou diminuído na gravidez. Uma explicação para esta constatação relaciona-se ao aumento do débito cardíaco que normalmente se eleva na posição supina em não grávidas, porém cai nas grávidas devido à compressão da veia cava inferior (Tabela 2).
Tabela 2 — Mudanças Fisiológicas na Gravidez
pH |
|
CPT |
levemente reduzida |
|
aumentada |
CRF |
|
|
|
VRE |
reduzida |
|
|
DLCO |
reduzida |
CVF |
inalterado |
VEF1 |
inalterado |
PFE |
inalterado |
VM |
|
O volume plasmático aumenta durante a gravidez, com modificações na sua composição. O conteúdo em água do plasma e do soro eleva-se de cerca de 91,5% no início da gestação, para mais de 92% no terceiro trimestre,31 podendo ter participação no edema das mucosas nasal e brônquica, com consequente elevação na resistência ao fluxo aéreo.
A obstrução nasal é comum durante a gravidez e é devida à hiperemia e ao edema da mucosa mediado pela progesterona. A obstrução nasal acentua a sensação de dispneia, sendo importante diferenciar a "dispneia normal" da gravidez por hiperventilação fisiológica da dispneia patológica, que está associada à redução do PFE e VEF1 ou à hipoxemia.
Vários estudos demonstram que, nas grávidas com asma leve intermitente ou com leve persistente controlada com corticoide inalatório, a gravidez transcorre sem maiores problemas para a mãe e para o feto, enquanto que na asma mais severa, o broncospasmo determina um aumento adicional na VM, visando à manutenção da PaO2. Levando-se em conta a hiperventilação basal da gravidez, que determina uma redução na reserva muscular, este esforço adicional para vencer o aumento da resistência das vias aéreas pode determinar fadiga muscular mais precoce e insuficiência respiratória.
Outro ponto a ser considerado refere-se ao ciclo respiratório materno-fetal. A troca gasosa respiratória materno-fetal ocorre por difusão simples, impulsionada por diferenças parciais de O2 e CO2 entre as respectivas circulações.
Como a PaO2 fetal corresponde a aproximadamente 1/3 da PaO2 de um adulto, a hipoxemia decorrente de uma exacerbação de asma aguda ou asma crônica mal controlada poderá ocasionar sérias complicações fetais. Um estudo utilizando experimentação animal com ovelhas demonstrou que quando a saturação de oxigênio materna cai de 98% para ~58%, a saturação fetal cai de 62% para 27%.31 A placenta altamente permeável tanto ao O2 como CO2 pode ser considerada como uma membrana que separa o fluxo sanguíneo materno uterino do fluxo sanguíneo umbilical. A perfusão materna da placenta se faz pelas artérias uterinas que se dividem em vasos progressivamente menores até formarem as arteríolas espirais, responsáveis pela perfusão do espaço interviloso – espaço onde o sangue circula entre as vilosidades coriônicas fetais.
O sangue materno deixa o espaço interviloso pelas vênulas uterinas que se unem até formar a veia uterina. A circulação uteroplacentária é um sistema de trocas por contracorrente, resultando em significativa shuntagem. A passagem transplacentária de oxigênio ocorre por difusão. Entretanto a diferença entre a PO2 alveolar e a do sangue venoso materno é de 70 mm Hg, na placenta, entre o sangue interviloso e o fetal a oxigenar, é de somente 35 mm Hg. Não há dúvidas de que o feto vive em ambiente hipóxico sendo que uma hipoxemia materna pode ter severas consequências no feto.32
Quando de respiração materna em ar ambiente com FIO2 de 21%, a PO2 da artéria umbilical [sangue fetal venoso (desoxigenado) análoga à artéria pulmonar] é de 15 mm Hg, trazendo sangue bastante hipóxico para a placenta com SaO2 de 30-45%. A PO2 da veia umbilical, (sangue arterial fetal) que retorna ao feto é de somente 31 mm Hg, porém mais rico em oxigênio, assim como o sangue venoso materno será mais pobre. À primeira vista,
isso parece ser uma quantidade insuficiente de oxigênio para o que é essencialmente sangue arterial, entretanto:
Alguns mecanismos importantes de adaptação do feto que minimizam esta hipoxemia, permitindo o seu desenvolvimento, podem assim ser sumarizados:32,33
|
O débito cardíaco fetal é muito maior do que o adulto em relação ao peso corporal; |
• |
Uma parcela do metabolismo fetal transcorre em anaerobiose; |
• |
A espessura da barreira placentária por onde ocorre a difusão do O2 diminui progressivamente à medida que a gravidez chega a termo (25µ no início da gestação, alcançando ao termo de 2 a 6µ, na média 3,7µ); |
• |
Alto hematócrito (Hb~15–18 g/dL) com elevada afinidade pelo oxigênio; |
• |
O desvio da curva de dissociação da hemoglobina fetal para a esquerda favorece maior liberação de O2 para o feto. Para uma mesma pressão parcial de oxigênio, a saturação do sangue fetal é maior que o sangue materno; o sangue materno é, na verdade, desviado para a direita por um aumento no conteúdo de 2,3-DPG; |
• |
Os shunts fetais (ductus arteriosus, foramen ovale) direcionam a maior parte do sangue para órgãos vitais; |
• |
Aumento do fluxo sanguíneo do feto para a placenta. |
Durante a gravidez ocorrem alterações fisiológicas que podem modificar o curso da asma. Podemos dividir em alterações que melhoram e aquelas que pioram a asma.
● |
Broncodilatação mediada pela progesterona; |
● |
Potencialização da broncodilatação ß-adrenérgica mediada pela progesterona ou estrogênios; |
● |
Aumento do cortisol livre plasmático; |
● |
Aumento do AMPc; |
● |
Aumento da resposta beta-adrenérgica mediada pelos corticoides; |
● |
Diminuição da broncoconstrição mediada pela histamina plasmática (devido ao aumento da histaminase circulante); |
● |
Estabilização brônquica mediada pela prostaglandina I2; |
● |
Broncodilatação mediada pela prostaglandina E; |
● |
Broncodilatação induzida pelo peptídeo natriurético atrial; |
● |
Aumento da meia-vida ou redução da ligação proteica de broncodilatadores “endógenos” ou exógenos; |
● |
Redução dos níveis de IgE que ocorrem durante a gravidez. |
Agravam a Asma10,34
● |
Refratariedade pulmonar aos efeitos do cortisol pela competitividade de ligação aos receptores de glucocorticoides pela progesterona, aldosterona ou deoxicorticosterona; |
● |
Broncoconstrição mediada pela prostaglandina F2a. A concentração de PGF2a aumenta durante a gravidez, particularmente durante o trabalho de parto;35 |
● |
Redução da CRF com fechamento das pequenas vias aéreas e redução dos índices de ventilação-perfusão; |
● |
Aumento do refluxo gastresofagiano; |
● |
Aumento do estresse e fatores psicológicos; |
● |
Maior frequência de sinusite durante a gravidez, 1,5% de todas as gravidezes, seis vezes mais que na população geral.36 |
Durante a gravidez ocorre elevação significativa dos níveis hormonais para preparar o organismo materno na sustentação do desenvolvimento fetal e futura amamentação. Ocorre elevação rápida da gonadotrofina coriônica humana (hCG) nas primeiras semanas de gestação com pico por volta da 10ª semana para a manutenção do corpo lúteo no início da gravidez cuja função principal é a produção da progesterona até que a placenta assuma essa tarefa; progesterona e estrogênio têm seus níveis em contínua elevação durante a gravidez.
Os estrogênios têm um efeito duplo. São imunoestimuladores em baixas doses e imunossupressores em altas doses (como no final da gestação). Esse fenômeno sugere um papel na tolerância imunológica em relação ao feto.
Como descrito, tanto a progesterona como também o cortisol aumentam progressivamente no decurso do ciclo gravídico. Outros hormônios, como a aldosterona e a desoxicorticosterona que também se elevam no soro da grávida, apresentam, entretanto, efeitos antagônicos sobre os receptores do cortisol,37 podendo ter participação na fisiopatologia da asma gravídica. Outras mudanças que podem explicar os efeitos da gravidez sobre a asma incluem a mudança da responsividade dos receptores ß2-agonistas, mudanças na inflamação brônquica decorrentes dos altos níveis de progesterona circulante e pela depressão da imunidade celular.38,39
A gravidez considerada normal, fisiológica portanto, é considerada uma condição pró-inflamatória, típica Th2.40 Além disso, na gestação normal ocorre alteração na representação da subpopulação leucocitária na circulação materna e está associada com a ativação sistêmica dos leucócitos.41 Uma resposta imune anormal em pacientes com pré-eclâmpsia é caracterizada pelo desvio Th2 para Th1.42 Recentemente, foi sugerido que o desenvolvimento de respostas por citocinas Th2 esteja associado à exposição a altas concentrações de antígeno leucocitário humano solúvel HLA-G, mantendo viável a gravidez, enquanto que baixas concentrações de HLA-G aumentam a expressão de citocinas Th1.43 Portanto, as respostas imunes Th2 durante a gravidez promovem uma gestação de curso normal até o termo. Todavia, não está elucidado se este predomínio Th2 normal da gravidez é capaz ou não de influenciar a asma da mãe atópica, exacerbando a doença no decurso de gestação.
O curso da asma na gravidez não pode ser previsto, podendo ocorrer tanto a estabilização, melhora ou piora. Um estudo de Schatz et al.44 abrangendo 16 centros médicos avaliou uma população de 1.739 mulheres com asma e gravidez. Estas mulheres foram acompanhadas prospectivamente até o termo. A grande maioria foi classificada ao entrar no estudo como portadora de asma leve (50,2%) ou moderada (46,8%). Cerca de 3% apresentavam-se com doença severa. Durante o curso gestacional, 30,3% das mulheres inicialmente classificadas como asma leve migraram para a categoria moderada-severa, enquanto que 23% daquelas classificadas como moderada-severa se converteram à asma leve. Portanto, presume-se ser uma boa generalização que durante a gravidez, cerca de um terço das mulheres com asma experimenta piora dos sintomas, um terço permanece o mesmo e um terço sofre piora de sua asma.45 Existem evidências de que o curso da asma é similar em subsequentes gravidezes. Em um estudo de coorte obstétrica norte-americana, que recebeu atendimento de acordo com a prática clínica padrão, não se obteve o subgrupo com melhora na asma durante a gravidez. Ao contrário, foi detectado que um grupo maior de mulheres teve piora durante a gestação (40%).46
Pacientes com asma severa tendem a piorar durante a gravidez, enquanto aquelas que apresentam asma leve tendem a melhorar.47 No estudo de Schatz et al.44 as exacerbações durante a prenhez ocorreram em 12,6% das pacientes inicialmente classificadas como asma leve, 25,7% nas com asma moderada e 51,9% com asma severa.
Em geral, o primeiro trimestre e o último mês de gravidez são relativamente livres de exacerbações. O agravamento dos sintomas da asma tende a ocorrer mais entre a 24ª–36ª semanas de gestação e a necessidade de medicamentos aumenta.48,49 O comportamento da asma nas gestações subsequentes é semelhante às anteriores.4,47 Além disso deve ser resslaltado que as exacerbações são incomuns durante o período do parto e 90% das parturientes não serão acometidas durante o parto.50
A interrupção da medicação para asma durante a gravidez, motivada pelo receio de efeitos teratogênicos, representa um risco significativo, porém evitável. A adesão ao tratamento reduz em mais de 75% a chance de exacerbações, destacando a importância do uso contínuo dos medicamentos de controle.51
As exacerbações da asma na gravidez estão associadas a fenótipos alérgicos específicos Th2, tendo a rinite alérgica atópica como fator agravante durante a gestação.52 Cerca de 70% das gestantes com asma ganham peso acima do recomendado, sendo frequente o sobrepeso ou obesidade pré-gestacional nesse grupo.53 Recentemente a obesidade foi reconhecida como fator de risco tanto para a asma como para a sua gravidade. Ela pode ser a responsável por um fenótipo de asma mais severa, sendo que as exacerbações da asma em grávidas com sobrepeso ou obesidade são duas vezes mais frequentes do que em mulheres com peso normal e com asma.54
No que concerne ao diagnóstico diferencial da asma na gravidez, deve-se levar em consideração outras patologias associadas à dispneia aguda e sibilância ocasional. Dentre elas:55-57 1) hiperventilação na fase inicial ou tardia da gravidez que possa estar associada à dispneia, sem que haja, entretanto, tosse, sibilos e sensação de opressão torácica; 2) miocardiopatia periparto idiopática; 3) terapia tocolítica associada ao edema pulmonar, relacionado à utilização de drogas simpaticomiméticas no trabalho de parto prematuro; 4) embolia de líquido amniótico; 5) embolia pulmonar (a gestação aumenta de 4 a 5 vezes o risco de tromboembolismo venoso).
Durante o ciclo gravídico-puerperal o acompanhamento especializado deve ser incentivado, objetivando-se suporte terapêutico farmacológico, enfatizando-se o aspecto preventivo, mantendo-se o bem-estar materno-fetal, reafirmando-se a necessidade do controle ambiental, evitando-se possíveis fatores precipitantes da asma.
O tabagismo tem sido relacionado a um nível maior de complicações maternas na gravidez como: gravidez ectópica, aborto espontâneo, rutura prematura das membranas, parto prematuro e placenta prévia.58 Assim, evitar exposição à fumaça e cessar o tabagismo bem como prevenir recaídas são intervenções muito importantes durante a gestação. Nas consultas regulares de pré-natal é indispensável o registro do estado tabágico da gestante e aplicar o aconselhamento para parar de fumar em qualquer idade gestacional.59,60
A importância de manter um nível de exercício aeróbico durante a gravidez deve ser fornecido às pacientes desde o início do atendimento pré-natal.
Já está bem estabelecido que
a asma materna especialmente quando mal controlada não só aumenta o risco de pré-eclâmpsia.45 Essas mulheres apresentam maior risco para apresentação pélvica, ruptura prematura de membranas, cesariana, hemorragia, embolia pulmonar,61 mas também de asma e sibilos em seus filhos.62,63 A orientação conjunta de um pneumologista em consonância com o obstetra durante a gravidez diminui o risco aumentado de diabetes gestacional,8 parto prematuro,7 e hospitalização neonatal.9
➢ Tratamento da Asma :: Situações Específicas —Tratamento da Asma na Gravidez
Referências
01.Kwon HL, Belanger K, Bracken MB. AsThma prevalence among pregnant and childbearing-aged women in The United States: estimates from national healTh surveys. Ann Epidemiol 2003; 13:317-24.
02.Murphy KJ, Kazerooni EA, Braun MA, Weinberg EP, Killan DA, Hendrick WJ. Radiographic appearance of intraThoracic complications of pregnancy. Can Assoc Radiol J 1996; 47:453-9.
03.Namazy JA, Murphy VE, Powell H, Gibson PG, Chambers C, Schatz M. Effects of asThma severity, exacerbations and oral corticosteroids on perinatal outcomes. Eur Respir J 2013; 41:1082-90.
04.Williams DA. AsThma and pregnancy. Acta Allergol 1967; 22:311-23.
05.Murphy VE, Namazy JA, Powell H, Schatz M, Chambers C, Attia J, Gibson PG. A meta-analysis of adverse perinatal outcomes in women wiTh asThma. BJOG 2016; 123:427-433.
06.Banha SL, Bjerkdal T. The course and outcome of pregnancy in women wiTh bronchial asThma. Acta Allergol 1972; 27:397-406.
07.Murphy VE, Namazy JA, Powell H, et al. A meta-analysis of adverse perinatal outcomes in women wiTh asThma. Br J Obstet Gynaecol 2011; 118:1314-1323.
08.Eltonsy S, Forget A, Beauchesne MF, et al. Risk of congenital malformations for asThmatic pregnant women using a long-acting beta2-agonist and inhaled corticosteroid combination versus higher-dose inhaled corticosteroid monoTherapy. J Allergy Clin Immunol 2015; 135: 123-130.
09.Murphy VE, Wang G, Namazy JA, et al. The risk of congenital malformations, perinatal mortality and neonatal hospitalisation among pregnant women wiTh asThma: a systematic review and meta-analysis. Br J Obstet Gynaecol 2013; 120: 812-822.
10.Liccardi M, D'Amato M, D'Amato G. AsThma in pregnant patients: paThophysiology and management. Monaldi Arch Chest Dis 1998; 53:151-9.
11.Stenius-Aarniala R, Pirila P, Teramo K. AsThma and pregnancy: a prospective study of 198 pregnancies. Thorax 1988; 43:12-8.
12.Weinberger SE, Weiss ST, Cohen WR, Weiss JW, Johnson TS. Pregnancy and The lung. Am Rev Respir Dis 1980; 121:559-81.
13.Contreras G, Gutiérrez M, Beroíza T, Fantín A, Oddó H, Villarroel L, Cruz E, Lisboa C. Ventilatory drive and respiratory muscle function in pregnancy. Am Rev Respir Dis 1991;144:837-41.
14.Gilroy RJ, Mangura BT, Lavietes MH. Rib cage and abdominal volume displacements during breaThing in pregnancy. Am Rev Respir Dis 1988; 137:668-72.
15.Crapo RO. Normal cardiopulmonary physiology during pregnancy. Clin Obstet Gynecol 1996; 39:3-16.
16.Lapinsky SE, Tram C, Mehta S, Maxwell CV. Restrictive lung disease in pregnancy. Chest 2014; 145:394-398.
17.LoMauro A, Aliverti A. Respiratory physiology of pregnancy: Physiology masterclass. BreaThe (Sheff). 2015; 11:297-301.
18.Cagal DW, Frank NR, Gaensler EA et al. Pulmonary function in pregnancy. I. Serial observations in normal women. Am Rev Tuberc 1953; 67:568-97.
19.Rees GB, Broughton Pipkin F, Symonds EM, Patrick JM. A longitudinal study of respiratory changes in normal human pregnancy wiTh cross-sectional data on subjects wiTh pregnancy-induced hypertension. Am J Obstet Gynecol 1990; 162:826-30.
20.Prowse CM, Gaensler EA. Respiratory and acid-base changes during pregnancy. AnesThesiology 1965; 26:381–392.
21.Fadel HE, et al. Normal pregnancy: a model of sustained respiratory alkalosis. J Perinat Med 1979; 74:195-201.
22.Liberatore SM. Respiratory function during pregnancy. Respiration 1984; 46:145-50.
23.Jensen D, Duffin J, Lam YM, Webb KA, Simpson JA, Davies GA, Wolfe LA, O'Donnell DE. Physiological mechanisms of hyperventilation during human pregnancy. Respir Physiol Neurobiol 2008; 161:76-86.
24.Blechner JN. Maternal-fetal acid-base physiology. Clin Obstet Gynecol 1993; 36:3–12.
25.MacRae DJ. Maternal influence on foetal acid-base balance. Proc R Soc Med 1968; 61:490–1.
26.Alaily AB, Carrol KB. Pulmonary ventilation in pregnancy. Br J Obstet Gynaecol 1978; 85:518-24.
27.Bonica JJ. Maternal respiratory changes during pregnancy and parturition. Clin AnesTh 1974; 10:1-19.
28.Baldwin GR et al. New lung functions and pregnancy. Am J Obstet Gynecol 1977; 127:235-9.
29.National AsThma Education Program Working Group on AsThma and Pregnancy. National Management of AsThma During Pregnancy. BeThesda, MD, NIH Publication No.93-3279A, 1992.
30.Milne JÁ et al. The effect of human pregnancy on The pulmonary transfer factor for carbon monoxide as measured by single-breaTh meThod. Clin Sci Mol Med 1977; 53:271-6.
31.Jellyman JK, Gardner DS, Edwards CM, Fowden AL, Giussani DA. Fetal cardiovascular, metabolic and endocrie responses to acute hypoxaemia during and following maternal treatment wiTh dexameThasone in sheep. J Physiol 2005; 567:673-88.
32.Rezende J, Nahoun JC. Trocas Materno-Ovulares. In : Jorge de Rezende. Obstetrícia . 3ª edição. Rio de Janeiro: Ed. Guanabara Koogan S.A.;1977:74.
33.Sinert R, Stavile KL, Han JH. Acute AsThma in Pregnancy. In : Barry E. Brenner. Emergency AsThma . 1 st . Ed. New York; 1999:443.
34.Schatz M. AsThma during pregnancy: interrelationships and management. Ann Allergy 1992; 68:123-33.
35.Fishburne JI Jr, Brenner WE, Braaksma JT, Hendricks CH. Bronchospasm complicating intravenous prostaglandin F2a for Therapeutic abortion. Obstet Gynecol 1972; 39:892-6.
36.Sorri M, Hartikainen-Sorri AL, Karja J. Rhinitis during pregnancy. Rhinology 1980; 18:83-6.
37.Hubl W, Buchner M, Bellee H et al. Study of plasma aldosterone in normal pregnancy, in pre-eclamptic women, and cord plasma of newborns. Endokrinologie 1979; 73:162.
38.Clemens LE, Stteri PK, Stites DP. Mechanism of immunosuppression of progesterone on maternal lymphocyte activation during pregnancy. J Immunol 1979; 122:1978-85.
39.Fortser PS, Goldie RG, Patterson JW. Effect of steroids on beta-adrenoceptor-mediated relaxation of pig bronchus. Br J Pharmacol 1983; 78:441-5.
40.Piccinni MP, Giudizi MG, Biagiotti R et al. Progesterone favors The development of human T helpecells producing Th2-type cytokines and promotes boTh IL-4 production and membraneCD30 expression in established Th1 cell clones. J Immunol 1995; 155:128-33.
41.Luppi P, Haluszczak C, Trucco M, Deloja JA. Normal pregnancy is associated wiTh peripheral leukocyte activation. Am J Reprod Imunol 2002; 47:72-81.
42.Rein DT, Schondorf T, Gohrioing UJ et al. Cytokine expression in peripheral blood lymphocytes indicates a switch to T (HELPER) cells in patients wiTh preeclampsia. J Reprod Immunol 2002; 54:133-142.
43.Kapasi K, Albert SE, Yie S, Zavazava N, Librach CL. HLA-G has a concentration-dependent effect on The generation of an allo-CTL response. Immunology 2000; 101:191-200.
44.Schatz M, Dombrowski MP, Wise R, Thom EA, Landon M, Mabie W, Newman RB et al. AsThma morbidity during pregnacy can be predicted by severity classification. J Allergy Clin Immunol 2003; 112:283-8.
45.Gluck JC, Gluck P. The effects of pregnancy on asThma: a prospective study. Ann Allergy 1976; 37:164-8.
46.Stevens DR, Perkins N, Chen Z, et al. Determining The clinical course of asThma in pregnancy. J Allergy Clin Immunol Pract 2022; 10:793-802.e10.
47.Schatz M, Hoffman E, Zeiger RS. The course and management of asThma and allergic diseases during pregnancy. In Middleton E, Reed CE, Ellis EF, eds. Allergy: Principles and Practice. St. Louis, Mosby Year Book Inc,1988.
48.Gluck PA, Gluck JC. AsThma in women: special considerations. Ann Allergy AsThma Immunol 2006; 96(5):635.
49.Murphy VE, Clifton VL, Gibson PG. AsThma exacerbations during pregnancy: incidence and association wiTh adverse pregnancy outcomes. Thorax 2006; 61:169-176.
50.Wang H, Li N, Huang H. Asthma in Pregnancy: Pathophysiology, Diagnosis, Whole-Course Management, and Medication Safety. Can Respir J 2020 Feb 22;2020:9046842.
51.Stenius-Aarniala BS, Hedman J, Teramo KA. Acute asthma during pregnancy. Thorax 1996; 51:411-4.
52.Powell H, Murphy VE, Hensley MJ, et al. Rhinitis in pregnant women wiTh asThma is associated wiTh poorer asThma control and quality of life. J AsThma 2015; 52:1023-1030.
53.Centre of excellence treatable traits. Asthma in pregnancy toolkit. Disponível em: https://asthmapregnancytoolkit.org.au
54.Murphy VE, Jensen ME, Powell H, et al. Influence of maternal body mass index and macrophage activation on asThma exacerbations in pregnancy. J Allergy Clin Immunol Pract 2017; 5:981–987.
55.National AsThma Education Program Report of The Working Group on AsThma and Pregnancy. BeThesda, MD: NTh Publication 93-3279, September 1993; 1-47.
56.HollingsworTh HM, Irwin RS. Acute respiratory failure in pregnancy. Clin Chest Med 1992; 13:723-40.
57.Rizk NW, Kalassian KG, Gilligan T, Druzin MI, Daniel DL. Obstetric complications in pulmonary and critical medicine. Chest 1996; 110:791-809.
58.Mehta N, Chen K, Hardy E, Powrie R. Respiratory disease in pregnancy. Best Pract Res Clin Obstet Gynaecol 2015l; 29:598-611.
59.Godoy, I.– "Janelas de Oportunidade" para Cessar o Tavagismo. In: Pereira LFF; Araújo AJ; Viegas CAA; Castellano MVCO. Tabagismo Prevenção e Tratamento. Rio de Janeiro: DiLivros: 2021:207-211.
60.Comittee on Obstetric Practice. Tobacco and nicotine cessation during pregnancy: ACOG Committee opinion summary, Number 807. Obstet Gynecol 2020; 135:1244-6.
61.Ali Z, Hansen AV, Ulrik CS. Exacerbations of asThma during pregnancy: impact on pregnancy complications and outcome. J Obstet Gynaecol 2016; 36:455-461.
62.Murphy VE, Jensen ME, Mattes J, Hensley MJ, Giles WB, Peek MJ, et al. The BreaThing for Life Trial: a randomised controlled trial of fractional exhaled nitric oxide (FENO)-based management of asThma during pregnancy and its impact on perinatal outcomes and infant and childhood respiratory healTh. BMC Pregnancy ChildbirTh 2016; 16:111.
63.Namazy JA, Murphy VE, Powell H, Gibson PG, Chambers C, Schatz M. Effects of asThma severity, exacerbations and oral corticosteroids on perinatal outcomes. Eur Respir J 2013; 41:1082-1090.
64.Prowse CM, Gaensler ES. Respiratory and acid-base changes during pregnancy. Anestesiology 1965;26:381.
65.Yartsev, Alex, Respiratory changes during pregnancy. Deranged Physiology, 2022 Disponível em: https://derangedphysiology.com/main/required-reading/pregnancy-obstetrics-and-gynaecology/Chapter%20114/respiratory-changes-during-pregnancy.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|