|
Asma
ASPERGILOSE BRONCOPULMONAR ALÉRGICA
A aspergilose broncopulmonar alérgica (ABPA) é um  endótipo da asma e se não for convenientemente tratada pode evoluir para bronquiectasias e fibrose. endótipo da asma e se não for convenientemente tratada pode evoluir para bronquiectasias e fibrose.
A prevalência de ABPA na asma é de cerca de 16%1 enquanto que na fibrose cística > 15%,2 sendo que a prevalência da ABPA na asma não varia de acordo com a gravidade da asma.3 Por outro lado, Saxena et al. observaram uma prevalência de 41% de asma com sensibilização ao Aspergillus fumigatus em pacientes com doença grave, utilizando IgE específica para A. fumigatus e de 30% através de teste cutâneo.1
Em 1952, Hinson, Moon e Plummer4 do London Chest Hospital descreveram oito casos de ABPA sob o título de "Broncho-pulmonary Aspergillosis". Destes oito casos, cinco foram considerados como micetomas, contendo espécies Aspergillus e foram classificados como do tipo saprófita. Os outros três, duas mulheres com idades de 45 e 55 anos e um homem de 37 anos, apresentavam episódios febris recorrentes com tosse severa do tipo produtiva purulenta. O escarro continha eosinófilos, espirais de Curschmann e cristais de Charcot-Leyden. A asma era indiscutível em dois pacientes e sibilos eram descritos no terceiro. Todos apresentavam eosinofilia maior que 1.000 células mm3. Dois apresentavam bronquiectasias saculares e o outro “rolhas” de muco visualizadas na broncoscopia. O paciente masculino evoluiu para óbito em decorrência de mal asmático e todos apresentavam história de exposição ao fungo, por criação de galinhas, moagem de trigo e jardinagem com utilização de fertilizantes contaminados. Como todos os três apresentavam eosinofilia os autores propuseram etiologia alérgica para a doença.
Entretanto, os primeiros esforços para formular critérios diagnósticos para a ABPA foram introduzidos em 1977 por Rosenberg et al.5
A
ABPA está associada a reações de hipersensibilidade dos Tipos I e III ao A. fumigatus inalado. Os conídios (esporos) inalados de Aspergillus devido ao seu pequeno diâmetro (2,5 a 4,5 micrômetros) se propagam facilmente atingindo as vias aéreas, germinam em hifas, com liberação de antígenos que ativam as respostas imunes inatas e adaptativas (respostas de células Th2) do pulmão. Sua patogênese é estabelecida através de níveis elevados de IgE sérica, reação de hipersensibilidade cutânea imediata com ou sem reação de Arthus e presença de IgE, IgG e/ou anticorpos específicos precipitantes de A. fumigatus.5-8
Pepys et al.9 foram os responsáveis pelo esclarecimento das bases alérgicas da doença, desenvolvendo extratos de Aspergillus com os quais demonstraram respostas in vivo e in vitro.
A ABPA é provavelmente uma doença pulmonar poligênica de hipersensibilidade Th2 causada por qualquer uma das numerosas espécies do gênero Aspergillus que abriga mais de 250 espécies de fungos filamentosos,10 pertencentes ao filo Ascomycota. A principal causa de aspergilose humana é determinada pelo Aspergillus fumigatus11 e ocasionalmente pelo Aspergillus flavus, Aspergillus niger, Aspergillus clavatus, Aspergillus nidulans e Aspergillus terreus. Os fungos do gênero Aspergillus são ubíquos, sendo encontrados praticamente em qualquer ambiente: água, ar e solo. São saprófitos e existem em qualquer lugar onde exista matéria orgânica em decomposição, tolerando condições ambientais extremas, sendo termotolerantes, apresentando crescimento entre 12º e 52ºC. Qualquer pessoa está exposta diariamente aos esporos deste fungo, sendo impossível evitá-lo.12 A identificação em nível tecidual baseia-se principalmente em três achados: uniformidade no tamanho das hifas (2,5 – 4,5 µm de largura), septação frequente e ramificações dicotômicas de aproximadamente 45º (Figura 1).
Outros fungos filamentosos, como Penicillium, Curvularia spp. e Schizophyllum commune, podem causar patologia semelhante chamada de Allergic Bronchopulmonary Mycosis (ABPM),13,14 quando atribuível a fungos que não sejam Aspergillus spp.
Susceptibilidade genética à ABPA na asma é descrita. Um estudo de associação genética identificou SNPs (Polimorfismo de Nucleotídeo Único) em genes candidatos, incluindo TLR3, IL4R e IL-13 que estão associados à ABPA e que ajudam a fundamentar a participação desses receptores e vias na resposta imune ao A. fumigatus e na susceptibilidade à ABPA.15 Chauhan et al. avaliaram o locus HLA-DR e o envolvimento dos genes HLA-DQ no desenvolvimento da ABPA. Concluíram que as moléculas HLA-DR DR2, DR5 e possivelmente DR4 ou DR7 contribuem para a susceptibilidade, enquanto o HLA-DQ2 contribui para a resistência à doença. Uma combinação deles pode determinar o desfecho da ABPA na fibrose cística e na asma.16,17
O quadro clínico típico da ABPA se caracteriza por: atopia, rinite, alergia às drogas, conjuntivite alérgica, história de asma mal controlada que se apresenta com exacerbações frequentes, tosse, expectoração de aspecto compacto/sólido ("tampões/rolhas"). Esta expectoração tem um aspecto de um molde brônquico, de coloração acastanhada, determinando o que se denomina de impactação mucoide ou bronquite plástica.18,19 Estes moldes podem se apresentar de forma larga e linear ou com configuração de Y ou V ou como um cacho de uvas, dependendo da extensão do brônquio comprometido e se a bifurcação é afetada. Os moldes são compostos por filamentos, ditos hifas, que constituem uma trama que representa o corpo vegetativo dos fungos, células inflamatórias e muco.
As grandes vias aéreas também podem ser obstruídas por muco e hifas impactadas.
Devido ao seu pequeno tamanho (2,5 – 4,5 µm), esses conídios se instalam também nas vias aéreas distais.
A patogênese da ABPA implica exposição e inalação de esporos. Devido às características estruturais, eles se fixam em brônquios mais calibrosos e, por serem termofílicos, germinam produzindo alta concentração de antígenos que estimulam o sistema imune local e sistêmico, com formação de anticorpos específicos de todas as classes, principalmente E, G e A. O fungo não invade os tecidos, permanecendo como saprófita na luz das vias aéreas. Determinam uma resposta imunológica com altos níveis de IgE específica contra o Aspergillus,20,21 com elevação da IgE total,21,22 bem como eosinofilia.17 A via clássica do sistema do complemento é ativada pelos complexos imunes formados pelas subclasses 1 e 3 da IgG com antígenos do Aspergillus. A via alternativa pode ser ativada tanto pela IgA 1 e 2 quanto pelas enzimas proteolíticas produzidas pelo fungo. Esta ativação gera produtos biologicamente ativos, que juntamente com as enzimas aumentam ainda mais a injúria tecidual, proporcionando maior adsorção de antígenos. Apesar da existência de complexos imunes, é importante salientar que eles atuam localmente, não sendo a ABPA uma doença de complexos imunes circulantes.21
O próprio fungo contribui substancialmente para a patogênese da doença. As proteases derivadas do Aspergillus fumigatus provavelmente causam lesão das células epiteliais e rotura da barreira protetora, desencadeando reação de hipersensibilidade, induzindo à inflamação e permitindo maior penetração de antígenos fúngicos na parede da via aérea.23 As proteases derivadas de Aspergillus também podem estimular a liberação de citocinas pró-inflamatórias, como a IL-8 e de fatores de crescimento e também podem causar danos nos tecidos, levando a bronquiectasias.24 Também são liberadas outras citocinas como IL-4, IL-5 e IL-13, que aumentam os eosinófilos no sangue e nas vias aéreas, bem como a IgE. Metaplasia escamosa da mucosa brônquica é comum e granulomas podem se desenvolver. Com a inflamação de longa duração, fibrose brônquica e bronquiolite obliterante podem ocorrer.
Estudos imunológicos demonstram a presença de reação de hipersensibilidade Tipo I com elevação dos níveis séricos da IgE total e da IgE específica para o Aspergillus fumigatus com ABPA. Assim, na atualidade a IgE
específica para A. fumigatus, através do teste de imunoensaio enzimático fluorescente é o teste mais utilizado para diagnosticar a sensibilização ao Aspergillus,25 sendo o instrumento de triagem preferido face a sua elevada sensibilidade (99–100%) quando comparado ao teste cutâneo para Aspergillus (88–94%).3,26 O ponto de corte para a IgE específica para A. fumigatus é de
≥ 0,35 kUA·L -1. Por outro lado a IgE total,
considerada um marcador não específico da atividade imunológica, com amplo diagnóstico diferencial quando elevada,27 apresenta um ponto de corte para a ABPA de ≥ 500 UI·mL -1 (Imunoenzimático). A proliferação de Aspergillus na luz das vias aéreas induz inflamação brônquica Th2 mediada e estimulada pela IgE com consequente eosinofilia pulmonar e no sangue periférico, muitas vezes já presente pela asma. A contagem de eosinófilos no sangue periférico é geralmente maior que 1.000 mm3 e valores superiores a 3.000 são comuns. A detecção do antígeno galactomanana no soro através de ensaio imunoenzimático (ELISA) foi aprovada para diagnosticar a aspergilose pulmonar invasiva. No entanto, devido à sua baixa precisão nos testes séricos de galactomanana na ABPA não é recomendado para diagnóstico nesta condição.28
Não existe predominância de sexo na ABPA. A maioria dos pacientes tem episódios de dispneia devido à asma. A reação antígeno-IgE ocorrendo continuamente nas vias aéreas conduzirá à exacerbação clínica da asma, com episódios febris intermitentes (38–40ºC), expectoração mucopurulenta, às vezes com agregados de eosinófilos, com “rolhas” de muco (2–3 mm) de coloração escura, que corados pela prata, permitem a identificação de hifas septadas de Aspergillus. Microscopicamente, esses tampões de muco mostram camadas de eosinófilos em degeneração mescladas na mucina e o pulmão circundante pode mostrar pneumonia eosinofílica irregular.29
Os episódios recorrentes da aspergilose alérgica podem gradualmente destruir a mucosa brônquica causando bronquiectasias saculares proximais, assim como evolutivamente a destruição parenquimatosa e fibrose intersticial. A causa das bronquiectasias em pacientes com ABPA decorre de reação imune à exposição às altas concentrações de alérgenos de Aspergillus, com liberação de uma variedade de proteínas como catalases, proteases, fosfolipases, hemolisina, superóxido dismutases e outras toxinas, que possuem atividade biológica além de imunológica e as ações de mucotoxinas, elastase, IL-4 e IL-5, sendo que em estágios bem mais avançados da doença, por invasão direta da parede brônquica pelos fungos. Acometem principalmente os lobos superiores, sobretudo as vias respiratórias mais verticais, estando ausentes no estágio inicial da doença.21 Quando presentes, o paciente passa a apresentar abundante expectoração do tipo purulento e infecções pulmonares recorrentes ou fibrose pulmonar, ou ambas com dispneia progressiva.30,31 O prognóstico é variável. Alguns pacientes evoluem sem que haja perda funcional apesar de episódios recorrentes da doença. Outros, entretanto, evoluem para asma corticoide dependente. O estágio final é o de fibrose com obstrução brônquica irreversível que evolui para insuficiência respiratória e morte.
Após o tratamento com corticoides, o infiltrado desaparece e o paciente entra em remissão. Após a retirada do corticoide, todavia, o paciente pode experimentar exacerbações assintomáticas ou sintomáticas. As exacerbações assintomáticas são detectadas pela presença de infiltrados radiológicos ou pela elevação de IgE. Muitos pacientes com ABPA tornam-se corticoide dependentes pois a redução da droga resulta em asma severa. Por último, alguns pacientes com ABPA desenvolvem severa fibrose pulmonar, apesar de toda a terapêutica. Alguns podem evoluir para a fase de fibrose, ou de bronquiectasias crônicas, enquanto que outros permanecem longo tempo em remissão. Deve ser ressaltado que a ABPA é uma doença de curso prolongado, requerendo constante monitorização radiológica e avaliações seriadas da IgE.
Na nova classificação ABPA/M, onde as cinco categorias foram mantidas: ABPA aguda, resposta, remissão, ABPA corticoide dependente e ABPA avançada.32 (Tabela 1)
Classificação Clínica e Critérios de Resposta ao Tratamento para Aspergilose/Micose Broncopulmonar Alérgica (ABPA/M) |
|
Recentemente diagnosticada: ABPA/M não diagnosticada anteriormente que atende aos critérios diagnósticos |
Exacerbação: Em um paciente com diagnóstico de ABPA/M:
• Piora clínica sustentada (>14 dias); ou
• Piora radiológica; e
• Aumento da IgE total sérica em ≥50% em relação ao último valor de IgE registrado durante a estabilidade clínica, juntamente com
• Exclusão de outras causas de piora. |
Exacerbação da asma: agravamento dos sintomas respiratórios por pelo menos 48h sem deterioração imunológica ou radiológica da ABPA/M. |
Exacerbação infecciosa / bronquiectasias: deterioração clínica por pelo menos 48h com aumento da tosse, respiração ofegante >>> volume ou consistência do escarro, escarro purulento, fadiga, mal-estar, febre ou hemoptise, sem deterioração imunológica ou radiológica de ABPA/M. |
Resposta |
• Melhora sintomática de pelo menos 50% (numa escala Likert ou visual analógica) após 8 semanas; e |
• Melhora radiológica significativa (redução de >50% nas opacidades radiológicas) ou redução da IgE total sérica em pelo menos 20% após 8 semanas de tratamento. |
Remissão |
• Melhora clínico-radiológica sustentada (≥6 meses), sem corticoides; e |
• Ausência de aumento de IgE total sérica em ≥50% em relação ao último valor de IgE registrado durante a estabilidade clínica. |
Pacientes que utilizam agentes biológicos ou antifúngicos de longa duração também podem ser considerados em remissão se atenderem aos critérios acima. |
|
• Duas ou mais exacerbações consecutivas de ABPA/M, cada uma dentro de 3 meses após a interrupção dos corticoides. |
• Piora dos sintomas respiratórios e piora nos exames de imagem ou aumento de 50% na IgE total sérica em 4 semanas após a redução gradual dos corticoides orais em duas ocasiões distintas. |
|
• Bronquiectasia extensa (≥10 segmentos) devido a ABPA/M na imagem do tórax; e |
| • Cor pulmonale ou insuficiência respiratória crônica Tipo 2. |
As manifestações radiológicas da ABPA, são evidentes tanto na radiografia simples de tórax (50% de sensibilidade para o diagnóstico de ABPA) como na tomografia computadorizada do tórax de alta resolução (HRTC). Lynch33 comparando os dois métodos detectou bronquiectasias nas radiografias de tórax em cerca de 11 de 19 pacientes com ABPA, enquanto a tomografia computadorizada (TC) detectou a mesma anormalidade em 18 dos 19 pacientes. A TC é considerada o método principal para a detecção de bronquiectasias, principalmente após o advento da técnica de HRTC.
Diretrizes revisadas de prática clínica do grupo de trabalho ISHAM-ABPA de 2024 categorizam a ABPA en cinco categorias radiológicas: ABPA sorológica (ABPA-S), ABPA com bronquiectasias (ABPA-B), ABPA com tampão mucoso (ABPA -MP), ABPA com muco de alta atenuação (ABPA-HAM) e ABPA com fibrose pleuropulmonar crônica (ABPA-CPF).32 (Tabela 2)
Tabela 2 — Classificação Radiológica da ABPA
ABPA – CLASSIFICAÇÃO RADIOLÓGICA |
| ABPA-S |
ABPA sorológica |
ABPA sem bronquiectasia |
| ABPA- B |
ABPA com bronquiectasia |
ABPA com bronquiectasias evidentes na TC |
| ABPA-MP |
ABPA com tampão mucoso |
ABPA com tampão mucoso (sem muco de alta atenuação), |
| ABPA-HAM |
ABPA c/ muco alta atenuação |
ABPA com tampão de muco alta atenuação na TC > 70 HU |
| ABPA-CPF |
ABPA c/ fibrose pleuropulmonar |
ABPA c/ fibrose, fibrocavitária, micetoma, espessamento pleural |
|
Nestes pacientes a TC pode identificar imagens como consolidações, nódulos centrolobulares (com aparência de árvore em brotamento), atelectasia e atenuação em mosaico. A TC é importante na identificação do tipo e na distribuição de bronquiectasias e ainda no reconhecimento de tampões de muco, configurando vantagens da TC em relação à radiografia de tórax.34,35 O termo bronquiectasia central foi substituído por simples bronquiectasias, pela constatação que estas podem ser também encontradas em cerca de 40% dos casos nas regiões periféricas dos pulmões.36 A impactação mucoide é um achado em que há obstrução dos brônquios por muco. Na ABPA isso aparece frequentemente associado a bronquiectasias. O muco impactado pode ter densidade variável (baixa, intermediária ou alta). O muco de alta atenuação é um subtipo particular de impactação mucoide, quando o muco apresenta atenuação maior do que o músculo esquelético – músculos paraespinhais na TC de tórax sem contraste – o que é uma característica patognomônica encontrada em pacientes com ABPA.34 A sensibilidade e a especificidade deste achado são de 35% e 100%, respectivamente.26,37 Na ABPA com fibrose crônica podem ser encontadas imagens na TC de fibrose pulmonar, lesões fibro-cavitárias, micetoma, e espessamento pleural.
Opacidades alveolares pulmonares fugazes são comuns,29 podendo também permanecer imutáveis por semanas ou meses, como também podem aumentar. Nódulos centrolobulares representando bronquíolos dilatados e opacificados são detectados.12 Bronquiectasias com impactação mucoide resultam em broncocele, com imagem em “dedo de luva". Isso pode dar uma configuração Y, V ou semelhante à imagem em "pasta de dente". Essas imagens homogêneas digitiformes estão localizadas na árvore brônquica, principalmente nos lobos superiores e quase sempre em brônquios proximais (lobar, segmentar ou subsegmentar de primeira ordem). Podem ocorrer eventualmente atelectasias lobares ou segmentares, coincidindo com a exacerbação da doença, bem como atelectasias que acometem brônquios mais distais. As bronquiectasias são geralmente do tipo cilíndrico e saculares. (Figura 2). Após a expectoração da “rolha” de muco, persiste dilatação brônquica residual, podendo ou não conter imagem hidroaérea. A impactação mucoide tende a reaparecer no mesmo local.
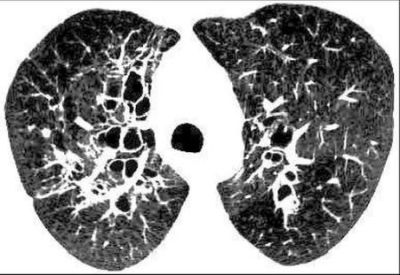
Figura 2 — Corte de tomografia do tórax evidenciando bronquiectasias em paciente com ABPA.
Sob o aspecto de correlação entre achados radiológicos e histopatológicos, os infiltrados pulmonares da ABPA correspondem a áreas de infiltração eosinofílica alveolar. Estas opacificações podem ser lobares, segmentares ou subsegmentares, medindo entre 1 e 5 cm de diâmetro, sendo frequentemente migratórias.29 O diagnóstico diferencial deve ser feito com pneumonias, Bronquiolite Obliterante com Pneumonia Organizada (BOOP), Granulomatose Eosinofílica com Poliangiite (GEPA), pneumonia eosinofílica crônica, que podem também evoluir com eosinofilia, aspergilose necrotizante crônica, tuberculose, pneumonite de hipersensibilidade e outras causas de bronquiectasias.
A broncofibroscopia pode revelar impactação mucoide e o escovado brônquico evidenciar muco que contém agregados de eosinófilos, hifas e cristais de Charcot-Leyden. O achado de tampões de muco pleno de hifas é patognomônico da ABPA. A análise do lavado broncoalveolar (LBA) demonstra: eosinofilia moderada (nos pacientes que não fazem uso de corticoide) e aumento dos níveis da IgE e IgE específicas para Aspergillus mas não de IgG.38 A broncofibroscopia não é recomendada rotineiramente para o diagnóstico de ABPA. Está indicada quando o diagnóstico é incerto, mal definido; nos pacientes com suspeita de infecção crônica (por micobactéria tuberculosa ou não tuberculosa) antes de se iniciar corticoide sistêmico; e naqueles com suspeita de ABPM onde as culturas de escarro não podem ser obtidas ou não são esclarecedoras. Raramente a broncoscopia para remoção de tampões de muco se faz necessária.39-41
Hifas podem ser visualizadas por microscopia no exame do escarro. A cultura de escarro demonstra o Aspergillus de forma intermitente, pois o fungo pode crescer distalmente à obstrução brônquica pelo "tampão" de muco, não sendo encontrado na expectoração. A colonização brônquica pelo fungo pode ser detectada pelo PCR do lavado broncoalveolar em 10 a 20% dos pacientes imunocompetentes e que têm achados clínicos e radiológicos de doença broncopulmonar associada ao Aspergillus.42 A sensibilidade e especificidade da cultura fúngica de escarro são baixas no diagnóstico de ABPA.
As principais características patológicas da ABPA são impactação mucoide dos brônquios, granulomatose broncocêntrica, bronquiectasias e pneumonia eosinofílica.43 Os dois primeiros achados são econtrados em praticamente todos os casos.44 A histopatologia evidencia brônquios irregulares com muco, células inflamatórias e hifas de Aspergillus; paredes brônquicas e parênquima peribrônquico infiltrados por mononucleares e eosinófilos. Um grande número de eosinófilos, células gigantes multinucleadas e a formação de granuloma são encontrados no parênquima nas áreas de consolidação.45 Distal a esses brônquios, exsudativa bronquiolite pode estar presente.44 Em estágios mais avançados, bronquiolite obliterante e fibrose pulmonar podem ocorrer.
Os testes de função pulmonar tipicamente demonstram um padrão obstrutivo em decorrência do broncospasmo ou da impactação brônquica e durante as fases aguda, de exacerbação, refratária e frequentemente na fase crônica. Entretanto, o achado mais frequente da fase crônica é a alteração ventilatória restritiva com redução na Capacidade de Difusão pelo Monóxido de Carbono. (DLCO).
ABPM
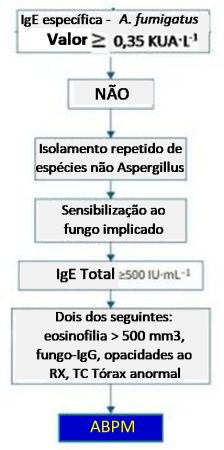
Outros fungos filamentosos, como Penicillium, Curvularia spp. e Schizophyllum commune, podem causar patologia semelhante à ABPA chamada de Allergic Bronchopulmonary Mycosis (ABPM),13,14 quando atribuível a fungos que não sejam Aspergillus spp. A estrutura básica para o diagnóstico de ABPM é semelhante à ABPA, com algumas distinções. (Tabela 3). A ABPM deve ser considerada em pacientes com possível ABPA, mas a IgE específica para A. fumigatus é menor que 0,35 kUA·l -1. A ABPM pode ser sugerida quando um fungo causador é isolado em pelo menos duas amostras de cultura de escarro ou cultura de material de lavado broncoalveolar. A ABPM é confirmada pela demonstração de sensibilização alérgica (teste cutâneo ou IgE específica para fungos), combinada com IgE total sérica elevada e características radiológicas consistentes.46 Infelizmente, ensaios comerciais para detecção de IgE e IgG contra fungos diferentes de Aspergillus spp. estão disponíveis apenas para algumas espécies (Alternaria, Cladosporium, Candida, Mucor, Trichophyton e Penicillium).
Tabela 3 – Sequência para o Diagnóstico da ABPM
Referências
01.Saxena P, Choudhary H, Muthu V, Sehgal IS, Dhooria S, Prasad KT, et al. Which are the optimal criteria for the diagnosis of allergic bronchopulmonary aspergillosis? A latent class analysis. J Allergy Clin Immunol Pract 2021; 9:328-335.e1.
02.Eschenhagen P, Grehn C, Schwarz C. Prospective Evaluation of Aspergillus fumigatus-Specific IgG in Patients With Cystic Fibrosis. Front Cell Infect Microbiol 2021; 10:602836. doi:10.3389/fcimb.2020.602836.
03.Agarwal R, Maskey D, Aggarwal AN, Saikia B, Garg M, Gupta D, et al. Diagnostic performance of various tests and criteria employed in allergic bronchopulmonary aspergillosis: a latent class analysis. PLoS One. 2013; 8:e61105.
04.Hinson KRW, Moon A, Plummer NS. Broncho-pulmonary aspregillosis: a review and a report of eight new cases. Thorax 1952; 7:317-333.
05.Rosenberg M, Patterson R, Mintzer R, Cooper BJ, Roberts M, Harris KE. Clinical and immunologic criteria for the diagnosis of allergic bronchopulmonary aspergillosis. Ann Intern Med 1977; 86:405-14.
06.Agarwal R, Chakrabarti A, Shah A, Gupta D, Meis JF, Guleria R, Moss R, Denning DW; ABPA complicating asthma ISHAM working group. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allerg y 2013; 43:850-73.
07.Asano K, Kamei K, Hebisawa A. Allergic bronchopulmonary mycosis - pathophysiology, histology, diagnosis, and treatment. Asia Pac Allergy 2018; Jul 16; 8(3):e24. doi: 10.5415/apallergy.2018.8.e24. PMID: 30079302; PMCID: PMC6073182.
08.Greenberger PA, Patterson R. Allergic bronchopulmonary aspergillosis and the evaluation of the patient with asthma. J Allergy Clin Immunol 1988; 81:646-50.
09.Pepys J, Riddell RW, Citron KM, Clayton YM, Short EI. Clinical and immunologic significance of Aspergillus fumigatus in the sputum. Am Rev Respir Dis 1959; 80:167-80.
10.Rokas A. Aspergillus. Curr Biol.2013; 23:R187-8. doi: 10.1016/j.cub.2013.01.021. PMID: 23473556.
11.Young RC, Jennings A, Bennett J. Species identification of invasive aspergillosis in man. Am J Clin Pathol 1972; 58:554-7.
12.Davies SF. An Overview of pulmonary fungal infection. Clin in Chest Medicine 1987; 8:495-512.
13.Chowdhary A, Agarwal K, Kathuria S, Gaur SN, Randhawa HS, Meis JF. Allergic bronchopulmonary mycosis due to fungi other than Aspergillus: a global overview. Crit Rev Microbiol 2014; 40:30-48.
14.Sehgal IS, Choudhary H, Dhooria S, Aggarwal AN, Bansal S, Garg M, Behera D, Chakrabarti A, Agarwal R. Prevalence of sensitization to Aspergillus flavus in patients with allergic bronchopulmonary aspergillosis. Med Mycol .2019; Apr 1;57(3):270-276. doi: 10.1093/mmy/myy012. PMID: 29566248.
15.Overton NL, Denning DW, Bowyer P, Simpson A. Genetic susceptibility to allergic bronchopulmonary aspergillosis in asthma: a genetic association study. Allergy Asthma Clin Immunol. 2016;12:47. Published 2016 Sep 27. doi:10.1186/s13223-016-0152-y.
16.Chauhan B, Santiago L, Hutcheson PS, Schwartz HJ, Spitznagel E, Castro M, Slavin RG, Bellone CJ. Evidence for the involvement of two different MHC class II regions in susceptibility or protection in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol 2000; 106:723-9.
17.Chauhan B, Santiago L, Kirschmann DA, Hauptfeld V, Knutsen AP, Hutcheson PS, Woulfe SL, Slavin RG, Schwartz HJ, Bellone CJ. The association of HLA-DR alleles and T cell activation with allergic bronchopulmonary aspergillosis. J Immunol 1997; 159:4072-6.
18.Shaw RR. Mucoid impaction of bronchi. J Thorac Surg 1951; 22:149-63.
19.Johnson RS, Sita-Lumsden EG. Plastic bronchitis. Thorax 1960; 15:32532.
20.Ricketti AJ, Greenberger PA, Mintzer RA et al. Allergic bronchopulmonary aspergillosis. Chest 1984; 86:773-8.
21.França, AT. – Aspergilose broncopulmonar alérgica. 1ª edição. Rio de Janeiro:Studio Alfa Letra & Imagem; 1996.
22.Imbeau SA, Nichols D, Flaherty D et al. Relationships between prednisone therapy, disease activity, and total serum IgE in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol 1978; 62:91-5.
23.Arora S, Huffnagle GB,. Immune regulation during allergic bronchopulmonary mycosis: lessons taught by two fungi. Immunol Res 2005 ;33:53-68.
24.Chen GH, Olszewski MA, McDonald RA, et al. Role of granulocyte macrophage colony-stimulating factor in host defense against pulmonary Cryptococcus neoformans infection during murine allergic bronchopulmonary mycosis. Am J Pathol 2007; 170:1028-1040.
25.Agarwal R, Muthu V, Sehgal IS, Dhooria S, Prasad KT, Soundappan K, Rudramurthy SM, Aggarwal AN, Chakrabarti A. Prevalence of Aspergillus Sensitization and Allergic Bronchopulmonary Aspergillosis in Adults With Bronchial Asthma: A Systematic Review of Global Data. J Allergy Clin Immunol Pract. 2023; 11:1734-1751.e3.
26.Saxena P, Choudhary H, Muthu V, Sehgal IS, Dhooria S, Prasad KT, Garg M, Saikia B, Aggarwal AN, Chakrabarti A, Agarwal R. Which Are the Optimal Criteria for the Diagnosis of Allergic Bronchopulmonary Aspergillosis? A Latent Class Analysis. J Allergy Clin Immunol Pract 2021; 9:328-335 e321.
27.Denning DW, Pfavayi LT. Poorly controlled asthma – easy wins and future prospects for addressing fungal allergy. Allergol Int 2023; 72:493–506.
28.Agarwal R, Aggarwal AN, Sehgal IS, Dhooria S, Behera D, Chakrabarti A. Performance of serum galactomannan in patients with allergic bronchopulmonary aspergillosis. Mycoses 2015; 58:408-12.
29.Kradin, RL. – Understanding Pulmonary Pathology . 1ªed. London:Academic Press; 2017.
30.Malo JL, Hawkins R, Pepys J. Studies in chronic allergic bronchopulmonary aspergillosis. 1: clinical and physiological findings. Thorax 1977; 32:254-61.
31.Malo Jl, Papys J, Simon G. Studies in chronic allergic bronchopulmonary aspergillosis. 2: radiological findings. Thorax 1977; 32:262-8.
32.Agarwal R, Sehgal IS, Muthu V, Denning DW, Chakrabarti A, Soundappan K, et al. Revised ISHAM-ABPA working group clinical practice guidelines for diagnosing, classifying and treating allergic bronchopulmonary. aspergillosis/mycoses. Eur Respir J 2024; 63(4):2400061. doi:10.1183/13993003.00061-2024
33.Lynch DA. Imaging of asthma and allergic bronchopulmonary mycosis. Radiologic Clinics of North America 1998; 36(1):129-42.
.34.Agarwal R, Gupta D, Aggarwal AN, Saxena AK, Chakrabarti A, Jindal SK. Clinical significance of hyperattenuating mucoid impaction in allergic bronchopulmonary aspergillosis: an analysis of 155 patients. Chest 2007; 132:1183-1190.
35.Agarwal R, Gupta D, Aggarwal AN, Behera D, Jindal SK. Allergic bronchopulmonary aspergillosis: lessons from 126 patients attending a chest clinic in north India. Chest 2006; 130:442-448.
36.Agarwal R, Khan A, Garg M, Aggarwal AN, Gupta D. Chest radiographic and computed tomographic manifestations in allergic bronchopulmonary aspergillosis. World J Radiol 2012;:141-50.
37.Agarwal R. High attenuation mucoid impaction in allergic bronchopulmonary aspergillosis. World J Radiol 2010; 2:41-3.
38.Sisodia J, Bajaj T. Allergic Bronchopulmonary Aspergillosis. 2021 Aug 11. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan–. PMID: 31194469.
39.Cosío BG, Shafiek H, Mosteiro M, Iglesias A, Gómez C, Toledo-Pons N, Martinez R, Lopez M, Escribano Gimeno I, Pérez de Llano L. Redefining the Role of Bronchoscopy in the Workup of Severe Uncontrolled Asthma in the Era of Biologics: A Prospective Study. Chest 2023; 164:837-845.
40.
Kodaka N, Nakano C, Oshio T, Watanabe K, Niitsuma K, Imaizumi C, Shimada N, Morita H, Matsuse H. Effectiveness of mucus plug removal by bronchoscopy for typical high-attenuation mucus with allergic bronchopulmonary mycosis. Allergol Int 2022; 71:150-152.
41.Agarwal R, Srinivas R, Agarwal AN, Saxena AK. Pulmonary masses in allergic bronchopulmonary aspergillosis: mechanistic explanations. Respir Care. 2008; 53:1744-8.
42.Tang CM, Holden DW, Aufauvre-Brown A et al. The detection of Aspergillus spp. By polymerase chain reaction and its evaluation in bronchoalveolar lavage fluid. Am Rev Respir Dis 1993; 148: 1313-7.
43.Chetty A. Pathology of allergic bronchopulmonary aspergillosis. Front Biosci 2003; 8:e110-4.
44.Bosken CH, Myers JL, Greenberger PA, Katzenstein AL. Pathologic features of allergic bronchopulmonary aspergillosis. Am J Surg Pathol 1988; 12:216-22.
45.Gupta K, Das A, Joshi K, Singh N, Aggarwal R, Prakash M. Aspergillus endocarditis in a known case of allergic bronchopulmonary aspergillosis: an autopsy report. Cardiovasc Pathol 2010; 19:e137-9.
46.Sehgal IS, Choudhary H, Dhooria S, Aggarwal AN, Garg M, Chakrabarti A, Agarwal R. Is There an Overlap in Immune Response Between Allergic Bronchopulmonary and Chronic Pulmonary Aspergillosis? J Allergy Clin Immunol Pract 2019; 7:969-974.
|