|
Asma
BRONCOCONSTRIÇÃO COMO ESTÍMULO PRÓ-INFLAMATÓRIO
Os mecanismos subjacentes da asma ainda carecem de uma definição adequada. Hoje, compreendemos que a broncoconstrição resulta da complexa interação de mediadores liberados por diversas células, desencadeando inflamação crônica que, por sua vez, resulta em um controle anormal do calibre das vias respiratórias.
Entretanto, uma pesquisa recente traz à tona um novo paradigma na compreensão da asma.1 Essas pesquisas salientam o estímulo pró-inflamatório que a broncoconstrição apresenta, não sendo somente uma consequência, mas também um ativo elemento participante da própria sequência inflamatória da doença.2,3
Bagley et al.1 identificaram exatamente esse mecanismo. Usando modelos de camundongos e amostras de ressecção de tecido de pulmão humano, relataram evidências convincentes de que a broncoconstrição é um fenômeno mecânico que comprime a camada epitelial, causando apinhamento celular. Por sua vez, essa aglomeração causa pronunciada extrusão de células epiteliais da camada epitelial das vias aéreas, o que ocasiona ruptura epitelial, ocasionando dano ao seu papel de barreira ao meio ambiente e, em consequência, favorece a penetração de alérgenos, patógenos e irritantes para locais que de outra forma não poderiam atingir, com a subsequente liberação de mediadores inflamatórios. A broncoconstrição pode assim desnudar o epitélio e dele retirar a sua função, provocando inflamação e hipersecreção de muco e, por esse motivo, os pacientes após o episódio apresentam inflamação que persiste por semanas ou até mesmo meses.
Este estudo, fundamentado em experimentos com modelos animais, demonstra que é possível prevenir tais mecanismos bloqueando a via de extrusão ou inibidores de esfingosina-1 fosfato (S1P), resultando na redução da resposta inflamatória subsequente.1
Os tecidos epiteliais devem manter sua integridade para desempenhar efetivamente suas funções de barreira. Um aspecto vital dessa regulação envolve a renovação e a eliminação de células através do processo de apoptose, um processo fisiológico essencial para eliminação de células defeituosas. As células mortas são então expelidas para assegurar a integridade da barreira epitelial funcional e a adesão contínua das células.4 Esse processo de extrusão é mediado pelas células destinadas à morte, que sinalizam às células epiteliais adjacentes para contrair. Forma-se então um anel de actomiosina de células contíguas cuja contração é essencial para a extrusão das células em processo de apoptose.4-6 O anel de actomiosina é formado em tecidos epiteliais por células vizinhas que "identificam" o apinhamento ou sinal de morte celular e se coordenam para formar essa estrutura contrátil. Vale ressaltar que isso acontece de um modo bem organizado e hierárquico, nada espontâneo. O posicionamento do anel de actomiosina não é arbitrário: ele ocorre em domínio específico para que a contração gere mudança de forma celular eficiente e direcional.7
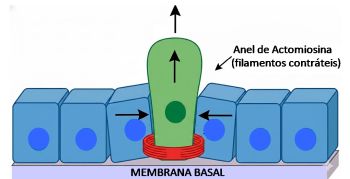
Figura 1 – A figura mostra uma célula central destacada em verde, sob compressão. Um anel de actomiosina em vermelho está contraindo ao redor desta célula, impulsionando sua expulsão. As células circundantes denotam estar comprimindo ativamente a célula. As setas indicam a direção da extrusão (para cima) e as forças pressoras.
Entretanto, o sistema possui um limite inerente que só pode suportar uma proporção ou taxa específica de eliminação celular (extrusão), assim como certas distribuições espaço-temporais. Bagley et al. sugeriram que a sobrecarga patológica resultante decorrente de uma broncoconstrição desencadearia uma quantidade tão significativa de extrusão celular que poderia comprometer a integridade da barreira epitelial das vias aéreas.1 Esta extrusão patológica de células epiteliais pode constituir a base da lesão e remodelação das vias aéreas na asma, com reparo aberrante, destacando-se que esse processo de extrusão não é inibido pelos tratamentos tradicionais como corticoides inalatórios e até mesmo biológicos.
Essa condição resultaria na perda de integridade da barreira, não apenas comprometendo a estabilização mecânica do tecido e interferindo na morfogênese, mas também potencialmente desencadeando inflamação crônica com liberação de mediadores pró-fibróticos,8 que acarretam fibrose subepitelial, hipertrofia do músculo liso das vias aéreas e deposição do colágeno, criando um ciclo de inflamação e reparo que leva à remodelação.
Assim, buscaram uma estratégia para interromper a extrusão e prevenir os danos causados pela broncoconstrição. Já se tinha conhecimento de que, em células vivas, na extrusão induzida pela aglomeração o canal ativado Piezo1 atua como mecanossensor equilibrando a extrusão com proliferação,
onde sua ativação por estiramento desencadeia a produção do lipídeo bioativo esfingosina quinase para produzir o lipídeo bioativo esfingosina-1-fosfato (S1P) nas células extrusoras, que se liga às células vizinhas pelo receptor S1PR2 que desencadeia a via de sinalização da Rho para formar e contrair o anel multicelular de actomiosina que expulsa eficientemente células alvo da monocamada (Figura 2).8 Assim, para inibir o Piezo1, bem como outros potenciais canais de proteína receptora transitória (TRP), foram utilizados cloreto de hexahidrato de gadolínio (Gd 3+) e um inibidor seletivo de TRPC1 como o
GsMTx4.
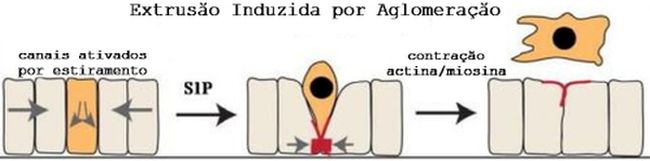
Figura 2 – Esquema da extrusão em células vivas - durante o processo de extrusão, uma aglomeração de células epiteliais localizada desencadeia a extrusão (representada pela célula cor laranja) através dos canais ativados por estiramento. A célula extrusora segrega S1P para que as células contíguas promovam a formação e contração de um anel de actina/miosina que impulsiona a ejeção da célula do tecido epitelial. Figura retirada com modificações de Eisenhoffer GF and Rosenblatt J. Trends Cell Biol 2013;23:185-92.9
Os resultados tanto ex vivo como in vivo em murinos sugerem que o bloqueio do processo pelo Gd 3+, isoladamente ou em associação ao salbutamol, podem prevenir a extrusão e morte celular epitelial e a consequente inflamação e o muco que resultam de um ataque de asma, oferecendo maior proteção do epitélio das vias aéreas, embora a sua segurança na utilização em humanos ainda não tenha sido avaliada.
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
Referências
01.Bagley DC, Russell T, Ortiz-Zapater E, Stinson S, Fox K, Redd PF, Joseph M, Deering-Rice C, Reilly C, Parsons M, Brightling C, Rosenblatt J. Bronchoconstriction damages airway epithelia by crowding-induced excess cell extrusion. Science 2024; 384:66-73.
02.Tschumperlin DJ, Dai G, Maly IV, Kikuchi T, Laiho LH, McVittie AK, Haley KJ, Lilly CM, So PT, Lauffenburger DA, Kamm RD, Drazen JM. Mechanotransduction through growth-factor shedding into the extracellular space. Nature 2004; 429:83-6.
03.Grainge CL, Lau LC, Ward JA, Dulay V, Lahiff G, Wilson S, Holgate S, Davies DE, Howarth PH. Effect of bronchoconstriction on airway remodeling in asthma. N Engl J Med 2011; 364:2006-15.
04.Rosenblatt J, Raff MC, Cramer LP. An epithelial cell destined for apoptosis signals its neighbors to extrude it by an actin- and myosin-dependent mechanism. Curr Biol 2001; 11:1847-57.
05.Gu Y, Forostyan T, Sabbadini R, Rosenblatt J. Epithelial cell extrusion requires the sphingosine-1-phosphate receptor 2 pathway. J Cell Biol 2011; 193:667-76.
06.Slattum G, McGee KM, Rosenblatt J. P115 RhoGEF and microtubules decide the direction apoptotic cells extrude from an epithelium. J Cell Biol 2009; 186:693-702.
07.Green RA, Paluch E, Oegema K. Cytokinesis in animal cells. Annu Rev Cell Dev Biol 2012; 28:29-58.
08.Castillo JR, Peters SP, Busse WW. Asthma Exacerbations: Pathogenesis, Prevention, and Treatment. J Allergy Clin Immunol Pract 2017; 5:918-927.
09.Eisenhoffer GT, Rosenblatt J. Bringing balance by force: live cell extrusion controls epithelial cell numbers. Trends Cell Biol 2013; 23:185-92.
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|