|
Asma
TIPOS DE ASMA
ASMA PERIMENSTRUAL
Estima-se que aproximadamente 20% das mulheres apresentam piora de sua asma no período perimenstrual. Sanchez-Ramos et al.1 em revisão sistemática e metanálise, em 2017, concluíram que essas mulheres tendem a ser mais velhas, têm asma mais grave, propensão a exacerbações, são altamente sintomáticas, com maior índice de massa corporal, apresentam maior tempo de asma e maior probabilidade de asma sensível à aspirina. Relatam frequentemente síndrome dismenorreica, ciclos menstruais mais curtos e sangramento menstrual mais prolongado.1
A piora da asma com aumento na variabilidade do Pico de Fluxo Expiratório (PFE) se desenvolve no 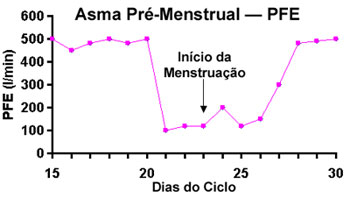 período de dois a cinco dias que antecede a menstruação (Figura 1). Na atualidade acredita-se que este tipo particular de asma ocorra em mulheres que já apresentem um certo grau de resistência aos corticoides. período de dois a cinco dias que antecede a menstruação (Figura 1). Na atualidade acredita-se que este tipo particular de asma ocorra em mulheres que já apresentem um certo grau de resistência aos corticoides.
Hanley2 submeteu 102 pacientes asmáticas a um questionário avaliando a relação entre os sintomas de asma e o ciclo menstrual. Trinta e seis relataram piora por ocasião da menstruação, com redução significativa do PFE. Gibbs et al.3 em protocolo semelhante, medindo o PFE duas vezes ao dia, detectaram piora clínica e funcional em cerca de 40% das pacientes. Eosinófilos no escarro e a fração exalada do óxido nítrico (FeNO) são citados como significativamente aumentados durante a fase pré-menstrual em comparação com a fase imediatamente pós-catamenial, indicando variação cíclica na inflamação.4 Um estudo prospectivo com 182 mulheres entre 13 anos até a menopausa demonstrou aumento de até quatro vezes na frequência de visitas ao serviço de emergência, nos sete dias que antecediam a menstruação
(dia 26 ao dia 4 de um ciclo de 28 dias) – 46% das visitas na fase perimenstrual,5 sendo que algumas pacientes necessitaram de hospitalização e até suporte ventilatório mensal.6 Outras publicações, entretanto, como a de Zimmerman et al.7 evidenciaram que somente 28% das 288 visitas à emergência por exacerbação de asma aguda ocorreram na fase perimenstrual, enquanto que 33% na fase pré-ovulatória. Brenner et al.8 em estudo que incluiu 792 visitas de mulheres à emergência por asma aguda, obtiveram resultados que também divergiam dos de Skobeloff e cols.,5 observando 28% das visitas na fase pré-ovulatória e 27% na perimenstrual.
Nas mulheres em período fértil ocorrem alterações periódicas mensais nas taxas de secreção dos hormônios sexuais.9 Este padrão rítmico é chamado de ciclo sexual feminino e dura em média 28 dias (Figura 2). Este ciclo, entretanto, pode ser de 20 dias ou atingir 45 dias mesmo em mulheres completamente normais.

Durante o ciclo os níveis de estrogênios e de progesterona se elevam e caem.
Durante os 4 dias após a menstruação, os níveis séricos de FSH, LH, estrogênio e progesterona são baixos. Sob a influência do estrogênio, secretado em quantidades cada vez maiores pelos ovários durante a primeira parte do ciclo, ocorre a chamada fase proliferativa ou fase estrogênica, quando o endométrio aumenta muito a sua espessura. Entre o 12º e 16º dias os níveis de progesterona permanecem baixos, enquanto os níveis de FSH, LH e estrogênio atingem o ápice. Durante a ovulação, que ocorre no 14º–15º dias do ciclo, acontece o pico de estrogênio. Posteriormente, na segunda metade do ciclo, os níveis de FSH e LH caem e os de estrogênio e progesterona são secretados em grandes quantidades (porém mais progesterona) pelo corpo lúteo, sucedendo-se uma elevação mantida destes hormônios entre o 19º–25º dias do ciclo, cujo sinergismo causa considerável espessamento endometrial, que praticamente dobra durante a fase secretora do ciclo. Na ausência de gravidez e estimulação hormonal por hCG, a função do corpo lúteo diminui espontaneamente 9 a 10 dias após a ovulação, processo este mediado pela progesterona. Os hormônios estrogênio e progesterona caem abruptamente a níveis de secreção muito baixos quando ocorre a menstruação, pondo fim ao ciclo ovariano.9
Estudos relataram piora dos sintomas da asma, diminuição das taxas de PFE e aumento do uso de medicamentos de resgate em mulheres com asma durante a fase pré-menstrual ou perimenstrual do ciclo, correspondendo a baixos níveis de progesterona e estrogênio.10
No homem não existem estas variações dia a dia ou semana a semana. A testosterona alcança seu pico máximo na adolescência, ocorrendo então redução muito lenta e gradual nos níveis séricos até a terceira idade.
Acredita-se que estas oscilações hormonais na mulher sejam responsáveis pela maior tendência à asma brônquica. A hiper-responsividade brônquica está usualmente aumentada no período perimenstrual, apresentando-se exacerbada em pacientes sintomáticas. Baseados na flutuação dos níveis de estradiol, Skobeloff et al.5 dividiram o ciclo feminino em quatro, cada um deles com 7 dias de intervalo: pré-ovulatório (dias 5 a 11), periovulatório (dias 12 a 18), pós-ovulatório (dias 19 a 25) e perimenstrual (dias 26 a 4) e propuseram que a flutuação dinâmica do estrogênio após a elevação sustentada da segunda fase (secretória) do ciclo é que era a responsável pelas alterações nos mediadores inflamatórios nas vias aéreas. Este trabalho foi posteriormente confirmado por Cydulka e Emerman,11 que avaliaram 69 mulheres atendidas em serviço de emergência universitário. Concluíram que não havia correlação entre os valores absolutos do estradiol sérico com a gravidade do broncospasmo, com a resposta ao broncodilatador ou com a admissão hospitalar para tratamento da asma. Assim atribuíram a queda brusca dos níveis de estrogênio após o plateau pós-ovulatório como fator determinante para a asma perimenstrual.
Uma outra vertente relaciona a asma perimenstrual à queda da progesterona e à elevação da relação estrogênio-progesterona. Esta teoria baseia-se na hipótese de que a progesterona normalmente determina uma ação protetora, possivelmente anti-inflamatória nestas pacientes. Apesar desses estudos clínicos, os mecanismos celulares pelos quais os hormônios sexuais regulam o processo fisiopatológico da asma não são totalmente compreendidos.
Os hormônios sexuais são poderosos moduladores imunológicos e inflamatórios.12 A maioria, senão todos, desses efeitos não foram testados em relação à asma ou ao agravamento perimenstrual, mas podem ser relevantes. Os mecanismos que valem à pena considerar incluem os efeitos dos hormônios femininos na inflamação da mucosa brônquica.13
Dois receptores são descritos para estrogênios (ER) ERa e ERß acoplados à proteína G.12,14,15 As células epiteliais brônquicas humanas expressam ambos os receptores – a e ß e são responsivas à exposição ao estrogênio.
O tratamento dessas células com estrogênio gera o NOS endotelial e consequente produção de óxido nítrico
que pode resultar em broncodilatação em mulheres com asma.16 De modo igual, a mesma dose de estrogênio relaxa o músculo liso das vias aéreas e leva à broncodilatação.17A maioria das células imunes expressa receptores de estrogênio (ERa, ERß ou o ER acoplado à proteína G ligado à membrana) em vários graus e pode responder ao hormônio. Isto significa dizer que a sinalização de estrogênio afeta praticamente todas as células do sistema imunológco18 e respiratório. Por exemplo,
em modelos de asma, o estrogênio pode reduzir a contração traqueal ao ativar vias que promovem a abertura de canais de potássio, induzindo relaxamento do músculo liso por meio da hiperpolarização celular.19
Não existe, entretanto, um efeito único e universal. Estrogênios e progesterona podem exercer efeitos contraditórios dependendo de: dose, via (aguda vs crônica), tipo de receptor ativado (ERa, ERß, receptores não genômicos), células-alvo (músculo liso das vias aéreas, epitélio, mastócitos, eosinófilos) e do contexto (obesidade, inflamação alérgica, uso de medicação).20,21 Têm efeitos relaxantes diretos sobre a musculatura lisa das vias aéreas em estudos experimentais (aumento de cAMP, efeitos rápidos não genômicos) sugerindo potencial broncodilatador em certos contextos.20
Desta forma, diversos estudos comprovaram que mastócitos expressam receptores de estrogênio (ERs) e progesterona (PRs),22,23 confirmando que hormônios sexuais regulam sua biologia.24 Especificamente, o estradiol (e compostos estrogênicos ambientais) promove a ativação de mastócitos e aumenta sua sensibilidade à desgranulação e intensifica a liberação de mediadores alérgicos (como histamina, prostaglandinas, leucotrienos) em respostas dependentes de IgE.23,25-28 Zaitsu et al. demonstraram que parte desses efeitos ocorre via ativação não genômica do ERa, desencadeando influxo downstream de cálcio extracelular como mecanismo subjacente.23
Como uma das características da asma perimenstrual é a ausência de resposta ao corticoide, mesmo em altas doses, embora responda a altas doses de progesterona,6 acredita-se que esta constatação derive de certa resistência, que deve ser regulada pelos níveis endógenos de hormônios sexuais femininos. Esta resistência parece decorrer da competição nos sítios de ligação dos receptores de corticoides (GR), pois os receptores de estrogênio e progesterona apresentam semelhanças estruturais com o GR.
Kalkhoveng et al.29 descreveram a interação entre o receptor da progesterona e o fator de transcrição NF-kB (nuclear factor kB), sugerindo que uma queda na progesterona possa aumentar a ativação do NF-kB. Como os corticoides bloqueiam o NF-kB, e na asma perimenstrual ocorre resistência ao corticoide, isto pode indicar que exista excessiva formação de NF-kB nestas pacientes. O NF-kB é uma proteína necessária para máxima transcrição de muitas moléculas pró-inflamatórias que são importantes na geração da inflamação e em sua amplificação, incluindo moléculas de adesão intercelular como a ICAM-1, enzimas como a COX-2 e a iNOS e a maior parte das citocinas como IL-1ß, TNF-a, IL-6 e quimiocinas como a IL-8, RANTES, MCP-1, MIP-1a e Eotaxina.30-32 O NF-kB é também importante na ativação de células T, na upregulation da IL-2 e receptores IL-2.33
Em modelo experimental translacional (murinos) a progesterona aumentou os escores histológicos inflamatórios totais, aumentou a hiper-responsividade à metacolina (MCh), aumentou as quimiocinas selecionadas no lavado broncoalveolar (LBA) e no soro, e aumentou o número de células ILC2 e neutrófilos ao longo das vias aéreas em comparação com os animais do grupo placebo. Puderam concluir que as ILC2 humanas também são hiper-responsivas à progesterona e à IL-33 e provavelmente contribuem para as exacerbações após exposição das vias aéreas a alérgenos em mulheres com asma.34
A obesidade está significativamente associada ao desenvolvimento de asma, ao agravamento dos sintomas e ao mau controle da doença. Ainda não se dispõe de estudos direcionados à associação entre obesidade e asma perimenstrual, entretanto, existem fortes indícios de que a combinação da obesidade com as flutuações hormonais características do ciclo feminino pode intensificar a asma perimenstrual, conforme sugerido em modelos animais e interações hormonais.35
A associação de asma perimenstrual com a doença respiratória exacerbada pela aspirina é especialmente interessante.36 A aspirina e os anti-inflamatórios não hormonais (AINHs) inibem de forma irreversível a enzima ciclo-oxigenase-1 (COX-1). A maior frequência de asma induzida por aspirina (AIA) em mulheres com asma perimenstrual ocorre porque as flutuações hormonais características do ciclo menstrual (principalmente o aumento prévio do estrogênio seguido por sua queda abrupta na perimenstruação) criam um ambiente nas vias aéreas que amplifica dramaticamente o efeito patológico central da aspirina. Isto potencializa a produção de leucotrienos (via aumentos da 5-LO); reduz a proteção broncodilatadora e antileucotrieno da PGE2, aumenta a hiper-responsividade das vias aéreas e induz à inflamação eosinofílica.37,38 O estrogênio também modula a expressão de receptores de leucotrienos, podendo explicar por que as mulheres são mais sensíveis à via leucotrienos em certos períodos do ciclo.
Na asma perimenstrual há relatos de redução no número de ß2-receptores em linfócitos circulantes, sugerindo que a resposta aos broncodilatadores ß2-agonistas possa estar deprimida nestas pacientes.39 Há algum tempo já sabemos que a progesterona determina upregulation dos receptores beta-adrenérgicos em mulheres sadias, quando os níveis de estrogênio são mantidos em níveis normais.39 Tan et al.40 demonstraram que, na mulher adulta com asma, a progesterona causa uma downregulation paradoxal dos receptores ß nos linfócitos. Esta downregulation dos receptores ocasiona uma baixa resposta do AMPc ao isoproterenol e outros ß-agonistas. Estes autores chegaram a propor que este efeito paradoxal da progesterona em pacientes com asma seria a causa determinante para o mau funcionamento dos receptores ß-adrenérgicos, ocasionando a asma perimenstrual, quando os níveis de progesterona se encontram elevados na fase secretória do ciclo que antecede à menstruação.40
A asma pré-menstrual é considerada na atualidade como um "marcador" de doença severa, ocorrendo maior número de hospitalizações neste grupo.41
Há relatos na literatura de episódios fatais atribuídos a essa condição, incluindo o caso descrito por Barkman, que documenta a morte súbita por asma pré-menstrual em duas irmãs.42
Tratamento
O tratamento da asma perimenstrual é o mesmo proposto pelos guidelines. Entretanto, algumas mulheres devido à gravidade da doença, podem necessitar, na segunda metade do ciclo menstrual, de aumento na dose do esquema de manutenção do corticoide por inalação (CI) com o CI-formoterol.43 Os antagonistas de receptor de leucotrienos também podem ser úteis.1
Embora não haja aprovação específica para biológicos na asma perimenstrual, evidências clínicas apoiam seu uso em casos graves refratários ao tratamento convencional, especialmente quando há componente eosinofílico ou alérgico. A escolha do biológico deve considerar o perfil imunológico da paciente e ser individualizado.
A presença de receptores de esteroides sexuais nos mastócitos sugere que esses hormônios desempenham um papel na regulação de processos biológicos por meio da interação com esses receptores.44 Estudos indicam que o estrogênio exógeno e a progesterona podem contribuir para o controle da asma perimenstrual.14,45
São poucos os estudos que avaliam a pílula anticoncepcional para o tratamento da asma perimenstrual. Não se dispõe de controle adequado dos vários medicamentos utilizados, sendo a apreciação do status alérgico muitas vezes falho. Não existem estudos comparando sintomas ou função pulmonar com as várias doses administradas ou tipo de contraceptivo hormonal oral utilizado. Entretanto, parece não haver dúvida de que este tipo de terapêutica pode eliminar as flutuações hormonais do ciclo feminino.
A utilização de anticoncepcional oral se faz há longa data na asma quando as pacientes não conseguem controle com o tratamento convencional.
A resposta é individual — algumas pacientes melhoram, outras não veem benefício, e raramente pode haver piora.
Não há ainda grandes ensaios randomizados que permitam recomendar universalmente, mas a Estratégia Global para o Tratamento e Prevenção da Asma (GINA) cita a opção como tratamento complementar, parte do manejo individualizado.
Tan et al.46 realizaram avaliação com 18 mulheres asmáticas, divididas em dois grupos: um utilizando contraceptivo oral e outro sem uso da medicação. No grupo que fazia uso da pílula anticoncepcional, não foram observadas alterações significativas na responsividade brônquica ao longo do ciclo hormonal. Em contraste, entre as participantes que não utilizavam contraceptivos orais, verificou-se um aumento da responsividade das vias aéreas durante determinadas fases. Esse efeito parece estar relacionado à ação da pílula, que suprime a elevação dos hormônios sexuais na fase lútea do ciclo menstrual, contribuindo para a estabilização da responsividade brônquica e, consequentemente, para a redução da variabilidade diurna do pico de fluxo expiratório (PFE).46
Murphy e Gibson47 avaliaram os efeitos do uso de anticoncepcionais orais e a relação entre asma perimenstrual e os sintomas pré-menstruais. Foram acompanhadas 28 mulheres com asma, prospectivamente por pelo menos 12 semanas ao longo de 2–4 ciclos menstruais consecutivos. Concluíram que os anticoncepcionais não proporcionam proteção e a utilização de medicamentos de alívio aumentou em 57%.
Estudo embasado em Pesquisas Nacionais de Saúde Escocesa, abrangendo um total de 3.257 mulheres não grávidas, entre 16 e 45 anos, evidenciaram que mulheres com sobrepeso e obesas que faziam uso de contraceptivos orais combinados ou em preparações apenas de progesterona apresentavam redução nos episódios de asma. Achados interessantes que apontam para complexas interações hormonais ⇔ obesidade ⇔ asma, em que o uso de contraceptivos hormonais pode reduzir as exacerbações da asma.48
Nwaru e Sheikh49 utilizando o Optimum Patient Care Research Database
(OPCRD), um banco de dados de cuidados primários do Reino Unido, efetuaram estudo de coorte aberto retrospectivo de mulheres na idade reprodutiva, entre 16 a 45 anos de idade (n = 564.896) acompanhadas entre os anos 2000 e 2016. Concluíram após análise dos registros para o risco substancialmente reduzido de casos novos de asma observado em mulheres que usam contraceptivos hormonais em comparação àquelas que não usam. Isto fornece evidência mais clara para um impacto relevante dos anticoncepcionais hormonais quanto à prevenção primária da asma em mulheres em idade reprodutiva.
Estudo mais recente utilizando o Clinical Practice Research Datalink do Reino Unido analisou 261.827 mulheres (18–50 anos) com asma, comparando não usuárias de contraceptivo oral com usuárias da pílula combinada ou de progesterona isolada (2004–2020). Foram avaliados casos de asma incidente, necessidade de corticoide oral, atendimento de emergência ou óbito relacionado à doença. A pílula combinada não mostrou influência na ocorrência de asma. Entretanto, a pílula apenas de progesterona foi associada a risco 39% maior de asma, especialmente em mulheres com menos de 35 anos, sendo o risco 20% maior naquelas que usavam menos medicação (como corticoides inalatórios – CIs) e 24% mais elevado quando de eosinofilia.50
Embora existam fundamentos para que o tratamento hormonal com anticoncepcionais possa ser instituído no tratamento da asma, mais pesquisas são necessárias, mais evidências para apoiar esta conduta. No entanto, teremos de avaliar o risco-benefício, equilibrando o risco de eventos adversos ao tratamento hormonal, que apresenta o potencial de efeitos colaterais cardiovasculares graves,51-55 pois é bem conhecida a maior tendência à trombose face as múltiplas alterações nos fatores de coagulação e na vasculatura.53-55 Esse risco varia de acordo com o tipo do estrogênio e a quantidade de progestogênio.53 A doença cerebrovascular que inclui o acidente vascular cerebral isquêmico e o acidente vascular hemorrágico junto à doença coronariana isquêmica têm maior probabilidade de ocorrer em quem faz uso de anticoncepcionais orais.52,54
Apesar das pílulas anticoncepcionais evoluírem para muitos formatos diferentes, podem apresentar, além do já descrito, outros efeitos colaterais e riscos como ganho de peso e distúrbios de humor (labilidade emocional e depressão).56,57
Mulheres com obesidade grave e risco cardiovascular elevado devem ser avaliadas cuidadosamente antes de usar estrogênio.
Em lúpus eritematoso sistêmico ativo ou síndrome antifosfolipídica (SAF),
a contracepção apenas com progesterona deve ser considerada.58
Figura 3 – Fluxograma Clínico para Abordagem de Asma Perimenstrual (APM)
 , ,
Referências
01.Sanchez-Ramos JL, Pereira-Vega AR, Alvarado-Gomez F, Maldonado-Perez JA, Svanes C, Gomez-Real F. Risk factors for premenstrual asthma: a systematic review and meta-analysis. Expert Rev Respir Med 2017;11:57-72.
02.Hanley SP. Asthma variation with menstruation. Br J Dis Chest 1981; 75:306-8.
03.Gibbs CJ, Coutts II, Lock R, Finnegan OC, White RJ. Premenstrual exacerbation of asthma. Thorax 1984; 39:833-36.
04.Oguzulgen IK, Turktas H, Erbas D. Airway inflammation in premenstrual asthma. J Asthma 2002; 39:517-22.
05.Skobeloff EM, Spivey WH, Silverman R, Eskin BA, Harchelroad F, Alessi TA. The effect of the menstrual cycle on asthma presentations in the emergency department. Arch Intern Med 1996; 156:1837-40.
06.Beynon H, Garbett N, Barnes PJ. Severe premenstrual exacerbations of asthma. Effect of intramuscular progesterone. Lancet 1988; 2:370-2.
07.Zimmerman JL, Woodruff PG, Clark S, Camargo CA.
Relation between phase of menstrual cycle and emergency department visit for acute asthma. Am J Respir Crit Care Med 2000; 162:512-5.
08.Brenner BE, Holmes TM, Mazal B, et al. Relation between phase of the menstrual cycle and asthma presentations in the emergency department. Thorax 2005; 60:806-9.
09.Erickson GF. Follicular growth and development. In: Sperloff, Simpson, Sciarra, editors. Gynecology and obstetrics. Vol. 5. Philadelphia: Lippincott, 1991 .
10.Thornton J, Lewis J, Lebrun CM, et al. Clinical characteristics of women with menstrual-linked asthma. Respir Med 2012; 106:1236-43.
11.Cydulka RK, Emerman CL. Serum estradiol levels in women with acute exacerbations of asthma
(abstract). Acad Emerg Med 1997; 4:481.
12.Douin-Echinard V., Calippe B., Billon-Galès A., Fontaine C., Lenfant F., Trémollières F., Bayard F., Guéry J.C., Arnal J.F., Gourdy P. Estradiol administration controls eosinophilia through estrogen receptor-alpha activation during acute peritoneal inflammation. J Leukoc Biol 2011;90: 145–154.
13.Vrieze, A., Postma, D. S., and Kerstjens, H. A. Perimenstrual asthma: a syndrome without known cause or cure. J. Allergy Clin. Immunol 2003; 112:271-282.
14.Graziottin A., Serafini A. Perimenstrual asthma: From pathophysiology to treatment strategies. Multidiscip Respir Med 2016; 11:30.
15.Beato M., Herrlich P., Schütz G. Steroid hormone receptors: Many actors in search of a plot. Cell 1995; 83:851–857.
16.Townsend EA, Meuchel LW, Thompson MA, Pabelick CM, Prakash YS. Estrogen increases nitric-oxide production in human bronchial epithelium . J Pharmacol Exp Ther 2011; 339:815–24.
17.Townsend EA, Thompson MA, Pabelick CM, Prakash YS. Rapid effects of estrogen on intracellular Ca2+ regulation in human airway smooth muscle . Am J Physiol Lung Cell Mol Physiol 2010; 298:L521–30.
18.Keselman A, Heller N. Estrogen Signaling Modulates Allergic Inflammation and Contributes to Sex Differences in Asthma Front Immunol. 2015; 6:568. Published 2015 Nov 16. doi:10.3389/fimmu.2015.00568.
19.Dimitropoulou C, White RE, Ownby DR, Catravas JD. Estrogen reduces carbachol-induced constriction of asthmatic airways by stimulating large-conductance voltage and calcium dependent potassium channels. Am J Respir Cell Mol Biol. 2005; 32(3):239-247.
20.Townsend EA, Sathish V, Thompson MA, Pabelick CM, Prakash YS. Estrogen effects on human airway smooth muscle involve cAMP and protein kinase A. Am J Physiol Lung Cell Mol Physiol 2012; 303(10):L923-8.
21.Borrelli R, Brussino L, Lo Sardo L, Quinternetto A, Vitali I, Bagnasco D, Boem M, Corradi F, Badiu I, Negrini S, Nicola S. Sex-Based Differences in Asthma: Pathophysiology, Hormonal Influence, and Genetic Mechanisms. Int J Mol Sci 2025; 26(11):5288.
22.Jensen F, Woudwyk M, Teles A, Woidacki K, Taran F, Costa S, Malfertheiner SF, Zenclussen AC. Estradiol and progesterone regulate the migration of mast cells from the periphery to the uterus and induce their maturation and degranulation. PLoS One 2010; 5(12):e14409.
23.Zaitsu M, Narita S, Lambert KC, Grady JJ, Estes DM, Curran EM, Brooks EG, Watson CS, Goldblum RM, Midoro-Horiuti T. Estradiol activates mast cells via a non-genomic estrogen receptor-alpha and calcium influx. Mol Immunol 2007; 44(8):1977-85.
24.Zierau O, Zenclussen AC, Jensen F. Role of female sex hormones, estradiol and progesterone, in mast cell behavior. Front Immunol 2012; 3:169.
25. Kim MS, Chae HJ, Shin TY, Kim HM, Kim HR. Estrogen regulates cytokine release in human mast cells. Immuno pharmacol Immunotoxicol 2001; 23(4):495-504.
26 Munoz-Cruz S, Mendoza-Rodriguez Y, Nava-Castro KE, Yepez-Mulia L, Morales-Montor J. Gender-related effects of sex steroids on histamine release and Fc e RI expression in rat peritoneal mast cells. J Immunol Res 2015; 2015:351829.
27.
Narita S, Goldblum RM, Watson CS, Brooks EG, Estes DM, Curran EM, Midoro-Horiuti T.
Environmental estrogens induce mast cell degranulation and enhance IgE mediated release of allergic mediators. Environ Health Perspect 2007; 115(1):48-52.
28.Vliagoftis H, Dimitriadou V, Boucher W, Rozniecki JJ, Correia I, Raam S, Theoharides TC.
Estradiol augments while tamoxifen inhibits rat mast cell secretion. Int Arch Allergy Immunol 1992; 98(4):398-409.
29.Kalkhoveng E, Wissink S, Van Der Saag PT, Van Der Burg B. Negative interaction between the Rel A (p65) subunit of NF- k B and the progesterone receptor. J Biol Chem 1996; 271:6217.
30.Blackwell TS, Christman JW. The role of nuclear factor kappa B in cytokine gene regulation. Am J Respir Cell Mol Biol 1997; 17:3-9.
31.Blackwell TS, Lancaster LH, Christman JW. Nuclear factor kappa B: a pivotal role in the systemic response syndrome and new target for therapy. Intensive Care Med 1998; 24:1131-8.
32.Siebenlist U, Franzoso G, Brown K. Structure, regulation and function of NF-kB. Ann Rev Cell Biol 1994; 10:405-55.
33.Lenardo MJ, Baltimore D. NF- k B: a pleiotropic mediator of inducible and tissue-specific gene control. Cell 1989; 58:227-9.
34.Trivedi S, Deering-Rice CE, Aamodt SE, Huecksteadt TP, Myers EJ, Sanders KA, Paine R 3rd, Warren KJ. Progesterone amplifies allergic inflammation and airway pathology in association with higher lung ILC2 responses. Am J Physiol Lung Cell Mol Physiol 2024; 327(1):L65-L78.
35.Ribeiro, Martina Raissa. Estudo da interação da obesidade com os hormônios sexuais femininos em modelo murino de asma mista. [Dissertação de Mestrado] – Universidade de São Paulo, São Paulo, 2021.
36.
Forbes L, Jarvis D, Bumey P. Is pre-menstrual asthma related to use of aspirin or non-steroidal anti-inflammatory drugs? Respir Med 2000; 94:828-829.
37.Gonzalez-Uribe V, Romero-Tapia SJ, Castro-Rodriguez JA. Asthma Phenotypes in the Era of Personalized Medicine. J Clin Med 2023; 12(19):6207.
38.Espersen J, Weber U, Römer-Franz A, Lenarz T, Stolle SRO, Warnecke A. Level of sex hormones and their association with acetylsalicylic acid intolerance and nasal polyposis. PLoS One 2020; 15(12):e0243732.
39.Tan KS, McFarlane LC, Coutie WJ, Lipworth BJ. The effect of exogenous female sex hormones on lymphocyte Beta 2 -adrenenoceptors in normal females. Br J Clin Pharmacol 1996; 41:414-6.
40.Tan KS, McFarlane LC, Lipworth BJ. Beta 2 adrenoceptor regulation and AMP reactivity during the menstrual cycle in female asthmatics. Thorax 1995; 50(suppl): A60.
41.Eliasson O, Scherzer HH, De Greff AC. Morbidity in asthma in relation to the menstrual cycle. J Allergy Clin Immunol 1986; 77:87-94.
42.Barkman RP. Sudden death in asthma. Med J Aust 1981; 1:316-7.
43.Tan KS. Premenstrual asthma: epidemiology, pathogenesis and treatment. Drugs 2001; 64:2079-86.
44.Zhao X.J., McKerr G., Dong Z., Higgins C.A., Carson J., Yang Z.Q., Hannigan B.M. Expression of oestrogen and progesterone receptors by mast cells alone, but not lymphocytes, macrophages or other immune cells in human upper airways. Thorax 2001; 56:205–211.
45.Chandler M.H., Schuldheisz S., Phillips B.A., Muse K.N. Premenstrual asthma: The effect of estrogen on symptoms, pulmonary function, and beta 2-receptors. Pharmacotherapy 1997; 17:224–234.
46.Tan KS, McFarlane LC, Lipworth BJ. Modulation of airway reactivity and peak flow variability in asthmatics receiving the oral contraceptive pill. Am J Respir Crit Care Med 1997; 155:1273-7.
47.Murphy VE, Gibson PG. Premenstrual asthma: prevalence, cycle-to-cycle variability and relationship to oral contraceptive use and menstrual symptoms. J Asthma 2008; 45:696-704.
48.Nwaru BI, Sheikh A. Hormonal contraceptives and asthma in women of reproductive age: analysis of data from serial national Scottish Health Surveys. J R Soc Med. 2015 Sep;108(9):358-71.
49.Nwaru BI, Pillinger R, Tibble H, Shah SA, Ryan D, Critchley H, Price D, Hawrylowicz CM, Simpson CR, Soyiri IN, Appiagyei F, Sheikh A. Hormonal contraceptives and onset of asthma in reproductive-age women: Population-based cohort study.J Allergy Clin Immunol 2020; 146:438-46.
50.Lee B, Amir RF, Wong E, Tan T, Bloom C. Oral contraceptives and the risk of asthma attacks: a population-based cohort study. ERJ Open Res 2025 01278-2024; DOI: https://doi.org/10.1183/23120541.01278-2024
51.Barr, N. Managing adverse effects of hormonal contraceptives. Am Fam Physician 2010; 82:1499-1506.
52.Lidegaard Ø. Løkkegaard E. Jensen A. et al. Thrombotic stroke and myocardial infarction with hormonal contraception. N Engl J Med 2012; 366:2257-2266.
53.de Bastos M, Stegeman BH, Rosendaal FR, Van Hylckama Vlieg A, Helmerhorst FM, Stijnen T, Dekkers OM. Combined oral contraceptives: venous thrombosis. Cochrane Database of Systematic Reviews 2013, Issue 11. Art. No.: CD010813. DOI: 10.1002/14651858.CD010813. Acesso em: 26 agosto 2021.
54.Roach RE, Helmerhorst FM, Lijfering WM, Stijnen T, Algra A, Dekkers OM. Combined oral contraceptives: the risk of myocardial infarction and ischemic stroke. Cochrane Database of Systematic Reviews 2015, Issue 8. Art. No.: CD011054. DOI: 10.1002/14651858.CD011054.pub2. Acesso em: 26 Agosto 2021.
55.Horton LG, Simmons KB, Curtis KM. Combined hormonal contraceptive use among obese women and risk for cardiovascular events: A systematic review. Contraception 2016; 94:590-604.
56.Poromaa IS, Segebladh B. Adverse mood symptoms with oral contraceptives. Acta Obstet Gynecol Scand 2012; 91:420-7.
57.Skovlund CW, Mørch LS, Kessing LV, Lidegaard Ø. Association of Hormonal Contraception With Depression. JAMA Psychiatry 2016; 73:1154-1162.
58.Andreoli L, Bertsias GK, Agmon-Levin N, Brown S, Cervera R, Costedoat-Chalumeau N, Doria A, Fischer-Betz R, Forger F, Moraes-Fontes MF, Khamashta M, King J, Lojacono A, Marchiori F, Meroni PL, Mosca M, Motta M, Ostensen M, Pamfil C, Raio L, Schneider M, Svenungsson E, Tektonidou M, Yavuz S, Boumpas D, Tincani A. EULAR recommendations for women's health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Ann Rheum Dis 2017; 76:476-485.
59.McNulty KL, Elliott-Sale KJ, Dolan E, Swinton PA, Ansdell P, Goodall S, Thomas K, Hicks KM. The Effects of Menstrual Cycle Phase on Exercise Performance in Eumenorrheic Women: A Systematic Review and Meta-Analysis. Sports Med 2020; 50(10):1813-1827.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|