|
Asma
Tratamento da Asma
IMUNOTERAPIA ESPECÍFICA
A imunoterapia específica (ITE) é utilizada há mais de 100 anos, tendo sido descrita pela primeira vez por Leonard Noon do St. Mary's Hospital de Londres no The Lancet em 1911.1 Sua utilização atual é controversa, pois a moderna terapêutica disponível para a asma é altamente eficaz e capaz de controlar a grande maioria dos pacientes, possibilitando-os a manter uma vida normal. Embora o mecanismo da ITE não seja totalmente compreendido, ela pode modular ativamente as vias protetoras responsivas a alérgenos do sistema imunológico e alterar o curso natural da doença.
A ITE deve ser indicada apenas para pacientes com asma alérgica e deve ser considerada como um tratamento adicional para reduzir a carga do tratamento (poupador) e ainda, como opção terapêutica para indução de remissão pós-tratamento.
Nos Estados Unidos no Expert Panel Report 3 — Guidelines for the Diagnosis and Management of Asthma, do National Institutes of Health2 recomenda-se
de forma condicional, a imunoterapia específica subcutânea (SCIT) como complemento ao tratamento farmacológico-padrão em indivíduos com ≥ 5 anos que apresentem asma persistente leve a moderada, desde que haja evidências claras de associação entre os sintomas e a exposição a um alérgeno identificado.3 O Painel de Especialistas observou que, quando a asma alérgica é tratada com SCIT, os sintomas de comorbidades como a rinoconjuntivite alérgica podem melhorar e ter um efeito benéfico na qualidade da vida.4 Entretanto, se posiciona contra o uso de imunoterapia específica sublingual (SLIT) como um tratamento exclusivo direcionado para asma.
A Agência Europeia de Medicamentos concedeu autorização para o uso pediátrico tanto da SCIT quanto da SLIT, chancelando as agências reguladoras nacionais que apresentam requisitos e cronogramas específicos. O uso de ITE em crianças é apoiado pelas diretrizes da
European Academy of Allergy & Clinical Immunology (EAACI).5 A SLIT, por sua vez, tem se destacado no continente europeu em razão de sua facilidade de administração e perfil de segurança favorável, características que a tornam alinhada às preferências dos pacientes e dos profissionais de saúde.
No British Guideline on the Management of Asthma da British Thoracic Society o uso da imunoterapia subcutânea não é recomendado para o tratamento da asma em adultos ou crianças. A imunoterapia sublingual não está licenciada para tratamento da asma no Reino Unido.6,7
O primeiro estudo controlado de extrato bruto de pólens de gramíneas por imunoterapia subcutânea para rinite alérgica e asma alérgica foi publicado em 1954 no The Lancet por Frankland et Augustin.8 Nas décadas seguintes Abramsom et al.9 através de revisão do sistema de banco de dados Cochrane analisaram oitenta e oito estudos de imunoterapia específica para diversos alérgenos para asma e concluíram que a imunoterapia reduzia os sintomas da asma, o uso de medicamentos e a hiper-responsividade das vias aéreas. A maioria desses estudos usou SCIT contra sensibilizações de ácaros da poeira doméstica e cerca de um terço dos estudos envolveu SCIT contra sensibilizações de pólen de gramíneas.
São três as indicações para esta forma de terapêutica antialérgica:2
➭ Relação indiscutível entre os sintomas e a exposição a um ou dois alérgenos aos quais o paciente seja sensível, sem que ocorra a possibilidade de um completo isolamento de contato (polissensibilizações baseadas em evidências disponíveis, não mais devem ser vistas como contraindicação).
➭ Manifestação dos sintomas durante todo o ano ou na maior parte dele.
➭ Dificuldade no controle da doença com a medicação habitual, incluindo os medicamentos anti-inflamatórios de uso profilático e aqueles que controlam as crises; quando múltiplos medicamentos se fazem necessários; ou quando da não aceitação pelo paciente da terapêutica farmacológica prescrita.
A ITE consiste na administração de extratos de alérgenos purificados e padronizados por via subcutânea. O objetivo do tratamento é a modificação da resposta imune ao futuro contato com o alérgeno, visando à redução dos sintomas. A imunoterapia é a única forma de tratamento na atualidade que proporciona melhora a longo prazo das doenças alérgicas, que se mantém mesmo após a sua interrupção. É uma forma de tratamento por imunomodulação e o aumento da tolerância está associado a aumento na proporção IgG4:IgE.
A padronização dos extratos de alérgenos é importante para que sejam executados com precisão o diagnóstico, tratamento e pesquisas, utilizando-se, para tal, critérios qualitativos e quantitativos (Tabela 1). Sempre que possível utilizar extratos padronizados, pois os não padronizados podem apresentar grande variabilidade em sua atividade biológica.
Tabela 1 — Critérios para a Padronização de Alérgenos
Critérios para a Padronização de Alérgenos
|
| ▹ Assegurar-se de que a fonte do alérgeno foi obtida da espécie correta |
| ▹ Assegurar-se de que a fonte do alérgeno não está contaminada por outros alérgenos |
| ▹ Estabelecer que um espectro de alérgeno principal esteja presente (CRIE, immunoblotting) |
| ▹ Medir e padronizar o conteúdo total do alérgeno |
| ▹ Determinar a concentração dos principais alérgenos selecionados quando forem disponíveis os testes (inibição do RAST, CRIE, RIA, ELISA) |
| ▹ Assegurar-se de que seja biologicamente ativo |
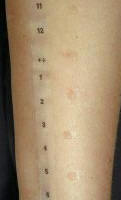 A utilidade da imunoterapia foi enfatizada em relatório da OMS,10 que recomenda a sua aplicação em pacientes selecionados (cooperantes), e que apresentem anticorpos IgE específicos a alérgenos clinicamente relevantes. A indicação da ITE se baseia em testes cutâneos (Figura 1) que devem ser utilizados para determinar reações a anticorpos IgE específicos. Os testes in vitro, se apropriadamente interpretados e bem executados, também podem ser utilizados. A seleção de pacientes é muito importante, sendo o risco-benefício menos favorável para pacientes com asma do que para aqueles com rinite alérgica, que respondem melhor a este tipo de tratamento. Quanto aos pacientes com asma, aqueles com doença mais severa e mal controlada são os mais propensos a desenvolver reações sistêmicas graves. Neste caso o risco relativo e os benefícios devem ser considerados com muita cautela, pois as mortes por ITE são mais comuns em pacientes sintomáticos do que em controlados. A utilidade da imunoterapia foi enfatizada em relatório da OMS,10 que recomenda a sua aplicação em pacientes selecionados (cooperantes), e que apresentem anticorpos IgE específicos a alérgenos clinicamente relevantes. A indicação da ITE se baseia em testes cutâneos (Figura 1) que devem ser utilizados para determinar reações a anticorpos IgE específicos. Os testes in vitro, se apropriadamente interpretados e bem executados, também podem ser utilizados. A seleção de pacientes é muito importante, sendo o risco-benefício menos favorável para pacientes com asma do que para aqueles com rinite alérgica, que respondem melhor a este tipo de tratamento. Quanto aos pacientes com asma, aqueles com doença mais severa e mal controlada são os mais propensos a desenvolver reações sistêmicas graves. Neste caso o risco relativo e os benefícios devem ser considerados com muita cautela, pois as mortes por ITE são mais comuns em pacientes sintomáticos do que em controlados.
A ITE é efetiva durante a gravidez, podendo ser mantida durante todo o ciclo gravídico-puerperal. Quando a paciente, recebendo ITE, referir a gravidez, a dose não deve mais ser aumentada, mantendo-se aquela que vinha em curso antes de engravidar, após discussão sobre os riscos de anafilaxia na gravidez.11,12 Não há evidências que indiquem risco aumentado ao prescrever ou manter a ITE para mães em período de amamentação.11 Não se recomenda, no entanto, iniciar este tipo de tratamento durante a gravidez, em função de possíveis complicações que incluem o aborto espontâneo, a prematuridade e a hipóxia fetal.
As contraindicações para a ITE incluem a presença de comprometimento funcional pulmonar grave, a já citada asma severa mal controlada, angina instável, infarto do miocárdio recente, importante arritmia cardíaca, hipertensão arterial não controlada ou falência de qualquer órgão nobre, esofagite eosinofílica e reação prévia grave e sistêmica à ITE.13
De acordo com as diretrizes atuais da
A Global Initiative for Asthma Management and Prevention (GINA) em seu update, a ITE pode ser considerada para todos os pacientes com asma que apresentam sensibilização clinicamente significativa a aeroalérgenos.14 No entanto, para minimizar os riscos de reações graves, os sintomas da asma devem estar controlados e o VEF1 deve ser superior a 70% do previsto quando da administração da imunoterapia. A SCIT demonstrou ser eficaz contra asma alérgica causada por pólens de gramíneas, ambrósia e bétula, ácaro da poeira, epitélio e caspa de gato, caspa de cão e alternaria spp.15
 O tratamento convencional é feito para induzir tolerância, através de uma série de injeções por via subcutânea, também chamada de
hipossensibilização ou dessensibilização que geralmente consiste em duas fases:
uma fase de progressão também conhecida como “up-dosing” ou indução e uma fase de manutenção (Figura 2).
Durante a fase de progressão, o paciente recebe injeções semanais, começando com uma dose muito baixa – em geral a dose inicial é 1.000 a 10.000 vezes menor do que a dose de manutenção, sendo que para os pacientes altamente sensíveis, a dose inicial deve ser mais baixa ainda – com aumentos graduais da dose ao longo de 3–6 meses.
Durante esta etapa, a frequência das injeções costuma variar entre 1 e 3 vezes por semana, podendo, em alguns casos, adotar-se esquemas de aumento mais rápidos. A qualidade do alérgeno utilizado é um fator de muita importância e se correlaciona com a eficácia clínica.16 Após essa fase, o paciente geralmente desenvolve tolerância suficiente ao alérgeno, permitindo alcançar a dose de manutenção. Na fase de manutenção, as injeções são administradas, em geral, a cada 4 semanas para alérgenos inalatórios, por um período de 3 a 5 anos. Ao final desse período, muitos pacientes desfrutam de um efeito protetor prolongado, o que pode justificar a interrupção do tratamento. Por outro lado, o tratamento com imunoterapia sublingual é iniciado com a dose de manutenção, no entanto, é recomendável administrar a primeira dose sob monitoramento. O tratamento convencional é feito para induzir tolerância, através de uma série de injeções por via subcutânea, também chamada de
hipossensibilização ou dessensibilização que geralmente consiste em duas fases:
uma fase de progressão também conhecida como “up-dosing” ou indução e uma fase de manutenção (Figura 2).
Durante a fase de progressão, o paciente recebe injeções semanais, começando com uma dose muito baixa – em geral a dose inicial é 1.000 a 10.000 vezes menor do que a dose de manutenção, sendo que para os pacientes altamente sensíveis, a dose inicial deve ser mais baixa ainda – com aumentos graduais da dose ao longo de 3–6 meses.
Durante esta etapa, a frequência das injeções costuma variar entre 1 e 3 vezes por semana, podendo, em alguns casos, adotar-se esquemas de aumento mais rápidos. A qualidade do alérgeno utilizado é um fator de muita importância e se correlaciona com a eficácia clínica.16 Após essa fase, o paciente geralmente desenvolve tolerância suficiente ao alérgeno, permitindo alcançar a dose de manutenção. Na fase de manutenção, as injeções são administradas, em geral, a cada 4 semanas para alérgenos inalatórios, por um período de 3 a 5 anos. Ao final desse período, muitos pacientes desfrutam de um efeito protetor prolongado, o que pode justificar a interrupção do tratamento. Por outro lado, o tratamento com imunoterapia sublingual é iniciado com a dose de manutenção, no entanto, é recomendável administrar a primeira dose sob monitoramento.
Vacinas com mais de um alérgeno devem ser evitadas devido à reatividade cruzada entre alérgenos, pela dificuldade em estabelecer a dose ótima de cada constituinte e pela degradação enzimática. Nada impede, no entanto, que o paciente receba duas injeções separadas, uma vacina para cada alérgeno.
A imunoterapia específica com vacinas deve ser diferençada da dessensibilização, que é um processo que se refere à rápida e progressiva administração de uma substância alergênica (proteína ou substância química) objetivando tornar as células efetoras menos reativas.
O tratamento com a imunoterapia empregando alérgenos é longo, com um curso de 3 a 5 anos de duração. Todavia, a duração da ITE pode ser individualizada de acordo com a resposta clínica, gravidade da doença e preferências do paciente. Os benefícios desta forma de tratamento devem ser muito bem avaliados em decorrência das sérias reações adversas que podem ocorrer na fase de indução ou quando de aumento das doses.
A ITE pode determinar reações locais e sistêmicas, que nos pacientes com asma variam segundo as estatísticas de 5 a 35%.16 A injeção subcutânea pode determinar reações locais como a pápula que pode alcançar 5 cm ou mais de diâmetro, manifestando-se por uma reação imediata (<1 h) ou tardia (1–24 h). Geralmente estas reações são bem toleradas, não necessitando de intervenção médica, embora possam se constituir na primeira manifestação de uma resposta sistêmica. O tratamento, quando de grande desconforto local, consiste na aplicação de compressas geladas, prescrição de anti-histamínico, corticoide tópico e redução da dose da imunoterapia.
A reações sistêmicas variam de simples rash ou prurido a severa anafilaxia. Dentre as principais manifestações sistêmicas temos:
● |
Rubor, sensação de calor, perspiração abundante |
● |
Urticária: intenso prurido no couro cabeludo, nas palmas das mãos e nas plantas dos pés |
● |
Sensação de "bolo" na garganta |
● |
Aperto no peito, sibilos, dispneia |
● |
Rinite, coriza |
● |
Tosse paroxística, estridor, disfonia |
● |
Náuseas, vômitos, tonteiras, síncope |
● |
Taquicardia, hipotensão |
● |
Angioedema, conjuntivite, prurido ocular, lacrimejamento |
● |
Gosto metálico na boca |
● |
Contrações uterinas |
As reações severas sobrevêm cerca de 30 minutos após a aplicação, podendo se manifestar como asma ou rinite ou por reações generalizadas através de urticária, angioedema ou choque anafilático. O choque anafilático é um evento raro, havendo, entretanto, relatos de evolução fatal. Em 1986 o British Committee on Safety Medicines relatou 26 mortes associadas à imunoterapia em um período de 30 anos,17 todas com ITE para asma. Nos EUA, entre 1985 e 2001 identificaram-se 34 mortes associadas à ITE, sendo que 28 (88%) em pacientes com asma lábil.18 As mortes foram atribuídas à inclusão de pacientes com doença mal controlada, erros na dose administrada e à aplicação por pessoal não qualificado, sem o acesso imediato à reanimação cardiopulmonar e a drogas como adrenalina. Recomenda-se que o paciente permaneça por 30 minutos em observação após a injeção subcutânea e, na eventualidade de identificar-se reação sistêmica, aplica-se 0,5 mg (0,5 ml de 1:1000) de adrenalina preferencialmente por via intramuscular, embora possa ser utilizada a via subcutânea.
A injeção intramuscular de epinefrina, em vez da administração subcutânea, fornece a absorção e a duração de ação mais consistentes desse fármaco. Anti-histamínicos e corticoides sistêmicos podem ser utilizados, entretanto, não substituem a adrenalina em decorrência do lento início de ação e ausência de ação vascular imediata.
Reações fatais relatadas à imunoterapia subcutânea ocorreram particularmente em pacientes com asma e, frequentemente, havia evidências de que a asma do paciente era grave e, mais importante, mal controlada no momento da reação fatal. Para minimizar o risco de reações graves, a SCIT não deve ser efetuada até que um bom controle da asma (controle dos sintomas e fatores de risco para exacerbações) tenha sido estabelecido.
Visando minimizar o risco de reações sistêmicas, preconizou-se o pré-tratamento dos extratos de alérgenos com agentes como o formaldeído, resultando no que se convencionou chamar de alergoides. Esta técnica que tem a ação benéfica de reduzir a ligação do alérgeno com a IgE, por outro lado reduz a sua imunogenicidade. Na Tabela 2 são apresentados os fatores mais comuns que podem estar associados às reações adversas na ITE. Na Tabela 3 são descritos os cuidados da administração e monitorização da imunoterapia específica. Na Tabela 4 estão as identificações dos frascos de acordo com a diluição.
Tabela 2 — Fatores Associados às Reações Adversas na Imunoterapia Específica
Fatores Associados às Reações Adversas na ITE
|
| ▹ Fase de indução do tratamento (primeiros meses) |
| ▹ Erros na dosagem – overdose |
| ▹ Injeção endovenosa inadvertida |
| ▹ Extrema sensibilidade ao alérgeno |
| ▹ Esforço vigoroso antes da aplicação da injeção |
| ▹ Troca de frasco |
| ▹ Asma incontrolável |
| ▹ Exposição ambiental ao alérgeno – p. ex. durante estação de pólens |
| ▹ Administração de ß-bloqueadores |
| ▹ Doença febril |
| Adaptado de: Frew AJ, Norman OS, Golden DB, Adelman DC. Immunotherapy. In: Holgate ST. Church MK, Lichtenstein LM. Allergy. London: Mosby: 2001:175-186. |
Tabela 3 — Cuidados na Administração e Monitorização da Imunoterapia Específica
Antes da Aplicação |
Durante a Injeção |
Após a Injeção |
O frasco da vacina deve ser identificado, tendo-se o cuidado de verificar o prazo de validade. Para a conservação deve ser mantido a 4ºC para reduzir a perda de sua potência. |
As injeções são aplicadas por via subcutânea, no terço médio posterior do tríceps, utilizando agulha calibre 26G ou 27G. |
O paciente deve permanecer em observação no consultório por 20-30 minutos após a injeção, ou por um tempo mais longo, se necessário, em caso de sinal de anafilaxia. |
O nome do paciente deve sempre ser confirmado, observando-se a dose correta prescrita para a ocasião. |
Aspirar antes de injetar o extrato de alérgeno, para certificar-se de que nenhum vaso foi puncionado. Em caso de punção acidental, interromper o procedimento, e reiniciar, com novo material, e com punção em outro local. |
Ao final do período de observação, o local da injeção deve ser examinado para verificar se há reação local. |
Questionar o paciente quanto a reações adversas tardias após suas últimas aplicações. |
. |
Os pacientes asmáticos podem necessitar de ausculta pulmonar. |
Atentar para o possível uso de beta-bloqueadores por via oral ou como colírio. |
Equipamento Necessário em Caso de Emergência
1 Estetoscópio
2 Esfigmomanômetro
3 Seringa
4 Adrenalina (1:1000)
5 Oxigênio
6 Soros: fisiológico 0,9% e glicosado 5%
7 Material para intubação orotraqueal
8 Anti-histamínicos
9 Corticoides
10 Aminofilina
11 Vasopressores
12 Nebulizador
13 Broncodilatadores Beta-agonistas |
Pacientes asmáticos devem ser auscultados para detectar-se sibilos. |
Pacientes com história de asma necessitam de medidas do pico de fluxo expiratório antes e após a injeção. |
A injeção não deve ser administrada na eventualidade de qualquer tipo de dificuldade respiratória. |
Tabela 4— Identificação dos Frascos de Acordo com a Diluição (De acordo com American College Of Allergy, Asthma & Immunology — Institutional Guide - Revised june 2023)
Não diluído |
1:1 |
Vermelho |
 |
10 vezes |
1:10 |
Amarelo |
100 vezes |
1:100 |
Azul |
1.000 vezes |
1:1.000 |
Verde |
10.000 vezes |
1:10.000 |
Prata |
Durante as exacerbações da asma não se aplica a imunoterapia. Alguns autores recomendam a avaliação do PFE antes da aplicação da injeção, suspendendo-se a ITE se o valor estiver abaixo daquele obtido quando de estado estável.
Um questionamento atual se refere aos pacientes alérgicos a múltiplos alérgenos, pois a imunoterapia contra um alérgeno não parece afetar a responsividade do paciente aos outros. A eficácia da ITE varia, sendo bastante ativa em pacientes com história de anafilaxia às picadas de abelhas e vespas. Três anos de tratamento de imunoterapia com o veneno conferem proteção de 90% contra futuras reações anafiláticas, por pelo menos cinco anos após a descontinuação do tratamento. Bons resultados são obtidos em pacientes com rinite sazonal alérgica decorrente de pólens de gramíneas, bétula e ervas (Ambrósia americana).19-21 Três ou quatro anos de imunoterapia resultam em proteção continuada por pelo menos mais três anos após a suspensão do tratamento.
No clima temperado, onde os chamados alérgenos perenes determinam asma e rinite, como, por exemplo, os
alérgenos dos ácaros da poeira, os dos pelos e escamas de gatos e os alérgenos de baratas, os pacientes são bem menos responsivos a esta forma de tratamento. Dá-se preferência aos cuidados ambientais e à farmacoterapia que se constituem na melhor opção, principalmente quando ocorre sensibilidade a vários alérgenos. Apesar disto, uma metanálise de 20 estudos randomizados controlados22 com alérgenos de ácaros da poeira doméstica, concluiu haver melhora dos sintomas, inibição da resposta tardia da asma e diminuição da hiper-responsividade brônquica, com redução concomitante no uso da medicação de resgate. Resultados favoráveis foram relatados com ITE utilizando extratos purificados de alérgenos do gato, com redução dos sintomas durante exposição ao alérgeno controlada, quando obteve-se redução nas alterações do PFE, e nas reações de sensibilidade cutânea e da conjuntiva.23
Em 1996, Creticos et al. ressaltaram a eficácia da ITE na asma.24 Em um estudo multicêntrico, duplo-cego, placebo-controlado utilizaram um extrato purificado de Amb a 1, aplicado aos pacientes sintomáticos com asma durante a época da polinização. A imunoterapia foi aplicada por um período superior a dois anos na maioria dos pacientes, tendo-se obtido reduções nas crises de broncospasmo e nas respostas ao teste cutâneo no grupo tratado. Os resultados demonstraram um pequeno, porém estatisticamente significativo aumento no PFE e uma redução no uso da medicação no primeiro ano de tratamento, mantendo-se inalterados os registros de sintomas e a responsividade à provocação com a metacolina. Os pequenos benefícios obtidos no primeiro ano de tratamento não se sustentaram por dois anos. Malling avaliou 54 ensaios clínicos randomizados publicados entre 1954 e 1997 constatando que não houve melhora geral na função pulmonar após a ITE.25 Os pacientes randomizados para ITE, entretanto, tiveram uma probabilidade significantemente menor para demandar medicação do que aqueles randomizados para placebo [OR 0,28; IC95% 0,19 a 0,42].25
A GINA em seu update de 202514 preconiza considerar a SLIT como tratamento adicional para a asma para adolescentes ou adultos sensibilizados ao ácaros da poeira doméstica se apresentarem sintomas persistentes de asma apesar do tratamento com CI em doses baixas ou médias, somente se apresentarem VEF1 >70% do previsto.
Para crianças com asma sensibilizadas à ambrósia, durante a temporada de ambrósia, considerar a adição de SLIT antes e durante a temporada de ambrósia, desde que o VEF1 seja ≥80% do teórico. Não há evidência para recomendar SLIT para ácaros da poeira em crianças com asma. Ressalte-se que a Ambrosia atemisiifolia considerada um dos mais potentes indutores de rinite alérgica e asma em várias regiões do mundo se encontra no Brasil em expansão, especialmente nas regiões Sul e Sudeste, onde há maior densidade populacional e registros crescentes de sensibilização.
Como para qualquer tratamento, os potenciais benefícios da ITSL para pacientes individuais devem incluir a tomada de decisão compartilhada e ser ponderados em relação ao risco de eventos adversos e ao custo para o paciente.
O estudo MITRA foi o primeiro a demonstrar que um tratamento de imunoterapia de alérgenos de ácaros da poeira doméstica com 1 comprimido sublingual por um ano é capaz de reduzir exacerbações em pacientes com asma mal controlada e alergia a ácaros da poeira doméstica, com um perfil de segurança aceitável.26
Jutel et al.27 em um estudo com dados do mundo real demonstraram que a ITSL
com alérgenos de ácaros da poeira doméstica proporcionou benefícios de longo prazo para pacientes entre 5 e 70 anos.
Houve diminuição tanto na progressão da rinite alérgica como para a asma e os
benefícios foram observados após pelo menos 2 anos de tratamento e se mantiveram por até 6 anos após o seu término.
Foi registrada redução significativa no risco de desenvolver asma a partir de 15 meses de tratamento.
O estudo REACT (Real-World Effectiveness in Allergy Immunotherapy) analisou dados de 2007 a 2017 de um grande banco de seguros de saúde na Alemanha, investigando o impacto da ITE em pacientes com rinite alérgica, com ou sem asma. Incluiu 46.024 pacientes tratados com ITE pareados 1:1 com controle, além de um subgrupo de 14.614 indivíduos com asma leve a moderada. A média de idade dos pacientes era de 29,5 ± 16 anos, e foram tratados com ITE por cerca de 549 ± 284 dias. Os tratamentos incluíram imunoterapia subcutânea (SCIT) e sublingual (SLIT), com alérgenos como gramíneas, árvores (bétula, amieiro, aveleiro), ácaros e outros. O estudo mostrou que a ITE está associada à redução sustentada no uso de medicamentos para rinite alérgica e asma, além de diminuir o risco de exacerbações graves e hospitalizações em pacientes asmáticos, reforçando sua eficácia no mundo real.28,29
A imunoterapia específica com alérgenos é atualmente considerada como ‘modificadora' de doença, principalmente porque benefícios clínicos e alterações imunológicas persistem além do tempo de duração do tratamento, ou seja,
o tratamento proporciona proteção continuada mesmo após a sua interrupção.30-32
A imunoterapia deve ser interrompida se não houver ganho nítido, após um ano de manutenção. Quando eficaz, o tratamento pode ser suspenso após um período adequado — em geral, três anos para alergias a pólen33 ou ácaros — com a expectativa de que os benefícios se mantenham por anos após a interrupção.
Mecanismo de Ação
A imunoterapia usa mecanismos gerais de tolerância imunológica a alérgenos com alterações nas respostas das células T e B da memória específica de alérgenos, regulação da produção de IgE e IgG específica de alérgenos e modificação dos limiares de ativação de mastócitos e basófilos ou fenótipos de células dendríticas.
O mecanismo de ação da imunoterapia ainda não está completamente elucidado. No início do tratamento ocorre um aumento nas concentrações da IgE específica, seguido por uma lenta e progressiva redução durante os anos subsequentes,34 sendo raro o seu desaparecimento completo. Cooke et al.35 demonstraram a geração de "anticorpos bloqueadores" que mais tarde se descobriu serem predominantemente da subclasse IgG4, que aumentam durante a imunoterapia e se mantêm em níveis elevados durante o tratamento. Embora os níveis de ambos os isotipos aumentem na fase inicial do tratamento, a relação da IgE específica/IgG4 diminui 10–100 vezes no decurso do tratamento.36
Acredita-se que estes anticorpos IgG promovam uma downregulation da resposta alérgica por três mecanismos: a) interceptação do alérgeno, b) por competição, antes que este possa ligar-se à IgE ou c) prevenindo a associação FceRI–IgE através de um "obstáculo" estérico. Estas hipóteses são questionáveis pois a melhora clínica usualmente precede o aumento nos títulos de anticorpos IgG4 alérgeno específicos, sendo pouco provável que estes anticorpos possam bloquear a ligação do alérgeno a IgE na superfície da mucosa do trato respiratório.37 Em resposta à imunoterapia ocorre uma inibição nos órgãos-alvo, no recrutamento e ativação de células efetoras, como os mastócitos e os eosinófilos. A adequada ITE está associada à tolerância imunológica, definida como um relativo declínio na responsividade alérgeno-específica.
A teoria mais coerente propõe como mecanismo de ação a modulação da função de células T, através de alteração na relação Th1/Th2, ou seja, um desvio na resposta imune do fenótipo Th2 para o Th1, indução da anergia, ou ambos. Na inflamação alérgica em pacientes atópicos ocorre predomínio de células Th2, que liberam grandes quantidades de citocinas como:
1 – A IL-4 que é importante na síntese da IgE pelas células B e consequentemente promove a sensibilização dos receptores de alta afinidade IgE na superfície de mastócitos e basófilos. É a responsável pela diferenciação/proliferação das células Th2, pela inibição do desenvolvimento Th1, pela upregulation da FceRII e a atuação na expressão antigênica do complexo maior de histocompatibilidade II (MHC classe II) sobre as células apresentadoras de antígenos (APCs). Participa na modulação do crescimento, na diferenciação e na degranulação dos mastócitos;
2 – A IL-5 que é o determinante primário da diferenciação, recrutamento, ativação, adesão e sobrevida dos eosinófilos;
3 – A IL-13 que atua na regulação da resposta imune. Induz à expressão CD23 nos linfócitos B, agindo como a IL-4 na síntese de IgE e prolongando a sobrevivência dos mastócitos nos tecidos. Determina o recrutamento seletivo de eosinófilos através do aumento da expressão VCAM-1 no endotélio vascular e inibe a IL-12 e o IFN-a que promovem normalmente resposta Th1. A IL-13 apresenta ainda importante papel na secreção de muco e hiper-responsividade do músculo liso das vias aéreas.
A imunoterapia está associada não só a downregulation da IL-4, IL-5 e IL-13, como também a elevações de IL-10 e IL-12. A IL-10 exerce uma variedade de efeitos sobre as células T, inibindo a sua proliferação, as respostas de citocinas tanto Th1 como Th2 e bloqueando vias de coestimulação. A IL-10 reduz o número e a responsividade dos mastócitos e produz a downregulation dos eosinófilos. Inibe a produção do GM-CSF e a expressão CD40 pelos eosinófilos ativados.
A IL-10 é importante para a indução e a manutenção de anergia.

Os estudos sugerem que a ITE possa atuar induzindo a tolerância imunológica, o desvio imune das respostas Th2 e Th0 a favor de uma resposta Th1 ou a uma downregulation das respostas Th0–Th2 (anergia) (Figura 3). Este desvio determinaria uma preponderância de células T do tipo Th1, com a liberação de IFN-g, que promove a produção de IgG pelos linfócitos B e inibe as células T do tipo Th2. Este efeito pode ser mediado por um aumento na expressão da IL-12, principalmente pelos macrófagos, após a exposição ao alérgeno.
Esta teoria tem sido apoiada por vários estudos que evidenciaram queda nos níveis séricos de IgE,34 aumento nas concentrações de IgG,36 e inibição do recrutamento ou ativação de células efetoras como mastócitos38,39 e eosinófilos40,41 nos órgãos alvo, em resposta à imunoterapia. Em paralelo, ocorre um aumento nas respostas Th1, detectadas por aumento na expressão mRNA do IFN-g.42,43
Estudos no sangue periférico de pacientes sob imunoterapia específica demonstraram redução na proliferação de células T que expressam IL-4 mRNA, sugerindo que uma persistente supressão de respostas Th2 possa ser a responsável pela melhora clínica, e por uma inibição da resposta alérgica tardia.44 Da mesma forma, a ITE, por períodos prolongados de 4 a 7 anos, resulta em diminuição da expressão IL-4 em biópsias cutâneas, de respostas tardias alérgeno induzidas.33 O aumento da expressão IL-5 mRNA observada na mucosa nasal de pacientes com rinite durante a exposição sazonal a pólens também é inibida pela ITE. Esta downregulation se correlaciona intimamente com a resposta clínica à imunoterapia, bem como à redução tecidual da eosinofilia.45
No final da década de 90 surgiram as primeiras publicações demonstrando a participação de células T regulatórias (Tregs) no mecanismo da imunoterapia alérgeno específica, sendo que a indução de tolerância imunológica se tornou o intuito principal no que concerne à prevenção e tratamento das doenças do sistema imune, incluindo as alergias.
Em 1998, Akdis et al. foram os primeiros a apresentar evidências do papel da IL-10 e das células Tregs T tipo 1 (Tr1) no efeito benéfico da imunoterapia com alérgenos em pacientes alérgicos a venenos de abelhas.46 Os dados sugerem que as células Tr1 representem um subconjunto de células Treg envolvidas na prevenção do desenvolvimento de doenças alérgicas. Eles observaram que a diminuição induzida pelo tratamento na proliferação de células T e produção de IL-5 e IL-13 em resposta à estimulação de veneno de abelha in vitro poderia ser totalmente antagonizada pela neutralização da IL-10.
Esses dados sugerem um papel importante para as células Tr1 produtoras de IL-10 na imunoterapia com alérgenos. Esses achados foram ampliados por estudos de imunoterapia com aeroalérgenos que mostraram aumentos nas células do tipo Tr1 produtoras de IL-10 alérgeno específicas e células do tipo Th3 produtoras de TGF-ß no sangue ou tecido das vias aéreas.47,48
Após a imunoterapia os macrófagos, monócitos, células B além das células T também geram a IL-10.46,47 Todos os três tipos de células, B, monócitos e macrófagos podem apresentar antígeno e, ao produzir IL-10, estarem envolvidos nos efeitos supressores da imunoterapia, diretamente ou através da indução de células Tr1.
Foi demonstrado que a IL-10 reduz a produção de IgE e melhora a produção de IgG4 em linfócitos B humanos in vitro. Portanto, a produção de IL-10 induzida por imunoterapia pelas células Tr1 também pode ser responsável pelo aumento observado na produção de anticorpos IgG4 específicos para alérgenos.45-47
Na fase inicial do tratamento a imunoterapia específica induz a um aumento das células Treg, diminuindo a produção de citocinas em resposta ao alérgeno específico pelos linfócitos TCD4+ Th1 e TCD4+ Th2.45
Sabe-se que durante a imunoterapia ocorre um aumento da relação Th1/Th2, uma vez que as citocinas Th2 são rapidamente inibidas. Isto estimula a população Th1 e IFN-ÿ como se acreditava anteriormente.
Os mecanismos da SCIT e da SLIT apresentam diferenças. Na SCIT, a atividade inibidora da IgE é principalmente mediada pela IgG4, enquanto na SLIT, os anticorpos bloqueadores locais, nasais e sistêmicos estão amplamente associados à IgA.49
O sucesso da ITE está associado a sua propriedade de induzir e expandir as Tregs que são fundamentais, pois atuam como "supervisores" ou "freios" do sistema imunológico, restaurando a tolerância aos alérgenos. Sua atuação decorre por meio de três modos: a) supressão direta de outras células imunes, b) liberação de citocinas anti-inflamatórias (IL-10 e TGF-ß) e c) por inibição da produção de IgE (Figura 4).
As células Tregs induzidas pela ITE atuam através de vários mecanismos supressores como:5,45-61
1. Supressão por Citocinas Anti-inflamatórias
As Tregs produzem e liberam duas importantes citocinas
■ A IL-10 conhecida como "Citocina supressora mestre".
● Com a capacidade de suprimir respostas imunes Th2 e de células Th17 produtoras de IL-17.
● Reduz a produção de IgE e, ao mesmo tempo, promove a produção de IgG4 (um isotipo de anticorpo "bloqueador" que neutraliza o alérgeno sem causar inflamação).
● Suprime a ativação de mastócitos e basófilos, reduzindo a liberação de histamina e mediadores inflamatórios.
● Restringe a produção de IgE, inibe eosinófilos, mastócitos; promove a produção de IgG4 ("anticorpo bloqueador").
■ TGF-ß (Fator de Crescimento Transformador beta):
● Potente efeito anti-inflamatório.
● Inibe a diferenciação das células Th2.
Induz mudança de classe para IgA e promove supressão da inflamação crônica.
2. Supressão Direta Célula a Célula
■ As Tregs podem suprimir diretamente a atividade de outras células imunes (como céllulas Th2, células dendríticas e mastócitos) através da interação entre moléculas de sua superfície celular (p. ex. CTLA-4, GITR).
3. Modulação da Função das Células Apresentadoras de Antígenos (APCs)
■ As Tregs podem "instruir" as células dendríticas (as que iniciam a resposta imune) a se tornarem células tolerogênicas. Essas APCs tolerogênicas, por sua vez, promovem a diferenciação de mais Tregs criando um ciclo virtuoso de tolerância.
4. Inibição da Migração de Células Inflamatórias
■ A IL-10 e TGF-ß suprimem a expressão de moléculas de adesão e quimiocinas que recrutam eosinófilos, mastócitos e outras células inflamatórias para os tecidos afetados (mucosas nasal e das vias aéreas).
5. Como participante adicional entre as citocinas reguladoras secretadas (IL-10 e TGF-ß) a IL-35 aparece como interveniente adicional.
■ Reforçando o ambiente de tolerância, potencializa atividade supressora das Tregs.
■ Pode induzir uma população específica de células regulatórias (iTr35), estáveis e altamente supressoras, que não dependem de IL-10 ou TGF-ß.
Sumário da sequência temporal da ITE: na fase inicial (semanas a poucos meses) a citocina-chave é a IL-10 quando ocorre a indução inicial de céulas Tregs e a modulação precoce da resposta Th2. A IL-10 o agente-chave desta fase, evolui com rápida elevação, reduz a produção de IgE com concomitante aumento dos anticorpos bloqueadores IgG4 e a inibição de mastócitos, eosinófilos e basófilos. Em fase intermediária de imunoterapia, com meses transcorridos, os eventos mais relevantes se constituem na expansão e estabilização das Tregs com aumento gradual de Bregs produtoras de IL-10. Na fase tardia, ou de manutenção, ocorre a consolidação da tolerância imunológica duradoura, com resposta clínica sustentada mesmo após a interrupção da ITE. Nessa etapa a IL-10 mantém bloqueio de células efetoras e estabilidade de IgG4 protetor, enquanto a TGF-ß assegura equilíbrio Th/Treg, homeostase de mucosa e memória regulatória. A IL-35 atua como "reforço tardio", expandindo iTr35 e Bregs+, auxiliando na manutenção do estado tolerogênico a longo prazo.
Os principais destaques dos últimos anos são os avanços no entendimento das células linfoides inatas (ILC), incluindo o envolvimento de ILCs tipo 2 no desenvolvimento da inflamação alérgica das vias aéreas e a contribuição das ILCs tipo 3 para a tolerância imune mediada por células Breg.62

Referências
01.Noon L, Cantab BC. Prophylactic inoculation against hay fever. Lancet 1911; 177:1572-1573.
02.
Expert Panel Working Group of the National Heart, Lung, and Blood Institute (NHLBI) administered and coordinated National Asthma Education and Prevention Program Coordinating Committee (NAEPPCC); Cloutier MM, Baptist AP, Blake KV, Brooks EG, Bryant-Stephens T, DiMango E, Dixon AE, Elward KS, Hartert T, Krishnan JA, Lemanske RF Jr, Ouellette DR, Pace WD, Schatz M, Skolnik NS, Stout JW, Teach SJ, Umscheid CA, Walsh CG. 2020 Focused Updates to the Asthma Management Guidelines: A Report from the National Asthma Education and Prevention Program Coordinating Committee Expert Panel Working Group. J Allergy Clin Immunol 2020; 146:1217-1270. doi: 10.1016/j.jaci.2020.10.003. Erratum in: J Allergy Clin Immunol 2021; 147:1528-1530. doi: 10.1016/j.jaci.2021.02.010. PMID: 33280709; PMCID: PMC7924476.
03.
National Asthma Education and Prevention Program. Third Expert Panel on the Diagnosis and Management of Asthma. Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma. Bethesda, Maryland: National Heart, Lung, and Blood Institute, National Institutes of Health. Aug. 2007. 440 pp. https://www.ncbi.nlm.nih.gov/books/NBK7232/.
04.Lin SY, Azar A, Suarez-Cuervo C, Diette GB, Brigham E, Rice J, Ramanathan M Jr, Gayleard J, Robinson KA. The Role of Immunotherapy in the Treatment of Asthma [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2018 Mar. Report No.: 17(18)-EHC029-EF. PMID: 30044579.
05.Alvaro-Lozano M, Akdis CA, Akdis M, Alviani C, Angier E, Arasi S, Arzt-Gradwohl L, Barber D, Bazire R, Cavkaytar O, Comberiati P, Dramburg S, Durham SR, Eifan AO, Forchert L, Halken S, Kirtland M, Kucuksezer UC, Layhadi JA, Matricardi PM, Muraro A, Ozdemir C, Pajno GB, Pfaar O, Potapova E, Riggioni C, Roberts G, Rodríguez Del Río P, Shamji MH, Sturm GJ, Vazquez-Ortiz M. EAACI Allergen Immunotherapy User's Guide. Pediatr Allergy Immunol 2020; 31 Suppl 25(Suppl 25):1-101.
06.BTS – British guideline on the management of asthma (SIGN 245). Disponível em: https://www.sign.ac.uk/our-guidelines/asthma-diagnosis-monitoring-and-chronic-asthma-management/
07.Arshad SH. An update on allergen immunotherapy. Clin Med (Lond) 2016; 16:584-587.
08.Frankland AW, Augustin R. Prophylaxis of summer hay-fever and asthma: a controlled trial comparing crude grass-pollen extracts with the isolated main protein component. Lancet 1954; 266:1055-57.
09.Abramson MJ, Puy RM, Weiner JM. Injection allergen immunotherapy for asthma. Cochrane Database Syst Rev. 2010 Aug 4;(8):CD001186. doi: 10.1002/14651858.CD001186.pub2. PMID:20687065.
10.Allergen immunotherapy: therapeutic vaccines for allergic diseases: Geneva: January 27-29, 1997. Allergy 1998; 44:Suppl:1-42.
11.Cox L, Nelson H, Lockey R, Calabria C, Chacko T, Finegold I, Nelson M, Weber R, Bernstein DI, Blessing-Moore J, Khan DA, Lang DM, Nicklas RA, Oppenheimer J, Portnoy JM, Randolph C, Schuller DE, Spector SL, Tilles S, Wallace D. Allergen immunotherapy: a practice parameter third update. J Allergy Clin Immunol 2011; 127(1 Suppl):S1-55. doi: 10.1016/j.jaci.2010.09.034. Epub 2010 Dec 3. Erratum in: J Allergy Clin Immunol 2011; 127(3):840.
12.Oykhman P, Kim HL, Ellis AK. Allergen immunotherapy in pregnancy. Allergy Asthma Clin Immunol 2015; 11:31.
13.Boursiquot JN, Gagnon R, Quirt J, Ellis AK. Allergen immunotherapy. Allergy Asthma Clin Immunol 2024; 20(Suppl 3):66. doi: 10.1186/s13223-024-00935-2. PMID: 39681846; PMCID: PMC11650827.
14.
Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2025. Updated May 2025. Disponível em: www.ginasthma.org
15.
Canadian Society of Allergy and clinical immunology. Immunotherapy Manual. 2024.
16.Bousquet J, Hejjaoui A, Michel FB. Specific immunotherapy in asthma. J Allergy Clin Immunol 1990; 86:292-305.
17. Commitee on Safety of Medicines. Desensitising vaccines. BMJ 1986; 293:948.
18.Nelson HS. Allergen immunotherapy: Where is it now? J Allergy Clin Immunol 2007; 119:769-79.
19.Varney VA, Gaga M, Frew AJ, Aber VR, Kay AB, Durham SR. Usefulness of immunotherapy in patients with severe summer hay fever uncontrolled by antiallergic drugs. BMJ 1991; 302:265-9.
20.Petersen BN, Janniche H, Munch EP, Wihl JA, Bowadt H, Ilsen H, Loweinstein H. Immunotherapy with partially purified and standardized tree pollen extracts. I. Clinical results from a three-year double-blind study of patients treated with pollen extracts either of birch or combinations of alder, birch and hazel. Allergy 1988; 43:353-62.
21.Lowell F, Franklin W. A double-blind study of the effectiveness and specifity of injection therapy in ragweed hay fever. N Engl J Med 1965; 273;675-9.
22.Abramson MJ, Puy RM, Weiner JM. Is allergen immunotherapy effective in asthma? A meta-analysis of randomized controlled trials. Am J Respir Crit Care Med 1995; 151:969-74.
23.Varney VA, Edwards J, Tabbah K, Brewster H, Mavroleon G, Frew AJ. Clinical efficacy of specific immunotherapy to cat dander: A double-blind placebo-controlled trial. Clin Exp Allergy 1997; 27:860-7.
24.Creticos PS, Reed CE, Norman PS, Khoury J., Adkinson NF, Buncher CR, Busse WW, Bush RK, Gadde J, Li JT, Richerson HB., Rosenthal RR, Solomon WR, Steinberg P, Yunginger JW. Ragweed immunotherapy in adult asthma. N Engl J Med 1996; 334:501-6.
25.Malling HJ. Allergenspecifik immunterapi ved behandling af asthma [Allergen-specific immune therapy in the treatment of asthma]. Ugeskr Laeger 2000; 162 :477-479.
26.Virchow JC, Backer V, Kuna P, Prieto L, Nolte H, Villesen HH, Ljørring C, Riis B, de Blay F. Efficacy of a House Dust Mite Sublingual Allergen Immunotherapy Tablet in Adults With Allergic Asthma: A Randomized Clinical Trial. JAMA 2016; 315:1715-25.
27.
Jutel M, Klimek L, Richter H, Brüggenjürgen B, Vogelberg C. House dust mite SCIT reduces asthma risk and significantly improves long-term rhinitis and asthma control-A RWE study. Allergy. 2024; 79:1042-1051.
28.Fritzsching B, Contoli M, Porsbjerg C, Buchs S, Larsen JR, Elliott L, Rodriguez MR, Freemantle N. Long-term real-world effectiveness of allergy immunotherapy in patients with allergic rhinitis and asthma: Results from the REACT study, a retrospective cohort study. Lancet Reg Health Eur 2021; 13:100275. doi: 10.1016/j.lanepe.2021.100275. PMID: 34901915; PMCID: PMC8640513.
29.Scadding G. Real world evidence of long-term benefits from allergen-specific immunotherapy (AIT). Lancet Reg Health Eur 2021; 13:100283.
30.Incorvaia C, Al-Ahmad M, Ansotegui IJ, Arasi S, Bachert C, Bos C, Bousquet J, Bozek A, Caimmi D, Calderón MA, Casale T, Custovic A, De Blay F, Demoly P, Devillier P, Didier A, et al. Personalized medicine for allergy treatment: allergen immunotherapy still a unique and unmatched model. Allergy 2021; 76:1041-52.
31.Pfaar O, Creticos PS, Kleine-Tebbe J, Canonica GW, Palomares O, Schülke S. One hundred ten years of allergen immunotherapy: a broad look into the future. J Allergy Clin Immunol Pract 2021; 9:1791-803.
32.Marogna M, Spadolini I, Massolo A, Canonica GW, Passalacqua G. Long-lasting effects of sublingual immunotherapy according to its duration: a 15-year prospective study. J Allergy Clin Immunol 2010; 126:969-75.
33.Durham SR, Walker SM, Varga EM, Jacobson MR, O'Brien F, Noble W, Till SJ, Hamid QA, Nouri-Aria KT. Long-term clinical efficacy of grass-pollen immunotherapy. N Engl J Med 1999; 341:468-75.
34.Lichtenstein LM, Ishizaka K, Norman PS, Sobotka AK, Hill BM. IgE antibody measurements in ragweed hay fever. Relationship to clinical severity and the results of immunotherapy. J Clin Invest 1973; 52:472-82.
35.
Cooke RA, Barnard JH, Hebald S, Stull A. Serological evidence of immunity with coexisting sensitization in a type of human allergy (HAY FEVER). J Exp Med 1935; 62:733-50.
36.Gleich GJ, Zimmermann EM, Henderson LL, Yunginger JW. Effect of immunotherapy on immunoglobulin E and immunoglobulin G antibodies to ragweed antigens: a six-year prospective study. J Allergy Clin Immunol 1982; 70:261-71.
37.Shamji MH, Ljørring C, Francis JN, Calderon MA, Larché M, Kimber I, Frew AJ, Ipsen H, Lund K, Würtzen PA, Durham SR. Functional rather than immunoreactive levels of IgG4 correlate closely with clinical response to grass pollen immunotherapy. Allergy 2012; 67:217-26.
38.Otsuka H, Mezawa A, Ohnishi M, Okubo K, Seki H, Okuda M. Changes in nasal metachromatic cells during allergen immunotherapy. Clin Exp Allergy 1991; 21:115-9.
39.Creticos PS, Adkinson NF Jr, Kagey-Sobotka A, Proud D, Meier HL, Naclerio RM, Lichtenstein LM, Norman PS.
Nasal challenge with ragweed pollen in hay fever patients: effect of immunotherapy. J Clin Invest 1985; 76:2247-53.
40.Furin MJ, Norman PS, Creticos PS, Proud D, Kagey-Sobotka A, Lichtenstein LM, Naclerio RM. Immunotherapy decreases antigen-induced eosinophil cell migration into the nasal cavity. J Allergy Clin Immunol 1991; 88:27-32.
41.Rak S, Lowhagen O, Venge P. The effect of immunotherapy on bronquial hyperresponsiveness and eosinophil cationic protein in pollen-allergic patients. J Allergy Clin Immunol 1988; 82:470-80.
42.Durham SR, Ying S, Varney VA, Jacobson MR, Sudderick RM, Mackay IS, Kay AB, Hamid QA. Grass pollen immunotherapy inhibits allergen-induced infiltration of CD4+ T lymphocytes and eosinophils in the nasal mucosa and increases the number of cells expressing messenger RNA for interferon-gamma. J Allergy Clin Immunol 1996; 97:1356-65.
43.Varney VA, Hamid QA, Gaga M, Ying S, Jacobson M, Frew AJ, Kay AB, Durham SR. Influence of grass pollen immunotherapy on cellular infiltration and cytokine mRNA expression during allergen-induced late-phase cutaneous responses. J Clin Invest.1993; 92:644-51.
44.Secrist H, Chelen CJ, Wen Y, Marshall JD, Umetsu DT. Allergen immunotherapy decreases interleukin-4 production in CD4+ T cells from allergic individuals. J Exp Med 1993; 178:2123-30.
45.Wilson DR, Nouri-Aria KT, Walker SM, Pajno GB, O'Brien F, Jacobson MR, Mackay IS, Durham SR. Grass pollen immunotherapy: symptomatic improvement correlates with reductions in eosinophils and IL-5 mRNA expression in the nasal mucosa during the pollen season. J Allergy Clin Immunol 2001; 107:971-6.
46.Akdis CA, Blesken T, Akdis M, Wuthrich B, Blaser K. Role of interleukin 10 in specific immunotherapy. J Clin Invest 1998; 102:98–106.
47.Jutel M, Akdis M, Budak F, Aebischer-Casaulta C, Wrzyszcz M, Blaser K, Akdis CA. IL-10 and TGF-beta cooperate in the regulatory T cell response to mucosal allergens in normal immunity and specific immunotherapy. Eur J Immunol. 2003; 33:1205-14.
48.Gardner LM, Thien FC, Douglass JA, Rolland JM, O'Hehir RE. Induction of T “regulatory” cells by standardized house dust mite immunotherapy: an increase in CD4CD25 interleukin-10 T cells expressing peripheral tissue trafficking markers. Clin Exp Allergy 2004; 34:1209–1219.
49.Durham SR, Shamji MH. Allergen immunotherapy: past, present and future. Nat Rev Immunol 2023; 23:317–28.
50.Nouri-Aria KT, Wachholz PA, Francis JN, Jacobson MR, Walker SM, Wilcock LK, Staple SQ, Aalberse RC, Till SJ, Durham SR. Grass pollen immunotherapy induces mucosal and peripheral IL-10 responses and blocking IgG activity. J Immunol 2004; 172:3252-9.
51.Akdis CA, Blaser K. Mechanisms of interleukin-10-mediated immune suppression. Immunology 2001; 103:131-136.
52.van Oosterhout AJM, Bioksma N. Regulatory T-lymphocytes in asthma. Eur Respir J 2005; 26:918-932.
53.Aarestrup FM. Imunoterapia injetável subcutânea (SCIT) para alérgenos inalantes In:. Guia Prático de Alergia e Imunologia Clínica – Baseado em Evidências. Atheneu. São Paulo. 2014; pp 24-27.
54.Pereira VAR, A WCT, Mello JF. Mecanismos da imunoterapia alérgeno-específica. Arq Asma Alerg Imunol. 2017; 1(3):257-62.
55.Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W, et al. International consensus on Allergen Immunotherapy II: Mechanisms, standardization, and pharmacoeconomics. J Allergy Clin Immunol 2016; 137:358-68.
56.Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy: Multiple suppressor factors at work in immune tolerance to allergens. J Allergy Clin Immunol 2014; 133:621-31.
57.Cavkaytar O, Akdis CA, Akdis M. Modulation of immune responses by immunotherapy in allergic diseases. Cur Opin Pharmacol 2014; 17:30-7.
58.Berings M, Karaaslan C, Altunbulakli C, et al. Advances and highlights in allergen immunotherapy: on the way to sustained clinical and immunologic tolerance. J Allergy Clin Immunol 2017; 140:1250–67.
59.Scadding GW, Calderon MA, Shamji MH, Eifan AO, Penagos M, Dumitru F, Sever ML, Bahnson HT, Lawson K, Harris KM, Plough AG, Panza JL, Qin T, Lim N, Tchao NK, Togias A, Durham SR; Immune Tolerance Network GRASS Study Team.
Effect of 2 years of treatment with sublingual grass pollen immunotherapy on nasal response to allergen challenge at 3 years among patients with moderate to severe seasonal allergic rhinitis: the GRASS randomized clinical trial. JAMA 2017; 317:615–25.
60.Branchett WJ, Lloyd CM. Regulatory cytokine function in the respiratory tract. Mucosal Immunol. 2019 May;12(3):589-600.
61.Branchett WJ, Lloyd CM. Regulatory cytokine function in the respiratory tract. Mucosal Immunol. 2019 May;12(3):589-600.
62.Akdis CA, Akdis M. Mechanisms of allergen-specific immunotherapy. J Allergy Clin Immunol 2011; 127:18-27.
63.Komlósi ZI, Kovác N, Sokolowska M, van de Veen W, Akdis M, Akdis CA. Mechanisms of subcutaneous and sublingual aeroallergen immunotherapy: What is new? Immunol Allergy Clin N Am 2020;40:1-14.
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|