|
Asma
FISIOPATOLOGIA DA ASMA
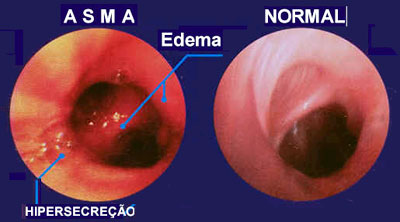
Como evidenciado no  estudo patológico da asma, a inflamação da mucosa brônquica ocasiona limitação ao fluxo aéreo devido ao aumento do fluxo sanguíneo brônquico, com vasodilatação, congestão e hiperpermeabilidade microvascular com edema e líquido intraluminal (Figura 1), tampões de muco e contração da musculatura lisa peribrônquica. Este conjunto determina redução do calibre das vias aéreas determinando aumento da resistência das vias aéreas (Rva) e consequente hiperinsuflação pulmonar com alterações na relação ventilação-perfusão. estudo patológico da asma, a inflamação da mucosa brônquica ocasiona limitação ao fluxo aéreo devido ao aumento do fluxo sanguíneo brônquico, com vasodilatação, congestão e hiperpermeabilidade microvascular com edema e líquido intraluminal (Figura 1), tampões de muco e contração da musculatura lisa peribrônquica. Este conjunto determina redução do calibre das vias aéreas determinando aumento da resistência das vias aéreas (Rva) e consequente hiperinsuflação pulmonar com alterações na relação ventilação-perfusão.
Os testes de função pulmonar auxiliam no diagnóstico e monitoramento de pacientes asmáticos. Praticamente todos os testes podem se alterar. Estes podem se apresentar normais nos assintomáticos fora de crise ou com os mais variados graus de obstrução em função do estágio da doença em que o paciente se encontra. As medidas mais comuns e fáceis de serem obtidas são aquelas através de manobra expiratória forçada: capacidade vital forçada (CVF), o volume expiratório no primeiro segundo (VEF1), a relação VEF1/CVF e o fluxo expiratório forçado 25-75% (FEF25-75%) (Figura 2). A diferença entre a capacidade vital "lenta" (CV) e a capacidade vital forçada (CVF) é vista frequentemente em pacientes com obstrução brônquica, sendo um sinal de air trapping.
Figura 2 – Capacidade Vital Forçada (CVF)– Em A, o registro mostra uma expiração forçada se iniciando de uma inspiração máxima onde está representado o volume expiratório forçado no primeiro segundo – VEF1. Em B, representação na mesma curva da CVF do fluxo expiratório forçado em 25-75% o equivalente ao FEF50% derivado da curva volume-tempo. Em C, são apresentados três exemplos de curvas de CVF, uma normal, outra de um paciente obstrutivo com asma e a terceira de paciente com padrão restritivo. CVF – capacidade vital forçada; VEF1 – volume expiratório forçado no primeiro segundo; FEF25-75% – fluxo expiratório forçado 25-75% da capacidade vital forçada.
A função pulmonar deve ser avaliada no diagnóstico ou início do tratamento, após 3 a 6 meses de tratamento com corticoides inalatórios (CI) para
avaliar o melhor VEF1 pessoal do paciente e periodicamente depois disso, pelo menos a cada 1 a 2 anos para a maioria dos pacientes adultos e crianças, com base na gravidade da asma e no curso clínico.
A redução do calibre e consequente aumento na resistência das vias aéreas determina diminuição de todos os fluxos expiratórios máximos, incluindo o pico de fluxo expiratório (PFE) que na asma aguda pode ser menor do que 150 a 100 l/min. Ocorrem ainda diminuição dos volumes expirados em função do tempo, oclusão prematura das vias aéreas, hiperinsuflação pulmonar, aumento do trabalho respiratório com mudanças na performance muscular e alterações na relação ventilação-perfusão com alteração nos gases sanguíneos.
A hiperinsuflação pulmonar é definida como um aumento da capacidade residual funcional (CRF) acima do valor teórico previsto. Sob o ponto de vista clínico, a modificação mais importante nos volumes pulmonares durante a crise de asma é o aumento da CRF, o que determina considerável mudança na mecânica dos músculos respiratórios, comprometendo a capacidade da "bomba" ventilatória em sustentar a respiração espontânea. Portanto, respirar com pulmões hiperinsuflados exige maior esforço e, assim, contribui para a sensação de dispneia.
O volume residual (VR) e a CRF aumentam à medida que a obstrução brônquica piora devido ao fenômeno de air trapping e compressão dinâmica das vias aéreas.
A capacidade pulmonar total (CPT) quase não se altera, salvo em vigência de obstrução muito grave, quando 50% dos pacientes apresentam a sua elevação. A oclusão das vias aéreas ocorrendo a volumes maiores do que o normal obviamente reduz a CV.1-3 Todavia, a redução na CV não é proporcional à elevação no VR porque a CPT também aumenta,4 provavelmente em consequência da perda da força de recolhimento elástico pulmonar5,6 ou aumento na força muscular inspiratória7,8 ou ambas. Existem evidências de que a força de recolhimento elástico dos pulmões está levemente reduzida na asma aguda, especialmente a volumes pulmonares próximos da CPT.9 Esta mudança na CPT é reversível com a resolução da asma.10
O volume expiratório forçado no primeiro segundo (VEF1) encontra-se reduzido assim como a relação VEF1/CVF, os fluxos expiratórios (FEF 25-75% , Vmáx50%CVF , Vmáx25%CVF, e o PFE).
A reversibilidade da obstrução das vias aéreas pode ser avaliada através do teste de broncodilatação, medindo-se o VEF1 antes e 10 a 15 minutos após a inalação de duas respirações profundas de broncodilatador de curta duração de ação (200-400 mcg). Arbitrariamente considera-se um aumento ≥ 12% ou 200 ml no DVEF1 como evidência de significativa reversibilidade. Na asma grave, entretanto, um aumento muito pequeno do VEF1 é encontrado após o teste com broncodilatador, devendo-se salientar, por outro lado, que um aumento de 20% quando o VEF1 é de apenas 0,5 l é frequentemente visto em obstruções brônquicas crônicas não asmáticas. Nos pacientes sem resposta ao teste com broncodilatador, um curso de 2 a 3 semanas de corticoide oral pode se fazer necessário para demonstrar a reversibilidade.
A curva pressão-volume na asma tem forma semelhante à normal. Devido à hiperinsuflação está desviada para cima e devido à baixa pressão está desviada para a esquerda. A complacência dinâmica pulmonar está reduzida e torna-se frequência-dependente devido às desigualdades nas constantes de tempo nos pulmões, em decorrência da distribuição paralela heterogênea das vias aéreas estreitadas.9 A redução da complacência dinâmica aumenta o trabalho elástico da respiração.
A capacidade de difusão pelo monóxido de carbono (DLCO) é normal podendo estar aumentada devido à hiperinsuflação que determina aumento da área de superfície de membrana alveolar e ao aumento do volume sanguíneo capilar pulmonar decorrente do aumento da pressão negativa intratorácica que propicia maior número de hemácias na captação do CO e pelo aumento da perfusão dos ápices pulmonares devido ao aumento da pressão arterial pulmonar.
Devido à obstrução brônquica das pequenas vias aéreas periféricas, os alvéolos são mal ventilados, porém continuam a ser perfundidos. Na asma também ocorre disfunção do surfactante.11,12 O surfactante pode estar substituído por exsudato inflamatório ou muco, tornando as pequenas vias aéreas mais propensas à obstrução e fechamento. Se a estabilidade das pequenas vias aéreas se altera por aumento de secreções ou disfunção do surfactante, ocorre estreitamento das vias aéreas periféricas, sua oclusão, maiores volumes pulmonares e air trapping. Como consequência, ocorre aumento da diferença alveolar-arterial de oxigênio (P[A-a]O2), aumento do espaço morto fisiológico (VD/VT), com queda da pressão parcial de oxigênio arterial (PaO2) determinando hipoxemia. Esta hipoxemia leva a taquipneia e aumento da ventilação-minuto, com eliminação de CO2, determinando hipocapnia (invariavelmente encontrada em crises leves e moderadas, refletindo um aumento do drive respiratório) e alcalose respiratória, o achado mais comum na análise da gasometria do sangue arterial do asmático.13 O estímulo ou mecanismo determinante desta hiperventilação ainda não está bem caracterizado. Durante a crise de asma, é possível que a ativação de receptores irritantes estimulem a ventilação, não podendo descartar-se também a ação de outros reflexos gerados nas vias aéreas, pulmões ou parede torácica.
 Embora a hipocapnia constitua-se em um achado constante nas crises de asma, não está bem definida a importância de sua participação na fisiopatologia da doença. Há mais de quarenta anos14 formulou-se a hipótese de que a hipocapnia nas vias aéreas resultante da hiperventilação, poderia perpetuar o broncospasmo através do aumento progressivo da resistência brônquica, decorrente de sua ação direta sobre a musculatura lisa e por aumento da permeabilidade da microvascularização brônquica.15,16 Embora a hipocapnia constitua-se em um achado constante nas crises de asma, não está bem definida a importância de sua participação na fisiopatologia da doença. Há mais de quarenta anos14 formulou-se a hipótese de que a hipocapnia nas vias aéreas resultante da hiperventilação, poderia perpetuar o broncospasmo através do aumento progressivo da resistência brônquica, decorrente de sua ação direta sobre a musculatura lisa e por aumento da permeabilidade da microvascularização brônquica.15,16
Possíveis mecanismos para a indução de broncoconstrição pela hipocapnia podem decorrer de reflexos neurais, aumento do calibre vascular, liberação de mediadores ou através de um efeito direto sobre o músculo liso da via aérea. Um estudo de Lindman et al.17 propõe que a hipocapnia desempenhe um efeito direto nas células do musculo liso das vias aéreas, possivelmente atuando na alcalose intracelular, na concentração do cálcio livre intracelular. Reynolds e McEvoy16 relataram que em pulmões de porquinhos-da-índia uma redução na PCO2 alveolar produzia um aumento da resistência das vias aéreas pela indução de broncospasmo e aumento da permeabilidade de microvasos brônquicos, e que este efeito era mediado pela liberação de taquicininas de fibras nervosas C-aferentes. Todavia, o mecanismo da broncoconstrição ainda é incerto e pode estar relacionado ao grau de hipocapnia. Sterling18 concluiu que quando a concentração de CO2 expirado (ETCO2) era < 30 mm Hg, a broncoconstrição era mediada via sistema nervoso autônomo (através do nervo vago) porém, quando a ETCO2 era < 15 mm Hg ocorria mediação por efeito direto nas células do músculo liso.
Como consequência da hipocapnia, ocorre um aumento no trabalho respiratório, o que pode potencializar a sensação de dispneia, conduzindo a adicional hiperventilação, progressiva hipocapnia e aumento do broncospasmo, culminando com fadiga e falência respiratórias (Figura 3).19 Esta teoria continua a ser discutida na atualidade, com confirmação através de vários estudos experimentais.15,16,19-21 Van den Elshout et al.20 estudaram 30 pacientes com asma e 15 voluntários sadios e encontraram no grupo com asma menor ETCO2 quando comparado ao grupo controle (36 mm Hg vs 40 mm Hg) e demonstraram experimentalmente em asmáticos, que a hipocapnia pode contribuir para o aumento da resistência das vias aéreas, mesmo quando se previnem as perdas de água e calor.
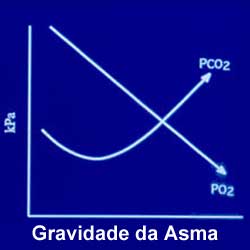 A hipoxemia correlaciona-se com o grau de obstrução brônquica, que não é homogênea nos pulmões. Existem vias aéreas completamente ocluídas, outras severamente estreitadas e outras completamente pérvias. Como consequência, resultam alterações na relação ventilação/perfusão, com aumento da diferença alveolar-arterial de oxigênio (P[A-a]O2), determinando PaO2 de 60–69 mmHg (8.0–9,2 kPa). Quando a PaO2 é < 60 mmHg, geralmente o VEF1 é menor que 1,0 litro. McFadden e Lyons13 avaliaram 101 pacientes, encontrando valores de VEF1 de 59%, 39% e 18% dos valores teóricos previstos quando de PaO2 médias de 83, 71 e 63 mmHg, respectivamente. Hipercapnia e acidose respiratória, com ou sem acidose metabólica (lática), ocorrem em estágios muito avançados, quando de obstrução muito severa com alterações nas trocas gasosas (Figura 4). Quando existe acidose metabólica com elevado anion gap, o lactato plasmático encontra-se elevado, devido à maior oxidação da glicose no músculo, em função do grande aumento do trabalho respiratório e fadiga muscular, além da redução do clearance do lactato e o efeito das catecolaminas (Tabela 1).22-25 A relação entre PaCO2 e VEF1 não é linear. Quando o VEF1 é maior que 750 ml ou 30% do previsto, raramente ocorre hipercapnia. A hipoxemia correlaciona-se com o grau de obstrução brônquica, que não é homogênea nos pulmões. Existem vias aéreas completamente ocluídas, outras severamente estreitadas e outras completamente pérvias. Como consequência, resultam alterações na relação ventilação/perfusão, com aumento da diferença alveolar-arterial de oxigênio (P[A-a]O2), determinando PaO2 de 60–69 mmHg (8.0–9,2 kPa). Quando a PaO2 é < 60 mmHg, geralmente o VEF1 é menor que 1,0 litro. McFadden e Lyons13 avaliaram 101 pacientes, encontrando valores de VEF1 de 59%, 39% e 18% dos valores teóricos previstos quando de PaO2 médias de 83, 71 e 63 mmHg, respectivamente. Hipercapnia e acidose respiratória, com ou sem acidose metabólica (lática), ocorrem em estágios muito avançados, quando de obstrução muito severa com alterações nas trocas gasosas (Figura 4). Quando existe acidose metabólica com elevado anion gap, o lactato plasmático encontra-se elevado, devido à maior oxidação da glicose no músculo, em função do grande aumento do trabalho respiratório e fadiga muscular, além da redução do clearance do lactato e o efeito das catecolaminas (Tabela 1).22-25 A relação entre PaCO2 e VEF1 não é linear. Quando o VEF1 é maior que 750 ml ou 30% do previsto, raramente ocorre hipercapnia.
Tabela 1 — Alterações na Gasometria Arterial na Asma, à Medida que a Obstrução Brônquica se Agrava
Gasometria Arterial na Crise Aguda de Asma |
|
PO2 |
PCO2 |
pH |
Excesso de Base |
|
↓ |
↓ |
↑ |
Alcalose Respiratória |
|
↓↓ |
Normal |
Normal |
Normal |
|
↓↓↓ |
↑ |
↓ |
Acidose Mista |
Durante longo tempo, a asma foi considerada uma doença obstrutiva reversível, pois a maioria dos pacientes consegue reversão completa dos parâmetros anormais da espirometria, como, por exemplo, o VEF1. No entanto, muitos asmáticos, crianças e adultos, demonstram obstrução residual, que é encontrada inclusive em assintomáticos. As alterações brônquicas estruturais decorrentes do remodelamento das vias aéreas, são as responsáveis pela obstrução persistente, hiper-responsividade brônquica (HRB) e acelerado declínio na função pulmonar. Este declínio é heterogêneo, podendo ser mínimo em uns e extenso em outros, similar ao que acontece nos pacientes com doença pulmonar obstrutiva crônica. Durante a vida adulta a asma está associada a um aumento na taxa de declínio do VEF1, quando comparado a indivíduos normais, sendo que em fumantes de meia-idade e em idosos, é virtualmente impossível distinguir a bronquite crônica da asma, utilizando-se somente o VEF1, significando que o dano e reparação resultam em alterações estruturais, muitas vezes permanentes, nas vias aéreas. Muitos asmáticos também são tabagistas, e esta combinação determina um impacto significativo na queda progressiva do VEF1.
Nos pacientes em que estão presentes os sintomas de asma, embora com espirometria normal, ocorrendo dúvida quanto ao diagnóstico, pode-se lançar mão dos chamados testes de provocação. Estes testes permitem avaliar a hiper-responsividade brônquica (HRB) que pode ser definida como um aumento anormal na limitação ao fluxo aéreo, após a exposição a um determinado estímulo. Como a resposta das vias aéreas aos diferentes estímulos é heterogênea, estes foram divididos em estímulos diretos e indiretos.
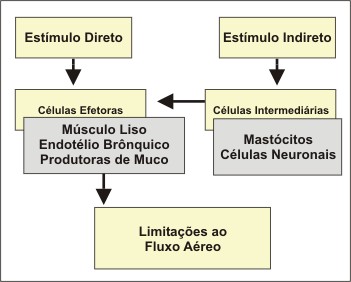 O estímulo direto determina limitação ao fluxo aéreo agindo sobre as chamadas células efetoras, como as células da musculatura lisa, as células do endotélio vascular brônquico e as células produtoras de muco. O estímulo indireto limita o fluxo aéreo por ação em células outras que não as efetoras. Estas células denominadas intermediárias, como por exemplo certas células inflamatórias como os mastócitos, células epiteliais e as células neuronais, determinam alterações na parede brônquica antes de interagirem com as células efetoras (Figura 5). O estímulo direto determina limitação ao fluxo aéreo agindo sobre as chamadas células efetoras, como as células da musculatura lisa, as células do endotélio vascular brônquico e as células produtoras de muco. O estímulo indireto limita o fluxo aéreo por ação em células outras que não as efetoras. Estas células denominadas intermediárias, como por exemplo certas células inflamatórias como os mastócitos, células epiteliais e as células neuronais, determinam alterações na parede brônquica antes de interagirem com as células efetoras (Figura 5).
De acordo com o mecanismo dominante na limitação ao fluxo aéreo em resposta a um determinado estímulo, podemos utilizar agentes parassimpaticomiméticos, antagonistas de receptores ß2, mediadores, poluentes atmosféricos e agentes físicos/osmóticos (Tabela 2) como testes de provocação brônquica para avaliar a HRB, classificando-os em estímulos diretos ou indiretos, embora alguns estímulos possam apresentar as duas características.
Tabela 2 — Estímulos para Medir a Hiper-responsividade Brônquica
|
|
Estímulo Físico |
|
| Aerossóis não isotônicos, hipertônicos, hipotônicos, água destilada, manitol |
Agonistas colinérgicos: acetilcolina, metacolina, carbacol |
Exercício |
Histamina |
Hiperpneia voluntária eucápnica com ar seco |
Prostaglandina D2 |
|
Leucotrienos C4, D4, E4 |
Estímulo Farmacológico |
|
Adenosina 3'5' monofosfato |
Bradicinina |
Taquicinina (NκA, SP) |
Metabissulfito, SO2 |
Propranolol |
Endotoxina |
Fator de Ativação Plaquetária |
Ozônio |
| Agentes Seletivos |
| Alérgenos |
Aspirina e anti-inflamatórios |
A utilização da acetilcolina e da histamina como instrumento para o diagnóstico e avaliação de pacientes com asma recebeu o apoio de Tiffeneau,26 na década de 1950.
Em pacientes que apresentam sintomas de asma com provas de função pulmonar normais os testes de broncoprovocação com histamina, exercício ou metacolina (b-metil homólogo da acetilcolina) são úteis para avaliar a hiper-responsividade das vias aéreas e confirmar ou afastar o diagnóstico de asma brônquica. Estas medidas são muito sensíveis porém, pouco específicas para o diagnóstico da asma. Isto significa que enquanto um teste negativo pode ser utilizado para excluir um diagnóstico de asma, um teste positivo nem sempre significa que o paciente tem asma. São padronizados, os testes de inalação são dependentes de dose-resposta, sendo a provocação efetuada pela inalação seriada de concentrações ascendentes da droga ( Técnica de administração do teste). As doses são cuidadosamente estipuladas e a resposta avaliada através da queda do VEF1, cinco minutos após a inalação. O teste é considerado positivo quando ocorre uma queda no VEF1 de 20% ou mais, quando comparado ao valor controle basal, após inalação de solução de cloreto de sódio. A quantidade de estímulo necessária para determinar a queda do VEF1 recebe a denominação de dose provocativa 20% (DP20). O teste da metacolina avalia a responsividade da musculatura lisa das vias aéreas, todavia, os mecanismos pelos quais a responsividade à metacolina aumenta ou diminui são ainda pouco conhecidos. Uma DP20 < 8 mg/ml indica hiper-responsividade brônquica. A metacolina é mais utilizada do que a histamina devido à baixa incidência de efeitos colaterais e por demonstrar melhor reprodutibilidade. Técnica de administração do teste). As doses são cuidadosamente estipuladas e a resposta avaliada através da queda do VEF1, cinco minutos após a inalação. O teste é considerado positivo quando ocorre uma queda no VEF1 de 20% ou mais, quando comparado ao valor controle basal, após inalação de solução de cloreto de sódio. A quantidade de estímulo necessária para determinar a queda do VEF1 recebe a denominação de dose provocativa 20% (DP20). O teste da metacolina avalia a responsividade da musculatura lisa das vias aéreas, todavia, os mecanismos pelos quais a responsividade à metacolina aumenta ou diminui são ainda pouco conhecidos. Uma DP20 < 8 mg/ml indica hiper-responsividade brônquica. A metacolina é mais utilizada do que a histamina devido à baixa incidência de efeitos colaterais e por demonstrar melhor reprodutibilidade.
O teste de provocação pela metacolina apresenta alta sensibilidade para identificar pacientes com asma, porém deve ser ressaltado que a HRB pode ocorrer em outras condições como na fibrose cística, traqueobronquite viral, na DPOC, na atopia sem asma, em fumantes, na insuficiência cardíaca e naqueles com função pulmonar no limite inferior ao normal. Mesmo os pacientes com rinite que não apresentam sintomas torácicos podem ter o teste de provocação positivo. A ausência de HRB após o teste de provocação com a metacolina expressa uma forte evidência contra o diagnóstico de asma.
 A DP20 é muito baixa em pacientes com asma quando comparada a atópicos sem asma e indivíduos normais. Em indivíduos normais, altas doses ou concentrações do agente broncoconstritor podem causar redução do calibre brônquico, porém a magnitude da resposta é limitada, isto é, existe um ponto no qual constrição adicional não irá ocorrer, apesar do aumento da dose do agente utilizado. Em outras palavras, ocorre um plateau na curva dose-resposta antes que uma broncoconstrição exagerada (p.ex. 40% do VEF1) ocorra. Em indivíduos atópicos sem asma e naqueles com asma leve, o limiar de dose ou concentração pode ser baixo, revelando hipersensibilidade, porém a resposta máxima pode ser limitada por um plateau similar ao dos indivíduos normais. Na asma moderada ou severa, a dose limiar tende a ser baixa, porém o broncospasmo continua a aumentar com o aumento das doses, com pequeno efeito plateau (Figura 6). A DP20 é muito baixa em pacientes com asma quando comparada a atópicos sem asma e indivíduos normais. Em indivíduos normais, altas doses ou concentrações do agente broncoconstritor podem causar redução do calibre brônquico, porém a magnitude da resposta é limitada, isto é, existe um ponto no qual constrição adicional não irá ocorrer, apesar do aumento da dose do agente utilizado. Em outras palavras, ocorre um plateau na curva dose-resposta antes que uma broncoconstrição exagerada (p.ex. 40% do VEF1) ocorra. Em indivíduos atópicos sem asma e naqueles com asma leve, o limiar de dose ou concentração pode ser baixo, revelando hipersensibilidade, porém a resposta máxima pode ser limitada por um plateau similar ao dos indivíduos normais. Na asma moderada ou severa, a dose limiar tende a ser baixa, porém o broncospasmo continua a aumentar com o aumento das doses, com pequeno efeito plateau (Figura 6).
Além da metacolina e histamina outros testes que utilizam estímulos diretos são utilizados como o manitol, o carbacol, a PGD2 e os leucotrienos C4, D4, E4 .
A inalação de ar frio com alta ventilação minuto, mantendo-se a PaCO2 constante (hiperpneia isocápnica), é um teste de provocação (indireto) capaz de induzir broncoconstrição transitória em pacientes cujo diagnóstico de asma é incerto.
Ar frio, exercício, hiperventilação e poeiras inertes são estimulantes comuns da hiper-responsividade brônquica em asmáticos. Estes estímulos provocam um efeito indireto através de vias neural e humoral. Em geral, o estímulo indireto é mais específico para o diagnóstico da asma, enquanto que o estímulo direto usado no teste de broncoprovocação química é mais sensível.
A água destilada veiculada através de inalação por nebulizador ultrassônico determina apenas tosse em indivíduos normais. Em asmáticos determina tosse e broncoconstrição. A maioria dos asmáticos apresenta broncoconstrição após a inalação de < 2 ml de água destilada. O grau de responsividade brônquica é similar à resposta ao exercício e à hiperpneia eucápnica. Um período refratário ocorre após a nebulização ultrassônica em cerca de ~50% dos pacientes.
O dióxido de enxofre inalado (SO2) tem sido utilizado como teste útil para discriminar os pacientes com asma daqueles com limitação crônica do fluxo aéreo e dos normais. Todos os asmáticos parecem responder a este estímulo, embora a resposta não seja cumulativa, como os testes com histamina e metacolina. Mais recentemente, outro teste utilizando agente estimulante indireto, a inalação da adenosina 3' 5' monofosfato (AMP), tem sido utilizado como teste de provocação, estimulando a liberação de histamina pelos mastócitos, provavelmente por estimulação do receptor A2B, determinando a mobilização de reservas de cálcio intracelular. É altamente sensível e específico para a asma, distinguindo asmáticos de portadores de doença pulmonar obstrutiva crônica (DPOC).
A bradicinina causa contração das vias aéreas pela estimulação de receptores B2. A bradicinina é metabolizada por várias peroxidases, sendo as mais importantes, a carboxipeptidase N (quinase I), ACE e a NEP. O efeito broncoconstritor da bradicinina é em parte mediado via nervos vagais colinérgicos.
A broncoconstrição induzida pelo propranolol é geralmente menos tolerada pelos pacientes do que a induzida pela metacolina, histamina e adenosina. Em função deste fato e por apresentar reversão mais difícil através de inalação com ß2-agonistas, sua utilização como teste de provocação foi abandonada.
Ao contrário dos agentes não seletivos, os estímulos seletivos provocam broncoconstrição apenas em certos asmáticos. Estas respostas podem ser imunologicamente mediadas ou não imunológicas. Estímulos comuns não imunológicos incluem os anti-inflamatórios não hormonais, a  aspirina, os alimentos e os aspirina, os alimentos e os  aditivos alimentares (p.ex. os sulfitos). aditivos alimentares (p.ex. os sulfitos).
A execução do teste de broncoprovocação deve levar em conta o risco de broncoconstrição imposto ao paciente. Existem contra-indicações relativas e absolutas para o teste, listadas na Tabela 3 .
Tabela 3 — Contraindicações para os Testes de Broncoprovocação
| |
Absolutas |
| ● |
Severa limitação ao fluxo aéreo (VEF1 < 50% do teórico ou < 1,0 l) |
| ● |
Infarto do miocárdio ou AVC nos últimos 3 meses |
| ● |
Hipertensão arterial não controlada (P. sistólica > 200 e P. distólica > 100) |
| ● |
Aneurisma da aorta |
| |
|
| ● |
Moderada limitação ao fluxo aéreo (VEF1 < 60% do teórico ou 1,5 l) |
| ● |
Incapacidade de executar uma espirometria aceitável |
| ● |
Uso de inibidores da colinesterase para misatenia gravis |
| |
Guidelines for methacholine and exercise challenge testing - 1999 - American Thoracic Societu . Am J Respir Crit Care Med 2000; 309-329. |
Para o diagnóstico e monitoramento da asma em termos práticos, utilizam-se pequenos aparelhos, que medem o pico de fluxo expiratório (PFE) (Tabela 4).
Tabela 4 — Diagnóstico da Asma Através da Medida do PFE
| |
Diagnóstico da Asma pelo PFE |
| ● |
PFE aumenta > 15% 15-20 min após a inalação de broncodilatador β2-agonista de curta ação: p. ex. salbutamol |
| ● |
PFE varia > 20% entre a medida matinal ao acordar e a medida efetuada 12 h após, em pacientes que fazem uso de broncodilatador, ou > 10% naqueles que não utilizam broncodilatador |
| ● |
O PFE diminui > 15% após 6 minutos de corrida ou exercício |
A variabilidade diurna do PFE tem sido um método clínico aceitável no controle da asma e avaliação da asma ocupacional. A variabilidade diurna normal no PFE em indivíduos não asmáticos é de 10% ou menos e em crianças cerca de 13%, aumentando consideravelmente em pacientes com hiper-responsividade brônquica e asma grave. O PFE correlaciona-se bem com o VEF1,27 porém não de forma uniforme. O VEF1 reflete alterações em grandes e médias vias aéreas, enquanto que o PFE registra somente mudanças em grandes brônquios.
O PFE não substitui o VEF1 no diagnóstico inicial da asma, porém constitui-se em útil alternativa à espirometria, na monitorização da limitação ao fluxo aéreo e progressão da obstrução
|
Em indivíduos normais o PFE é determinado pelo tamanho dos pulmões, pela elasticidade pulmonar, pelas dimensões e complacência das vias aéreas intratorácicas centrais, e pela força e velocidade de contração dos músculos expiratórios (principalmente abdominais). A resistência friccional das vias aéreas e particularmente as das pequenas vias aéreas, têm apenas pequena contribuição.
Vários estudos clínicos demonstram que alguns pacientes com asma não são capazes de perceber o agravamento de sua obstrução brônquica, ao contrário daqueles que percebem pequenas mudanças. Cerca de 15% dos pacientes asmáticos não notam quando o seu VEF1 é menor que 50% do teórico previsto, sendo que não existe nenhum procedimento clínico que ajude o médico a distinguir este grupo de pacientes. Estes pacientes devem ser acompanhados através da monitorização regular do PFE.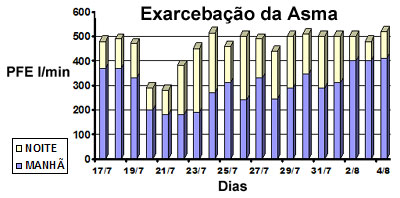 Beneficiam-se também com este procedimento os pacientes que apresentam excessivas variações diurnas no PFE, quando a incidência de morte súbita é elevada, detectando-se os pacientes com alto risco de ataques de asma quase-fatal ou fatal. O PFE é utilizado também para orientar os pacientes quanto à utilização e doses de medicamentos, favorece o controle da doença e reduz a sua morbidade. Beneficiam-se também com este procedimento os pacientes que apresentam excessivas variações diurnas no PFE, quando a incidência de morte súbita é elevada, detectando-se os pacientes com alto risco de ataques de asma quase-fatal ou fatal. O PFE é utilizado também para orientar os pacientes quanto à utilização e doses de medicamentos, favorece o controle da doença e reduz a sua morbidade.
O PFE é medido em aparelhos portáteis, baratos, sendo ideal para o acompanhamento domiciliar e ocupacional (Figura 7). O paciente deve ser bem instruído quanto à forma da realização das medidas. É um exame que demanda cooperação, dependendo muito do esforço muscular desenvolvido na expiração forçada. Devem ser efetuadas três medidas da expiração forçada (intervalos de um a dois minutos) que devem ser iniciadas sempre imediatamente após a inspiração pulmonar máxima, considerando-se o maior resultado obtido na série.
A utilização do PFE apresenta certas limitações como:
| ❏ |
Ser esforço-dependente |
| ❏ |
Não revelar a obstrução de pequenas vias aéreas |
| ❏ |
Ser difícil detectar o mau funcionamento do aparelho |
| ❏ |
Não substituir a espirometria para o diagnóstico inicial da asma |
| ❏ |
Não apresentar nenhuma contribuição na asma leve |
| ❏ |
Não apresentar nenhuma contribuição na asma leve |
| ❏ |
Uma má avaliação pelo paciente pode retardar a procura de cuidados médicos |
| ❏ |
Poder contribuir para a não aderência ao tratamento |
| ❏ |
Poder contribuir para a não aderência ao tratamento |
| ❏ |
A utilidade da variabilidade do PFE como teste diagnóstico é limitada pela baixa sensibilidade |
Para o cálculo da variabilidade diurna, o paciente deve medir o PFE imediatamente ao acordar, antes da utilização de qualquer broncodilatador, e à noite, após broncodilatador.
Deve utilizar sempre o mesmo medidor todas as vezes, pois o PFE pode variar em até 20% entre os diferentes medidores. Uma variabilidade maior que 20% em adultos e 30% em crianças é indicativa de asma.28

O PFE é importante em pacientes que são incapazes de perceber o agravamento da obstrução, ao contrário daqueles que percebem pequenas mudanças. O PFE é capaz de detectar uma crise em sua fase inicial, algumas horas antes do aparecimento dos sintomas, pois quando detectamos sibilância à ausculta, o PFE já caiu 20 a 25%. No entanto, um PFE < 50% do teórico (ou do melhor resultado do próprio paciente) representa severa obstrução. Todavia, para um paciente em que o melhor PFE é de 200 l/min, uma queda para 120 l/min (60% de seu melhor resultado) pode significar obstrução muito severa, com potencial risco de vida. Devem ser efetuadas quatro medidas diárias, distribuídas desde o despertar até a hora de deitar. Se acordar de madrugada ou apresentar sintomas durante o dia, novas medidas são efetuadas.29
 Técnica Correta para Medir o Pico de Fluxo Expiratório (PFE) Técnica Correta para Medir o Pico de Fluxo Expiratório (PFE)
A técnica para realizar as medidas do PFE deve incluir as seguintes etapas:
■ Antes de cada uso, certificar-se de que o ponteiro deslizante no medidor de fluxo de pico seja redefinido para a marca zero
■ O teste deve ser efetuado na posição de pé com o aparelho posicionado horizontalmente
■ O paciente deve executar uma inspiração máxima
■ Colocar o bocal do aparelho firme entre os lábios, para evitar fuga aérea. Não colocar a língua contra ou dentro do orifício
■ Soprar o mais forte e rápido possível, sem tossir, utilizando os músculos do tórax e abdome; isso não deve demorar mais do que dois segundos. A flexão ou extensão do pescoço devem ser evitadas
■ Anotar o resultado – observar o número em que o ponteiro deslizante parou na escala
■ Redefinir o ponteiro para o zero
■ Repetir três vezes. As três leituras devem estar próximas umas das outras. Se não, ajustar a técnica
■ Registrar apenas o maior dos três valores
➭ O número mais alto é chamado de pico de fluxo ou recorde pessoal
Tabelas com Valores de Referência para PFE em função do Sexo, Idade e Altura.
Tabela 5 – PFE: Valores de Referência para o Sexo Masculino - Idade (anos)/Altura (cm) - Limite Inferior da Normalidade em litros/min |
. |
5 |
8 |
11 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
55 |
60 |
65 |
70 |
75 |
80 |
85 |
| 100 |
24 |
24 |
24 |
| 105 |
51 |
51 |
51 |
| 110 |
77 |
77 |
77 |
| 115 |
104 |
104 |
104 |
| 120 |
130 |
130 |
130 |
| 125 |
156 |
156 |
156 |
| 130 |
183 |
183 |
183 |
| 135 |
209 |
209 |
209 |
| 140 |
236 |
236 |
236 |
414 |
456 |
481 |
494 |
499 |
497 |
491 |
480 |
467 |
452 |
436 |
418 |
400 |
381 |
362 |
| 145 |
262 |
262 |
262 |
423 |
466 |
491 |
504 |
509 |
508 |
501 |
491 |
477 |
462 |
445 |
427 |
408 |
389 |
370 |
| 150 |
289 |
289 |
289 |
432 |
475 |
501 |
514 |
519 |
518 |
511 |
500 |
487 |
471 |
454 |
436 |
417 |
397 |
378 |
| 155 |
315 |
315 |
315 |
440 |
484 |
510 |
524 |
529 |
527 |
520 |
510 |
496 |
480 |
463 |
444 |
425 |
405 |
385 |
| 160 |
342 |
342 |
342 |
448 |
492 |
519 |
533 |
538 |
536 |
530 |
519 |
505 |
489 |
471 |
452 |
432 |
412 |
392 |
| 165 |
368 |
368 |
368 |
456 |
500 |
527 |
542 |
547 |
545 |
538 |
527 |
513 |
497 |
479 |
460 |
440 |
419 |
399 |
| 170 |
394 |
394 |
394 |
463 |
508 |
535 |
550 |
555 |
554 |
546 |
535 |
521 |
504 |
486 |
467 |
447 |
426 |
405 |
| 175 |
421 |
421 |
421 |
469 |
515 |
543 |
558 |
563 |
561 |
554 |
543 |
528 |
512 |
493 |
474 |
453 |
432 |
411 |
| 180 |
. |
. |
. |
476 |
522 |
551 |
566 |
571 |
569 |
562 |
550 |
536 |
519 |
500 |
480 |
459 |
438 |
417 |
| 185 |
. |
. |
. |
482 |
529 |
558 |
573 |
578 |
576 |
569 |
557 |
543 |
525 |
506 |
486 |
465 |
444 |
422 |
| 190 |
. |
. |
. |
488 |
536 |
564 |
580 |
585 |
583 |
576 |
564 |
549 |
532 |
513 |
492 |
471 |
450 |
428 |
| Valores referentes ao Limite Inferior da Normalidade dos estudos de:
Crianças: Godfrey S et al. Bri J Dis Chest 1970; 64:15.
Adultos: Gregg I, Nunn AJ. BMJ 1989; 298:1068.
Limite de 90% de confiança. |
.
Tabela 6 – PFE: Valores de Referência para o Sexo Feminino - Idade (anos)/Altura (cm) -Limite Inferior da Normalidade em litros/min
|
|
5 |
8 |
11 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
55 |
60 |
65 |
70 |
75 |
80 |
85 |
| 100 |
39 |
39 |
39 |
|
| 105 |
65 |
65 |
65 |
| 110 |
92 |
92 |
92 |
| 115 |
118 |
118 |
118 |
| 120 |
145 |
145 |
145 |
| 125 |
174 |
171 |
171 |
| 130 |
197 |
197 |
197 |
| 135 |
224 |
224 |
224 |
| 140 |
250 |
250 |
250 |
348 |
369 |
380 |
384 |
383 |
379 |
371 |
362 |
352 |
340 |
328 |
316 |
302 |
289 |
276 |
| 145 |
276 |
276 |
276 |
355 |
376 |
387 |
391 |
390 |
385 |
378 |
369 |
358 |
347 |
334 |
321 |
308 |
294 |
281 |
| 150 |
303 |
303 |
303 |
360 |
382 |
393 |
397 |
396 |
391 |
384 |
375 |
364 |
352 |
340 |
327 |
313 |
300 |
286 |
| 155 |
329 |
329 |
329 |
366 |
388 |
399 |
403 |
402 |
397 |
390 |
381 |
370 |
358 |
315 |
332 |
318 |
304 |
290 |
| 160 |
356 |
356 |
356 |
371 |
393 |
405 |
409 |
408 |
403 |
396 |
386 |
375 |
363 |
350 |
337 |
323 |
309 |
295 |
| 165 |
382 |
382 |
382 |
376 |
398 |
410 |
414 |
413 |
408 |
401 |
391 |
380 |
368 |
355 |
341 |
327 |
313 |
299 |
| 170 |
408 |
408 |
408 |
381 |
403 |
415 |
419 |
418 |
413 |
406 |
396 |
385 |
372 |
359 |
346 |
331 |
317 |
303 |
| 175 |
435 |
435 |
435 |
385 |
408 |
420 |
424 |
423 |
418 |
411 |
401 |
389 |
377 |
364 |
350 |
335 |
321 |
307 |
| 180 |
. |
. |
. |
390 |
413 |
425 |
429 |
428 |
423 |
415 |
405 |
394 |
381 |
368 |
354 |
339 |
325 |
310 |
| 185 |
. |
. |
. |
394 |
417 |
429 |
433 |
432 |
427 |
419 |
409 |
398 |
385 |
372 |
358 |
343 |
328 |
314 |
| 190 |
. |
. |
. |
398 |
421 |
433 |
438 |
436 |
432 |
424 |
414 |
402 |
389 |
375 |
361 |
347 |
332 |
317 |
| Valores referentes ao Limite Inferior da Normalidade dos estudos de:
Crianças: Godfrey S et al. Bri J Dis Chest 1970; 64:15.
Adultos: Gregg I, Nunn AJ. BMJ 1989; 298:1068.
Limite de 90% de confiança. |
Embora existam inúmeros relatos de linearidade e precisão dos medidores de pico de fluxo30,31 em condições laboratoriais rigorosas, não há relatos de controle de qualidade ou durabilidade destes instrumentos no seu uso na prática clínica prolongada. Esses dispositivos, com cuidado, podem durar 3 anos ou mais. Para manutenção recomenda-se limpeza regular a cada duas semanas com água quente e detergente neutro, mas não com solução antisséptica. Evitar quedas ou choques, pois isso pode afetar a precisão dos valores obtidos nos testes.
Vários gases, como o óxido nítrico (NO), o monóxido de carbono (CO) e hidrocarbonetos têm sido medidos no ar exalado de adultos e crianças. Mais recentemente, marcadores não voláteis e mediadores (peróxido de hidrogênio, leucotrienos, prostaglandinas, citocinas, produtos de peroxidação de lipídios...) têm sido detectados no ar exalado e condensado. Estes marcadores exalados têm sido utilizados para monitorar a inflamação das vias aéreas e o estresse oxidativo na asma e na DPOC, assim como no acompanhamento da resposta terapêutica durante o tratamento com corticoides, modificadores de leucotrienos etc.
Em 1993, a asma foi a primeira doença a ser associada a níveis elevados de NO exalado, e desde então centenas de estudos foram efetuados tentando discernir o possível papel do NO na monitorização da doença, bem como o seu papel como molécula efetora.
O NO é um radical livre gasoso, com uma meia-vida extremamente curta, de alguns segundos. Na asma o NO é o teste de respiração exalada (FeNO) mais utilizado na prática clínica. Trata-se de um teste útil, prático, confortável, sensível, reprodutível, não-invasivo, e que apresenta forte correlação com a inflamação das vias aéreas.
Na atualidade os dispositivos para medir a FeNO empregam tecnologia mais moderna que utiliza leitura através de sensor eletroquímico que torna as leituras equivalentes àquelas obtidas com quimioluminescência. Ao contrário da geração anterior os novos aparelhos são mais compactos, portáteis, fáceis de manusear e de manter, mais rápidos e baratos. (Figura 9).
Os corticoides não têm efeito no NO exalado em indivíduos normais,32 porém reduzem a FeNO em asmáticos, principalmente naqueles com doença severa.33,34 Na asma atópica, níveis elevados exalados (bucal e nasal) de NO correlacionam-se de forma significativa com os testes cutâneos, a IgE total e a eosinofilia sanguínea. A FeNO é extremamente sensível ao tratamento com corticoides, sendo que a redução no NO pode ser detectada após 6 h de uma única dose de corticoide nebulizado, ou dentro de 2–3 dias após o tratamento com corticoide inalado.35-37 Níveis persistentemente elevados da FeNO em pacientes asmáticos tratados com corticoides refletem ou a pouca aderência do paciente ao tratamento ou um tratamento não eficaz.38,39
Recentemente o monóxido de carbono passou a ser utlizado também como um marcador da inflamação em pacientes com asma. Zayasu et al.40 efetuaram estudo em asmáticos sintomáticos não-fumantes e sem tratamento, antes e após a terapia com corticoide inalado. Um analisador de CO, com detector infravermelho (Bedfont EC50) com resolução de mais ou menos 1 ppm, foi utilizado para medir o gás exalado após 20 segundos de apnéia. Valores elevados foram encontrados em asmáticos não-tratados, com redução após terapêutica esteroide por inalação. Existe uma boa correlação entre a mudança no CO exalado (eCO) com as mudanças no percentual de eosinófilos no escarro sugerindo uma ligação entre um marcador já aceito da inflamação com eCO exalado. O CO eleva-se também durante as exacerbações da asma, retornando aos valores basais com o tratamento.41
Este teste apresenta limitações, como por exemplo, a interferência que ocorre quando de infecções respiratórias superiores, que se caracterizam por elevar o eCO.42
Outra técnica fisiológica é a oscilometria de impulso (IOS),
uma medida não invasiva das propriedades mecânicas do sistema respiratório, derivada da técnica de oscilação forçada (FOT) descrita por Dubois et al.43 em 1956, que avalia as mudanças na resistência das vias aéreas durante a respiração corrente, cuja técnica foi aperfeiçoada por investigadores como Peslin e Duvivier (Nancy)44 e Farré (Barcelona),45 sendo que em 1990 a técnica foi normatizada em um encontro em Antuérpia. Os impulsos geram oscilações de fluxo que se sobrepõem à ventilação espontânea (volume corrente) percorrendo toda a via aérea, permitindo analisar as respectivas respostas de variação de pressão e fluxo a estes impulsos.
Ao contrário das técnicas que usam os músculos respiratórios como fonte geradora de força, a oscilometria de impulso o faz através de um gerador externo de impulsos – um alto-falante para produzir oscilações de pressão dentro da via aérea, resultando na medição de mudanças de pressão e fluxos e cálculo de resistência, reatância e ressonância.
Na prática o doente respira ar ambiente através de um pneumotacógrafo acoplado ao alto-falante. Existem dois transdutores, um de fluxo total e outro de pressão bucal total conectados ao pneumotacógrafo que permitem o traçado em ventilação espontânea (0,2 a 5 Hz) e posterior curva fluxo/volume, e que se irão sobrepor aos sinais do impulso gerados separados da respiração espontânea por filtro de sinal (Figura 10).
Um impulso que consiste em uma mistura de ondas sonoras de diferentes frequências é gerado pelo alto-falante na boca. À medida que esta onda passa para os pulmões, ela causa mudanças na pressão, bem como no fluxo de ar. As frequências das ondas geradas no IOS variam de 5 a 30 Hz. Enquanto frequências superiores a 30 Hz podem causar desconforto ao paciente, os parâmetros medidos em < 5 Hz são influenciados pela dinâmica da respiração.
O teste de IOS tem a vantagem única por ser um teste de função pulmonar que não demanda manobras expiratórias forçadas, possibilitando exames para indivíduos pouco cooperativos ou frágeis, em crianças ou em pacientes com disfunção muscular respiratória.
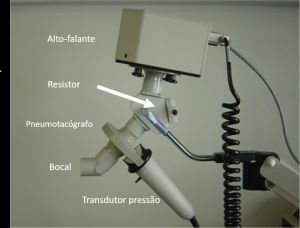 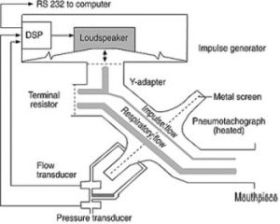
Figura 10 – Instrumentação básica utilizada na técnica da oscilometria de impulso. O diagrama foi retirado da referência 46.
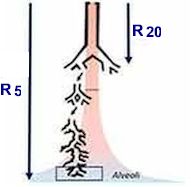 Desta forma obtém-se uma resistência respiratória complexa em função das frequências que se aplicam durante a respiração espontânea, que se denomina impedância respiratória (Z) e tem duas constituintes, a resistência (R) e a reatância (X). As medidas de resistência total e proximal das vias aéreas são obtidas em 5 e 20 Hertz (R5 e R20 (kPa·L-1 s -1)) respectivamente. Assim, a queda da resistência das vias aéreas a frequências de 5 a 20 Hz (R5–R20) expressa a dependência da frequência da resistência (DFR
(kPa·L-1 s -1)) e é considerada um índice para a resistência em pequenas vias aéreas.47,48 (Figura 11) Desta forma obtém-se uma resistência respiratória complexa em função das frequências que se aplicam durante a respiração espontânea, que se denomina impedância respiratória (Z) e tem duas constituintes, a resistência (R) e a reatância (X). As medidas de resistência total e proximal das vias aéreas são obtidas em 5 e 20 Hertz (R5 e R20 (kPa·L-1 s -1)) respectivamente. Assim, a queda da resistência das vias aéreas a frequências de 5 a 20 Hz (R5–R20) expressa a dependência da frequência da resistência (DFR
(kPa·L-1 s -1)) e é considerada um índice para a resistência em pequenas vias aéreas.47,48 (Figura 11)
Outra avaliação é da área de reatância (AX (kPa·L-1), medida composta de reatância de vias aéreas em frequências baixas representativa da complacência das vias aéreas periféricas e o seu aumento, portanto, é considerado um substituto para a obstrução das vias aéreas mais periféricas (< 2 mm) que não podem ser avaliadas por métodos convencionais visto que, não existindo praticamente fluxo aéreo nesta zona, também não são mensuráveis as resistências.48
Portanto, tem sido proposto que a IOS possa detectar comprometimento das vias aéreas periféricas em um estágio inicial e reproduza a elasticidade das vias aéreas periféricas.49,50 Com significado clínico tem-se ainda a resistência à frequência de 20 Hertz (R20) que corresponde à resistência central das vias aéreas.
Para se ter um exame válido tem de existir regularidade do registro do volume em função do tempo; o gráfico impedância/volume sem artefatos; a coerência (Co) a 5 Hertz acima de 0,7 e a 20 Hertz acima de 0,9.
A execução técnica é simples, demandando pouca cooperação, uma vez que não é necessária a realização de uma manobra específica pelo doente, permitindo ser realizada em crianças (> 2 anos), idosos, acamados, adultos com problemas de coordenação ou com déficits cognitivos. O traçado oscilométrico se obtém com colaboração mínima do doente que se traduz numa respiração espontânea calma e estável. O registro inicia-se quando o volume corrente está estabilizado e termina, em regra, após 30 segundos de bom traçado. A zona de bom traçado pode ser identificada e depois selecionada, sendo os valores dos parâmetros automaticamente calculados.
A oscilometria é especialmente útil na avaliação do paciente pediátrico e adultos fragilizados, naquelas crianças asmáticas incapazes de realizar manobras de espirometria satisfatórias. Pacientes com asma apresentam elevação de R5 enquanto a reatância costuma ser mais negativa. A R20 encontra-se aumentada na exacerbação da asma/broncospasmo. A redução de 30 a 35% em R5 é considerada resposta significativa após broncodilatador.
Sua utilização na prática clínica ainda é limitada pois depende de valores de referência ainda não disponíveis. A literatura atualmente disponível que fornece valores de referência e equações para medidas de impedância respiratória em adultos é limitada. Até que estudos padronizados em maior escala estejam disponíveis, a escolha das equações de predição deve ser baseada em um conjunto de dados que melhor represente a população-alvo de pacientes e a modalidade em uso em cada laboratório de fisiologia pulmonar.51 O estudo mais recente e amplo inclui vários centros e vários equipamentos de oscilometria atualmente disponíveis.52
Referências
01.Macklem PT. Mechanical factors determining maximum bronchoconstriction. Eur Respir J 1989; 2 (Suppl):516-9. 02.Macklem PT. The clinical relevance of respiratory muscle research. Am Rev Respir Dis 1986; 134:812-5.
03.Macklem PT. The importance of excessive bronchoconstriction in asthma. Giorn It Allergol Immunol Clin 1992; 2:275.
04.
Blackie SP, al-Majed S, Staples CA, Hilliam C, Paré PD. Changes in total lung capacity during acute spontaneous asthma. Am Rev Respir Dis 1990; 142:79-83.
05.Woolcock AJ, Read J. The static elastance properties of the lungs in asthma. Am Rev Respir Dis 1968; 98:788-94.
06.Hillman DR, Finucane KE. The effect of hyperinflation on the lung elasticity in healthy subjects. Respir Physiol 1983; 54:295-305.
07.Muller N, Bryan AC, Zamel N. Tonic inspiratory muscle activity as a cause of hyperinflation in histamine-induced asthma. J Appl Physiol 1980; 49:869-74.
08.Muller N, Bryan AC, Zamel N. Tonic inspiratory muscle activity as a cause of hyperinflation in asthma. J Appl Physiol 1981; 50:279-82.
09.Ward ME, Roussos C, Macklem PT. Respiratory mechanics, in Murray JF, Nadel JA (eds): Textbook of Respiratory Medicine, 2d ed. Philadelphia, Saunders, 1994, pp 90-138.
10.Gold WM, Kaufman HS, Nadel JA. Elastic recoil of the lungs in chronic asthmatic patients before and after therapy. J Appl Physiol 1967; 23:433-8.
11.Hohlfeld JM, Ahlf K, Enhorning G, Balke K, Erpenbeck VJ, Petschallies J, Hoymann HG, Fabel H, Krug N.
Dysfunction of pulmonary surfactant in asthmatics after segmental allergen challenge. Am J Respir Crit Care Med 1999; 159:1803-9.
12.van de Graaf EA, Jansen HM, Lutter R, Alberts C, Kobesen J, de Vries IJ, Out TA.
Surfactant protein A in bronchoalveolar lavage fluid. J Lab Clin Med 1992; 120:252-63.
13.McFadden ER Jr, Lyons HA. Arterial-blood gas tension in asthma. N Engl J Med 1968; 278:1027-32.
14.Hypoxemia and hypocapnia in asthma. N Engl J Med 1968; 248:1068.
15.Jamison JP, Glover PJ, Wallace WE. Comparison of the effects of inhaled ipratropium bromide and salbutamol on the bronchoconstrictor response to hypocapnic hyperventilation in normal subjects. Thorax 1987; 42:809-14.
16.Reynolds AM, McEvoy RD. Tachykinins mediate hypocapnia-induced bronchoconstriction in guinea pigs. J Appl Physiol 1989; 67:2454-60.
17.Lindeman KS, Croxton TL, Lande B, et al. Hipocapnia induced contraction of porcine airway smooth muscle. Eur Respir J 1998; 12:1046-1052.
18.Sterling GM. The mechanism of bronchoconstriction due to hypocapnia in man. Clin Sci 1968; 34:277-285.
19.Laffey JG, Kavamagh BP. Hypocapnia. N Engl J Med 2002; 347:43-53.
20.van den Elshout FJ, van Herwaarden CL, Folgering HT. Effects of hypercapnia and hypocapnia on respiratory resistence in normal and asthmatic subject. Thorax 1991; 46:28-32.
21.O'Cain CF, Hensley MJ, McFadden ER Jr, Ingram RH Jr. Pattern and mechanism of airway response to hypocapnia in normal subjects. J Appl Physiol 1979; 47:8-12.
22.Molfino NA, Nannini LJ, Martelli AN, Slutsky AS. Respiratory arrest in near-fatal asthma. N Engl J Med 1991; 324:285-5.
23.Wasserfallen JB, Schaller MD, Feihl F, Perret CH. Sudden asphyxic asthma: a distinct entity? Am Rev Respir Dis 1990; 142:108-11.
24.Mountain RD, Heffner JE, Brackett NC, Shann SA. Acid-base disturbances in acute asthma. Chest 1990; 98:651-5.
25.Palmer K, Diamant ML. Effect of salbutamol on spirometry and blood-gas tensions in bronchial asthma. Br Med J 1969; 1:31-2.
26.Tiffeneau R: Mesure de la sensibilité pulmonaire à l'acetylcoline et a l' histamine. In cie Me Ed, ed. Examen pulmonaire de l'asthatique: Deductions, diagnostiques, prognostiques, et yherapeutiques, vol 55. Paris, France Libraries de L'Academie de Medicine, 1997; p75.
27.Paggiaro PL, Moscato G, Giannini D, Di Franco A, Gherson G. Relationship between peak expiratory flow (PEF) and FEV 1. Eur Respir J 1997;
Suppl. 1997 Feb;24:39S-41S. PMID: 9098708.
28.Jamison JP, McKinley RK. Validity of peak expiratory flow rate variability for diagnosis of asthma. Clin Sci (Lond) 1993; 85:367-71.
29.Jansen JM, Plotkowski LM, Bohadana AB. Controle domiciliar de “peak-flow”. JBM 1982; 42:122.
30.Shapiro SM, Hendler JM, Ogirala RG, Aldrich TK, Shapiro MB. An evaluation of the accuracy of assess and miniWright peak flowmeters. Chest 1991; 99:358-362.
31.Jackson AC. Accuracy, reproducibility, and variability of portable peak flow meters. Chest 1995; 107:648-651.
32.Yates DH, Kharitonov AS, Robbins RA, Thomas OS, Barnes PJ. Effect of a nitric oxide synthase inhibitor and a glucocorticosteroid on exhaled nitric oxide. Am J Respir Crit Care Med 1995; 152:892-6.
33.Baraldi E, Dario C, Ongaro R, Scollo M, Azzolin NM, Panza N, Paganini N, Zacchelo F. Exhaled nitric oxide concentrations during treatment of wheezing exacerbation in infants and Young children. Am J Respir Crit Care Med 1999; 159:1284-8.
34.Baraldi E, Azzolin NM , Zanconato S, Dario C, Zacchello F. Corticosteroids decrease exhaled nitric oxide in children with acute asthma. J Pediatr 1997; 131:381-5.
35.Kharitonov SA, Yates DH, Barnes PJ. Inhaled glucocorticosteroids decrease nitric oxide in exhaled air of asthmatics patients. Am J Respir Crit Care Med 1996; 153:454-7.
36.Kharitonov SA, Yates DH, Chung KF, Barnes PJ. Changes in the dose of inhaled steroid affect exhaled nitric oxide levels in asthmatic patients. Eur Respir J 1996; 9:196-201.
37.Kharitonov SA, Donnelly LE, Corradi M, Montuschi P, Barnes PJ. Dose-dependent onset and duration of action of 100/400 mcg budesonide on exhaled nitric oxide and related changes in other potential markers of airway inflammation in mild asthma. Am J Respir Crit Care Med 1996 2000; 161:A186.
38.Artlich A, Bush T, Lewandowski K, Jonas S Gortner L, Falke KJ. Childhood asthma: exaled nitric oxide in relation to clinical symptoms. Eur Respir J 1999; 13:1396-401.
39.Strling RG, Kharitonov SA, Campbell D, Robinson DS, Durham B, Chung KF, Barnes PJ. For the Asthma and Allergy Group. Increase in exhaled nitric oxide levels in patients with difficult asthma and correlation with symptoms and disease severity despite treatment with oral and inhaled corticost e roids. Thorax 1998; 53:1030-4.
40.
Zayasu K, Sekizawa K, Okinaga S, Yamaya M, Ohrui T, Sasaki H.
Increased carbon monoxide in exhaled air of asthmatic patients. Am J Respir Crit Care Med 1997; 156:1140-3.
41.
Uasuf CG, Jatakanon A, James A, Kharitonov SA, Wilson NM, Barnes PJ.
Exhaled carbon monoxide in childwood asthma. J Pediatr 1999; 135:569-74.
42.
Yamaya M, Sekizawa K, Ishizuka S, Monma M, Mizuta K, Sasaki H.
Increased carbon monoxide in exhaled air of subjects with upper respiratory tract infections. Am J Respir Crit Care Med 1998; 158:311-14.
43.DuBois AB, Brody AW, Lewis DH, Burgess BF. Oscillation mechanics of lungs and chest in man. J Appl Physiol 1956; 8:587-94.
44.Peslin R, Fredberg JJ. Oscilation mechanics of the respiratory system. In: Macklem PT, Mead J eds. Handbook of Physiology: The Respiratory System. Betesda, America, Physiological Society, 1986; pp. 145-178.
45.Farré R, Peslin R, Oostven E, Suki B, Duvivier C, Navajas D. Human respiratory impedance from 8 to 256 Hz corrected for upper airway shunt. J Appl Pfysiol 1989;67:1973-1981.
46.Smith HJ, Reinhold P, Goldman MD. Forced oscillation technique and impulse oscillometry. In:Gosselinl R, and Stam H eds. Lung Function Testing. Eur Respir Mon 2005, 31, 72–105.
47.
Foy BH, Soares M, Bordas R, Richardson M, Bell A, Singapuri A, Hargadon B, Brightling C, Burrowes K, Kay D, Owers-Bradley J, Siddiqui S. Lung Computational Models and the Role of the Small Airways in Asthma. Am J Respir Crit Care Med 2019; 200:982-991.
48.Abdo M, Kirsten AM, von Mutius E, Kopp M, Hansen G, Rabe KF, Watz H, Trinkmann F, Bahmer T; ALLIANCE study group. Minimal clinically important difference for impulse oscillometry in adults with asthma. Eur Respir J 2023 May 5;61(5):2201793.
49.Desiraju K, Agrawal A. Impulse oscillometry: the state-of-art for lung function testing. Lung India 2016;33:410-416.
50.Galant SP, Komarow HD, Shin HW, Siddiqui S, Lipworth BJ. The case for impulse oscillometry in the management of asthma in children and adults. Ann Allergy Asthma Immunol 2017;118:664-671.
51.Kalchiem-Dekel O, Hines SE. Forty years of reference values for respiratory system impedance in adults: 1977-2017. Respir Med 2018;136:37-47.
52.Oostveen E, Boda K, van der Grinten CP, James AL, Young S, Nieland H, Hantos Z. Respiratory impedance in healthy subjects: baseline values and bronchodilator response. Eur Respir J 2013;42: 1513-23.
53.Porojan-Suppini N, Fira-Mladinescu O, Marc M, Tudorache E, Oancea C. Lung Function Assessment by Impulse Oscillometry in Adults. Ther Clin Risk Manag. 2020;16:1139-1150.
|